
今回からはこれに\(\rm{O}\)が加わります!
\(\rm{O}\)が加わることで,反応の幅が一気に広がり難しくなりますが,考え方は変わりません!
原子や電子の感情を考えながら電子の動きを理解することが本質を理解する近道となります!
それでは今日はアルコールについて学習を進めていきましょう!
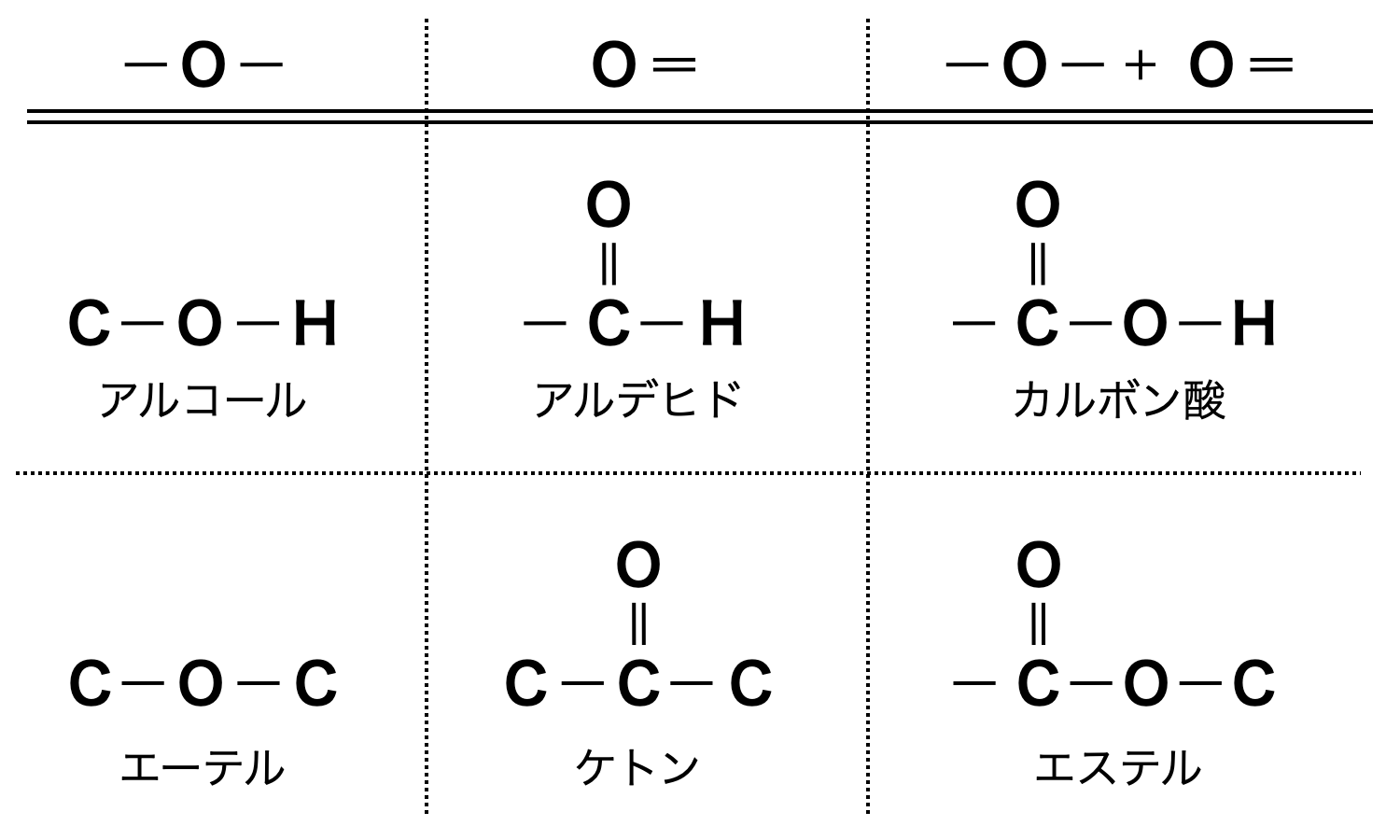
まず,\(\rm{C \cdot H \cdot O}\)が含まれる物質の中で\(\rm{O}\)原子は\(\ \rm{-O-}\ \)と\(\ \rm{O=}\ \)の\(\rm{2}\)種類で結合しています.
そして\(\rm{C}\)と\(\rm{H}\)の違いによって下のような官能基があります.
ここで全体像を掴むようにしてくださいね!
アルコールとは?
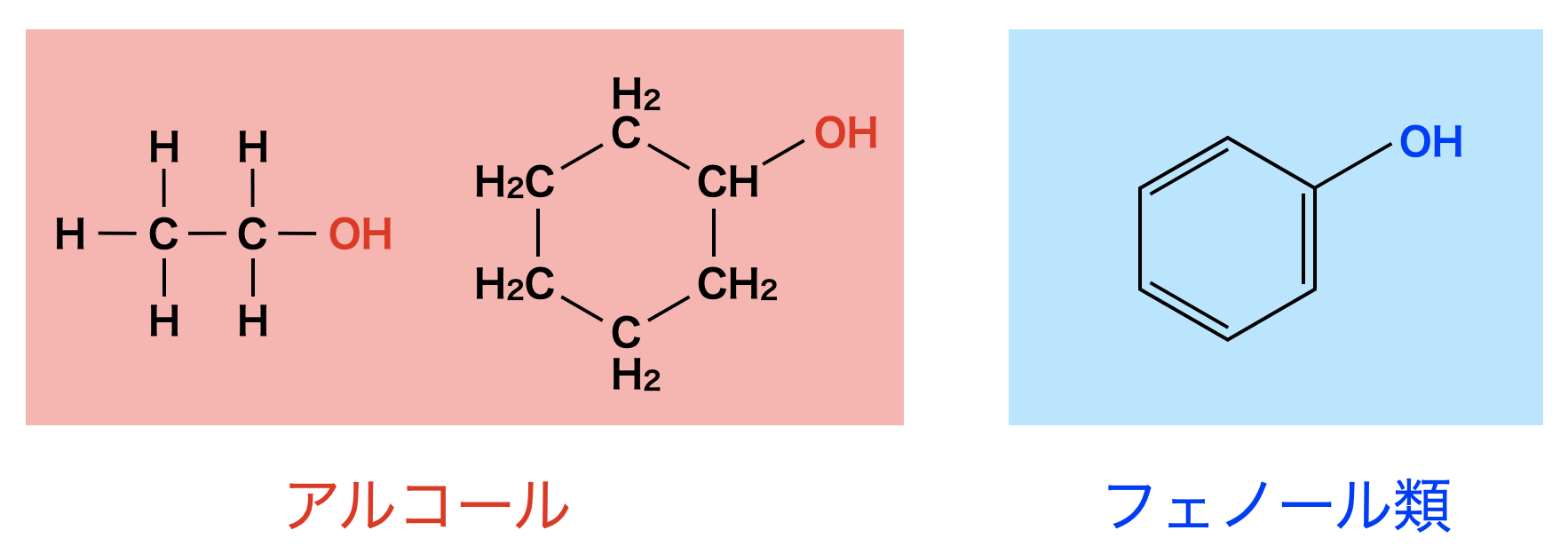
アルコールとは,炭化水素の\(\rm{H}\)原子を\(\rm{-OH}\)(ヒドロキシ基)で置換した化合物です.
ベンゼン環の\(\rm{H}\)原子を\(\rm{-OH}\)(ヒドロキシ基)で置換したものはアルコールと性質が異なるので,アルコールと言わずにフェノール類といいます.
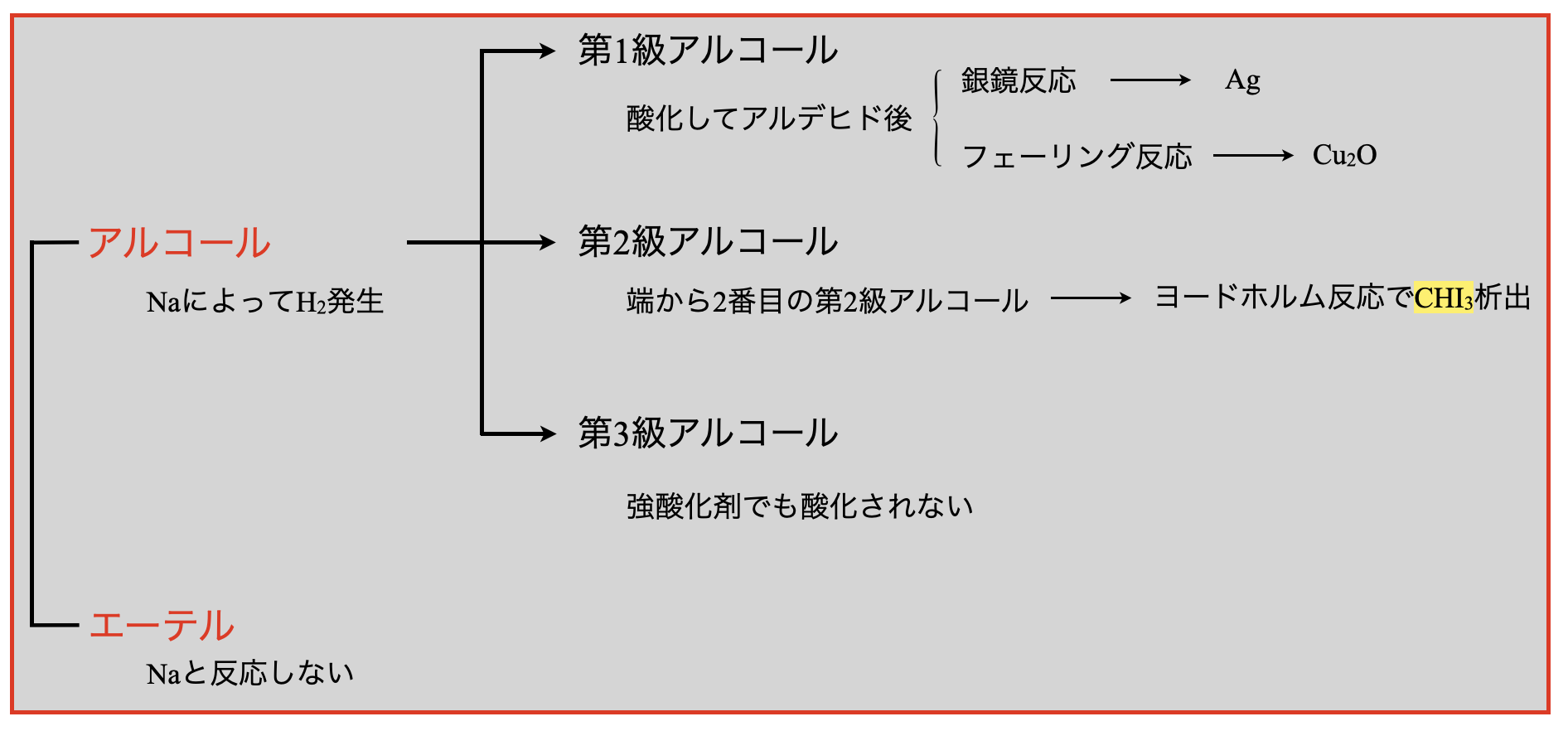
アルコールの分類
アルコールは,
① \(1\)分子中の\(\rm{OH}\)基の数
② \(\rm{OH}\)基の結合した\(\rm{C}\)原子のアルキル基の数
③ 分子量
の\(3\)通りで分類されます.
それぞれ\(1\)つずつみていきましょう.
① \(1\)分子中の\(\rm{OH}\)基の数
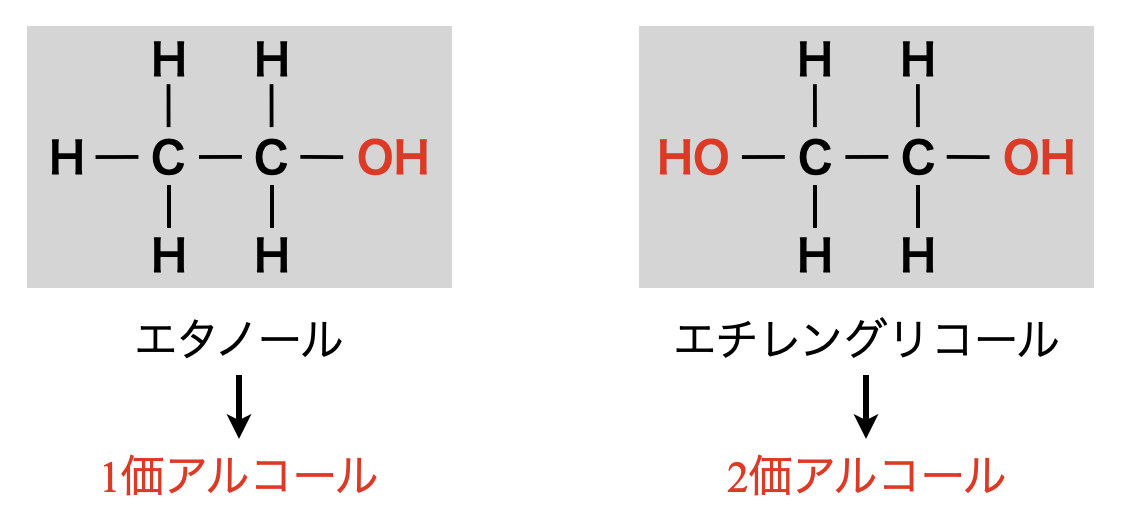
\(1\)分子中の\(\rm{OH}\)基の数を価数と呼びます.\(1\)分子中の\(\rm{OH}\)基の数が\(1\)個であるものを\(1\)価アルコール,\(2\)個であるものを\(2\)価アルコール,\(3\)個であるものを\(3\)価アルコールといいます.
② \(\rm{OH}\)基の結合した\(\rm{C}\)原子のアルキル基の数
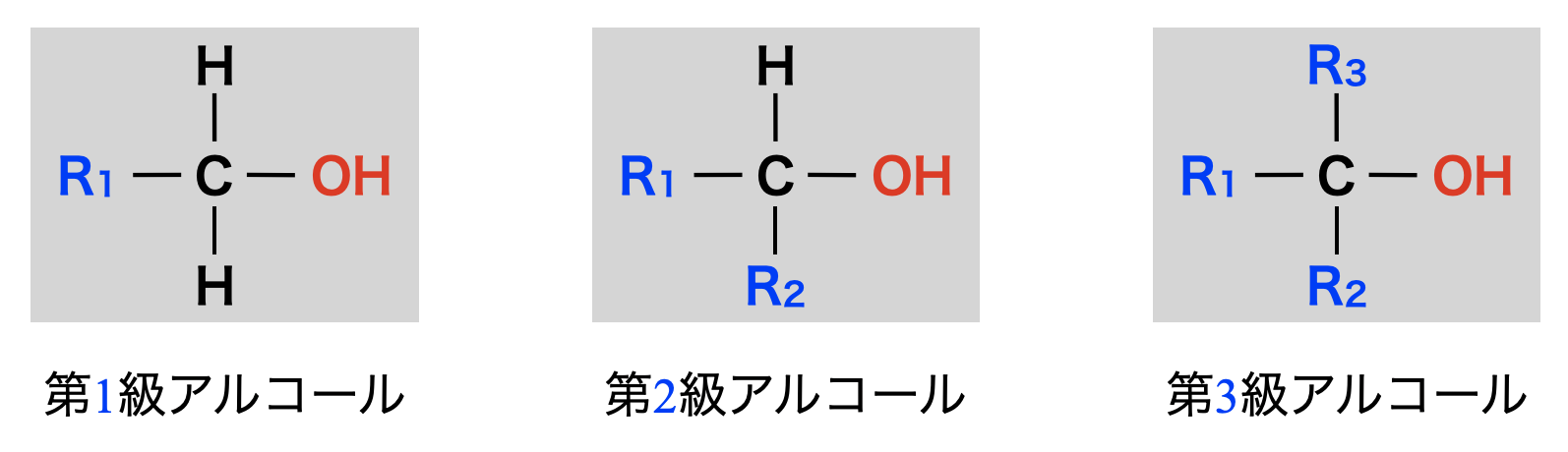
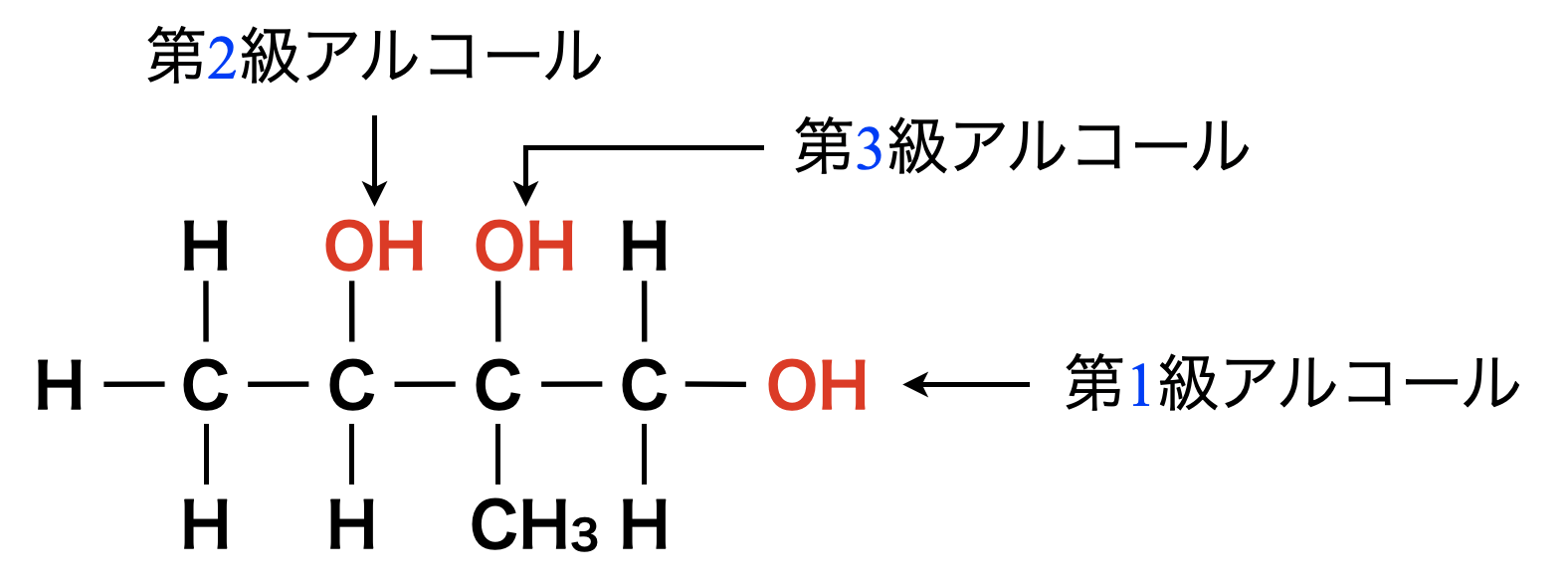
\(\rm{OH}\)基の結合した\(\rm{C}\)原子のアルキル基の数を級数といいます.つまり,\(\rm{OH}\)基の結合した\(\rm{C}\)原子に何個\(\rm{R}\)が含まれているかが級数となります.
\(\rm{R}\)の数が\(1\)個であるものを第\(1\)級アルコール
\(\rm{R}\)の数が\(2\)個であるものを第\(2\)級アルコール
\(\rm{R}\)の数が\(3\)個であるものを第\(3\)級アルコール
と分類します.
アルカンから\(\rm{H}\)原子を\(1\)つ除いた残りの原子団のことをアルキル基といいます.この記事でも\(\rm{R}\)として表しています.
具体例で少し見てみましょう!下のような図でどこに\(\rm{OH}\)基がついたときに第◯級アルコールであるのかを理解できるようにしておきましょう!
③ 分子量
分子量の大きなアルコールを高級アルコールといいます.
特に,②の第◯級アルコールを使うので,これをしっかりと押さえてくださいね!
物理的性質
\(\rm{-O-}\)が\(1\)つという点でアルコールとエーテルは似ています.まずは,これらの沸点を比較してみましょう.
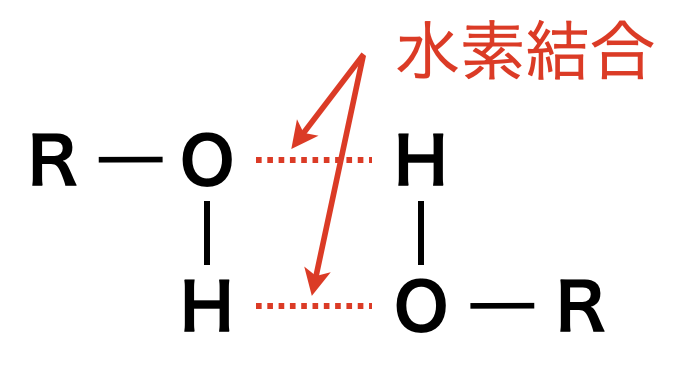
アルコールは分子間で水素結合をすることができますが,エーテルはできません.そのため,同一分子式なら水素結合ができるアルコールの方が,エーテルよりも沸点が高くなります.
沸点:アルコール > エーテル
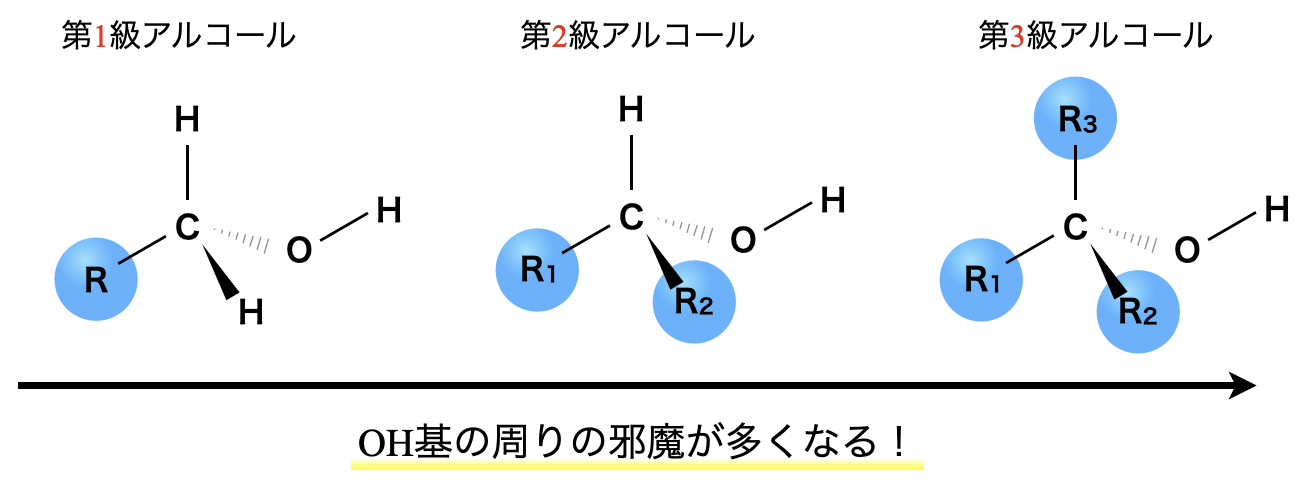
また同一分子式のアルコールの場合,級数が大きくなるほど,水素結合への立体的な障害が増すため,沸点は低くなります.
沸点:第\(1\)級アルコール > 第\(2\)級アルコール > 第\(3\)級アルコール
さらに同一級数のアルコールでは,枝分かれがあるものとないものとでは沸点が異なります.
沸点:直鎖 > 分枝状(=枝分かれあり)となります.
下の例で確認してみましょう!
分子式\(\rm{C_4H_{10}O}\)のアルコールの沸点順位は?
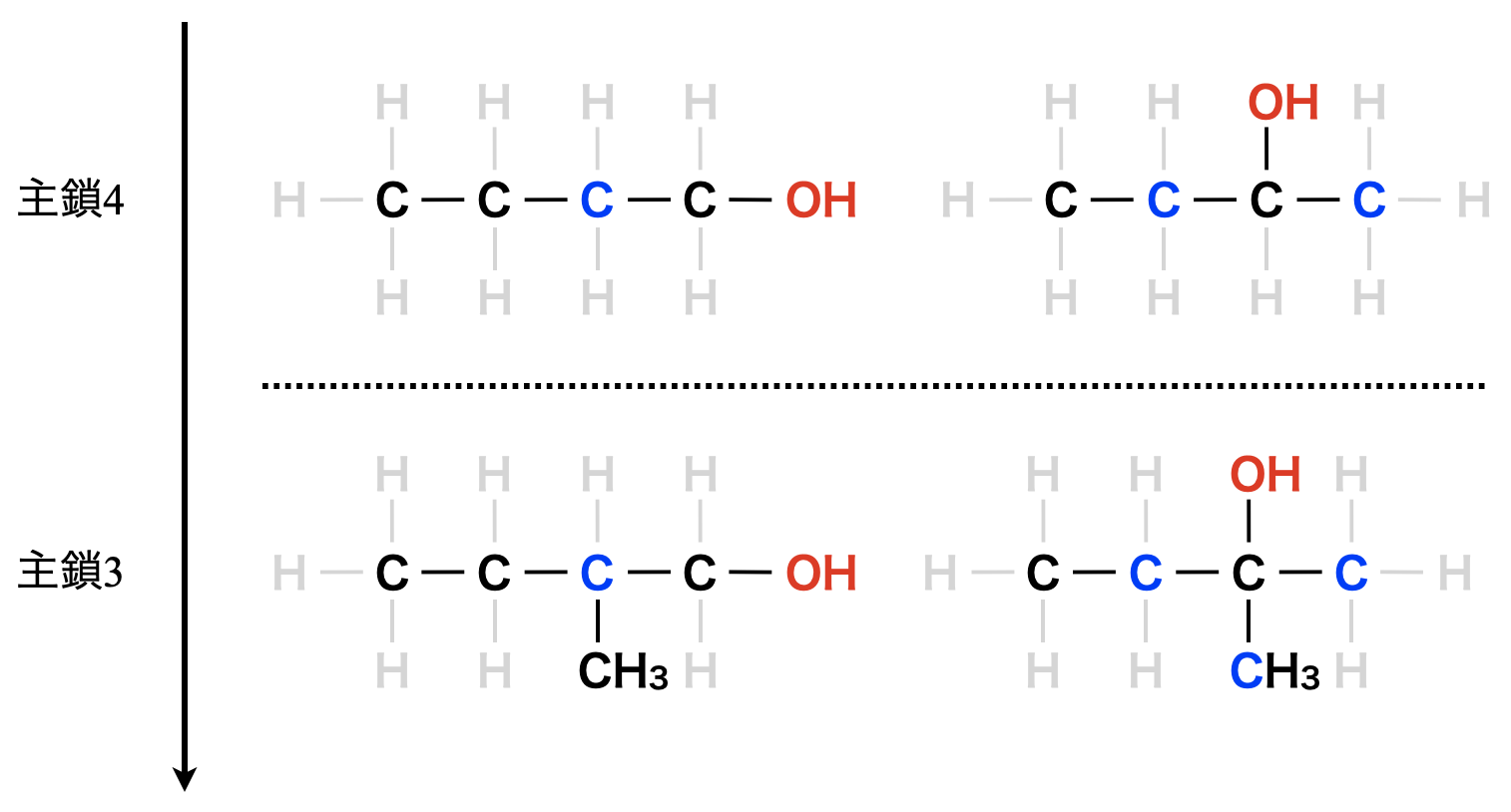
直鎖第\(1\)級アルコール > 分枝状第\(1\)級アルコール > 第\(2\)級アルコール > 第\(3\)級アルコール
の順になります.
化学的性質
アルコールの\(\rm{OH}\)基は,ごくわずかに水中で電離します.その電離で生じる\(\rm{H^+}\)は,\(\rm{H_2O}\)の電離によって生じる量よりも少ないので,アルコールは中性物質です.アルコールの官能基には2つあります.
・ヒドロキシ基→親水性(=水に溶けやすい性質)
・アルキル基→疎水性(=水に溶けにくい性質)
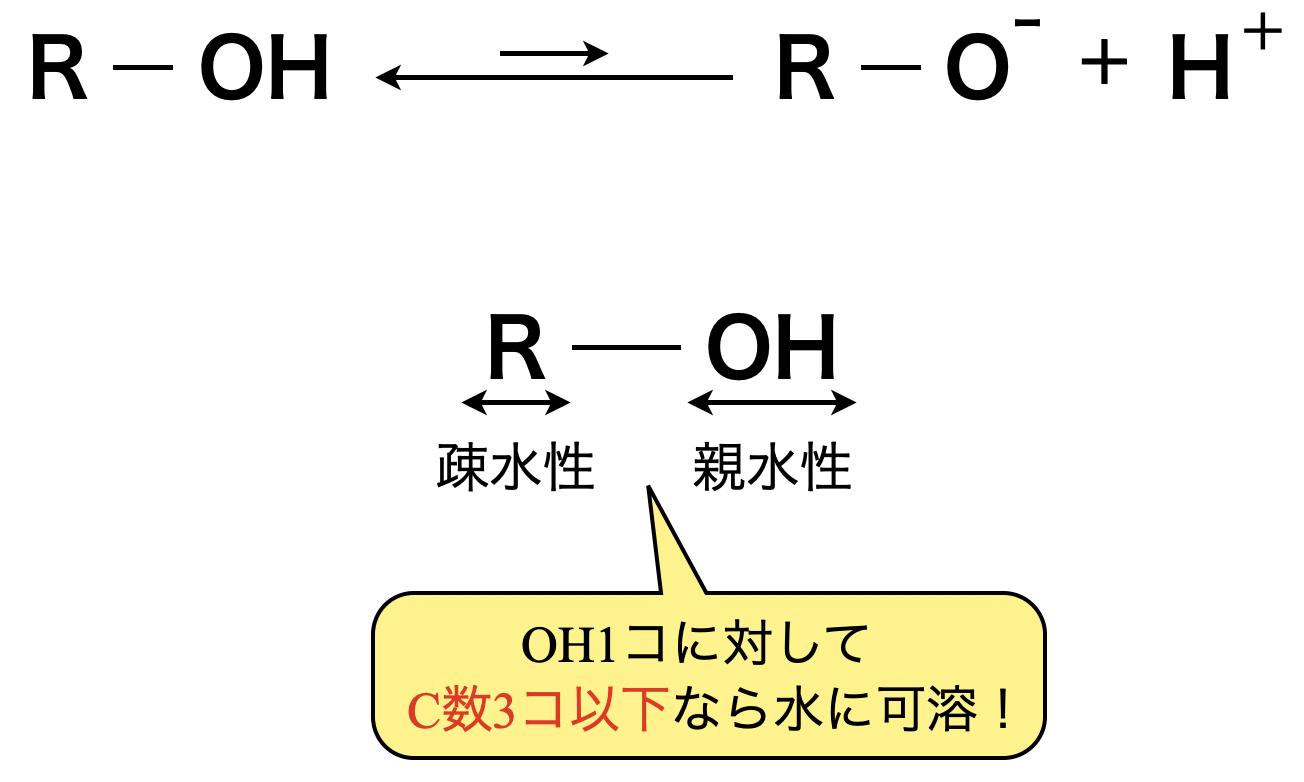
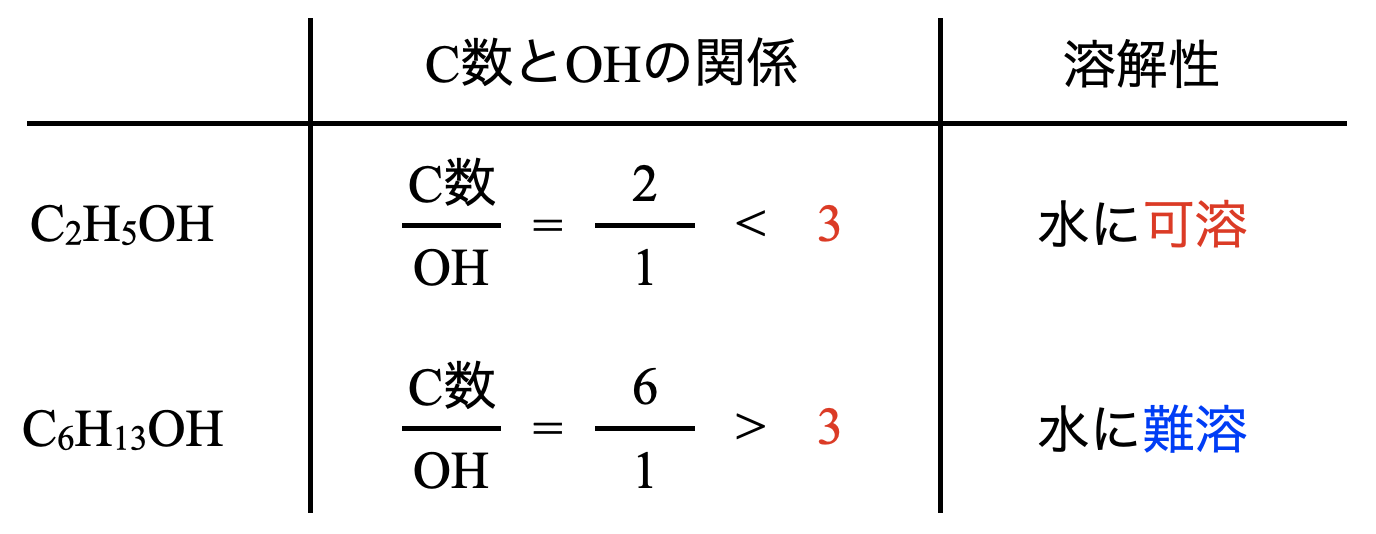
アルコールは\(\rm{OH}\)基\(1\)個に対して\(\rm{C}\)数が\(3\)個以下ならヒドロキシ基の親水性が勝ち,水に溶けます!
この関係性は必ず覚えてくださいね!
アルコールの反応
アルコールには\(\pi\)結合はなくすべて\(\sigma\)結合からできています.有機化学反応は,結合の切断→再生の順で考えていくのですが,結合の切断の部分がわかりやすくなるように,アルコールの結合を「電子式」で記すのがコツです!
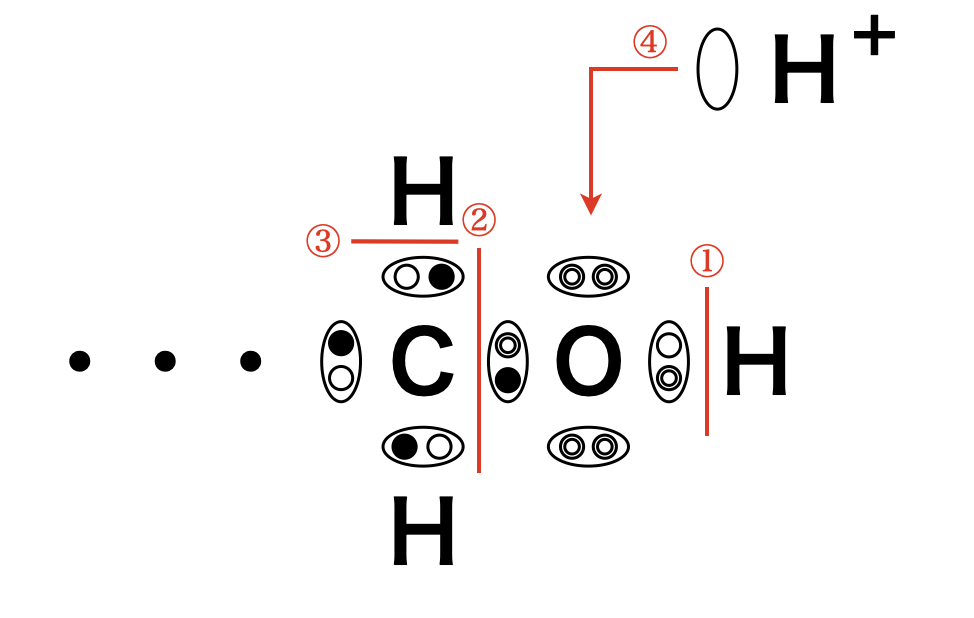
ただこれらの結合は全て同じではなく,「ひび割れ」しているものがあります.
そこでポーリングの定義による電気陰性度について考えてみましょう!\(\rm{C \cdot H \cdot O}\)の電気陰性度の値を記すと,次のようになります.
\(\rm{O:3.5,C:2.5,H:2.1}\)
この電気陰性度の値の差が大きいほど,結合に「ひび割れ」が生じやすくなります.これらの値をもとに考えると「ひび割れ」結合が\(3\)種類あり,そのひび割れ度は次のようになっています.
\(\rm{O-H > O-C > C-H}\)
また\(\rm{O}\)原子上に「暇な」電子対(非共有電子対)が\(2\)対あります.アルコールと反応するためには,これらのひび割れにつけ込むか,暇な電子対に誘いをかけるしかありません.ただ,「ひび割れ」といっても\(\sigma\)結合であるためそんなに簡単には反応しません.そのため強烈な試薬(強酸・強塩基・強酸化剤・強還元剤)を使う必要があります.
以下では,起こりそうな反応について詳しくみていきます!
・\(\rm{O-H}\)結合の切断→金属\(\rm{Na}\)との反応
・\(\rm{O-C}\)結合の切断→アルコールの脱水反応
・\(\rm{C-H}\)結合の切断→強酸化剤との反応
\(\rm{O-H}\)結合の切断
\(\rm{O-H}\)結合の切断は,①の結合を切断することを意味しています.アルコール分子中では\(\rm{O-H}\)結合が最も電気陰性度の差が大きく,結合が切断しやすくなります.しかし,実際には\(\rm{H_2O}\)中の\(\rm{O-H}\)結合より結合が切れにくいため,\(\rm{H_2O}\)の電離反応よりアルコールの電離反応の方が起こりにくくなります.
そのため,アルコールの\(\rm{O-H}\)結合を切って反応させるためには,金属\(\rm{Na}\)のような強還元剤で反応させることで,やっとこさ反応させることができます.

このアルコールと強還元剤である金属\(\rm{Na}\)との反応は,アルコールとエーテルとの区別に応用することができます.
電離のしやすさを考えるためには,電離定数\(K_{\rm{a}}\)を考えると良いです!この電離定数が大きいほど\(\rm{H^+}\)が電離しやすくなることがわかりますね!
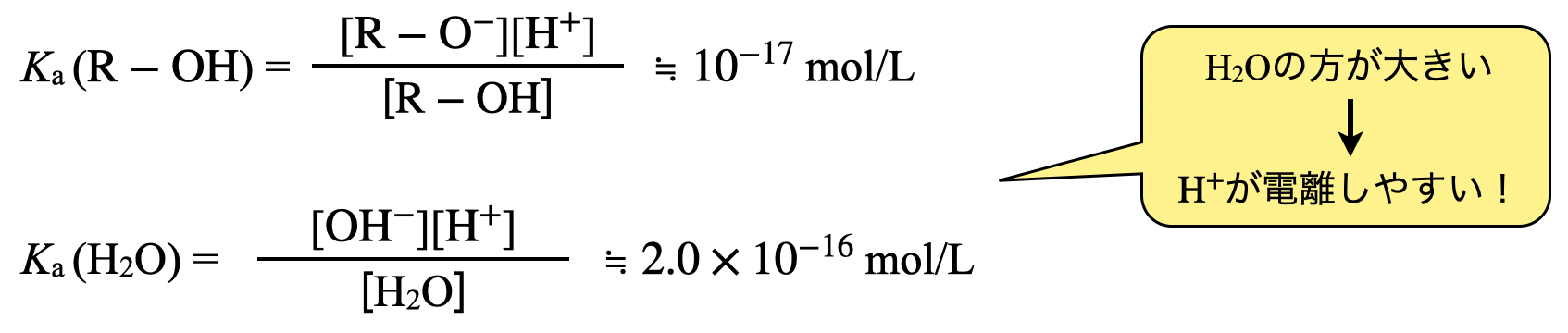
\(\rm{O-C}\)結合の切断
次は,\(\rm{O-C}\)結合の切断です!
\(\rm{O-C}\)結合の切断は\(\rm{O-H}\)結合よりも切断しにくいため,アルコールに\(\rm{H^+}\)を結合させることで\(\rm{O-H}\)結合を切断させます.これは,②+④の組み合わせによる反応となっていて,アルコールの脱水反応です.脱水反応とは,ヒドロキシ基から\(\rm{H_2O}\)をぬく反応のことをいいます!
まずこの反応のプロセスから説明していきましょう!
まず,アルコールのもつ\(\rm{OH}\)基の\(\rm{O}\)原子の非共有電子対に\(\rm{H^+}\)イオンが配位結合すると,\(\rm{O}\)原子が\(\delta ^+\)に帯電します.(\(\rm{O}\)原子の暇そうにしている電子対に対して攻撃!)陰性の強い\(\rm{O}\)原子は,\(\delta ^+\)を嫌って,隣の\(\rm{C}\)原子から電子を激しく奪って②の結合が切れます.最終的に\(\rm{H_2O}\)が脱離することで,カチオン(陽イオン)が生成します.

先ほども説明したようにこの反応を起こすためには,\(\rm{H^+}\)イオンを結合させる必要があり,この\(\rm{H^+}\)イオンの供給先として,濃\(\rm{H_2SO_4}\)を使います.
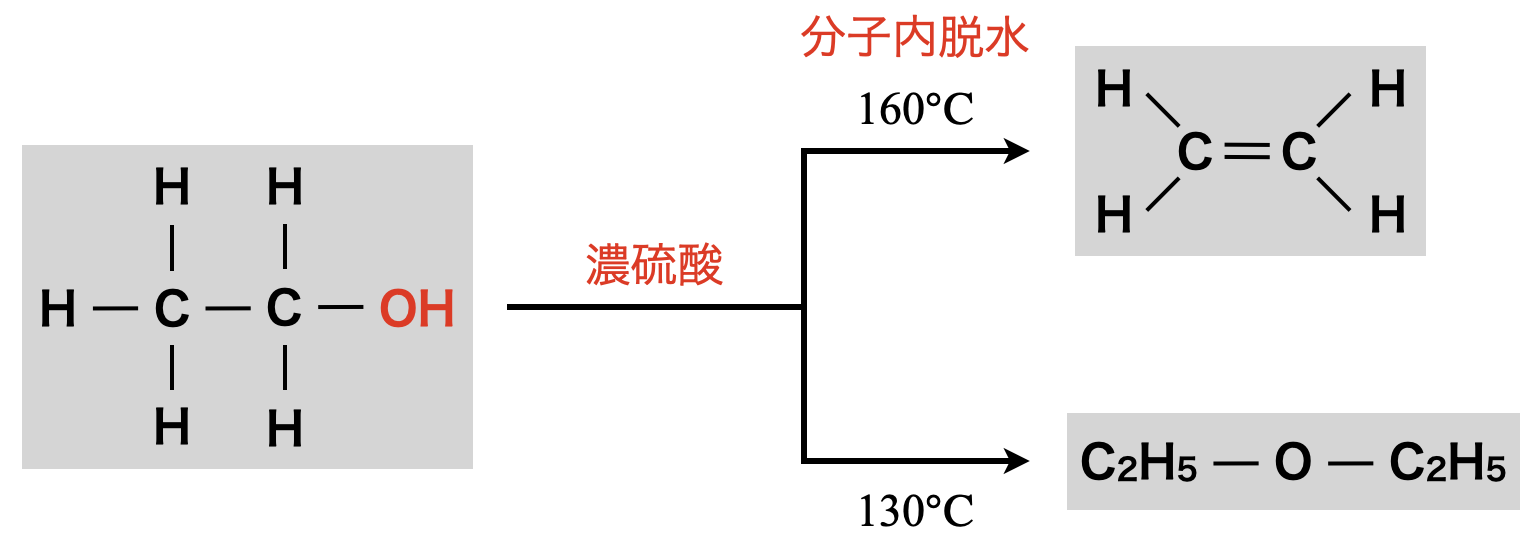
そして,このカチオンが最終的にどのように反応するのかで\(2\)通りあります.
①エーテル生成
約\(\rm{130^\circ C}\)〜\(\rm{140^\circ C}\)で反応させると,カチオンに別のアルコールの\(\rm{OH}\)基の\(\rm{O}\)原子の非共有電子対が攻撃します!ここでの反応のイメージとしては,\(\rm{C}\)原子の「すきま」を非共有電子対で「うめる」という,「すきま・うめます」反応として覚えましょう!最終的には,\(\rm{O}\)原子が\(\delta ^+\)に帯電するのを嫌い,\(\rm{OH}\)基の\(\rm{H}\)が\(\rm{H^+}\)として脱離し,エーテルが生成されます.
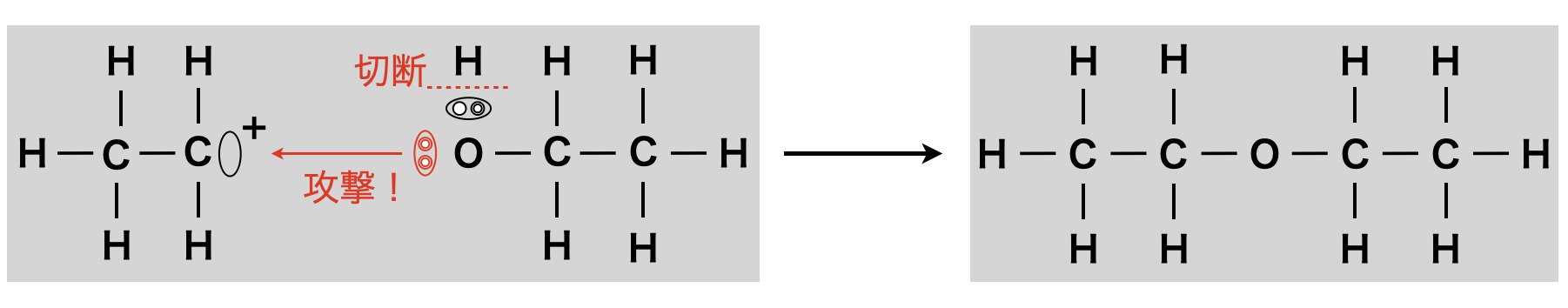
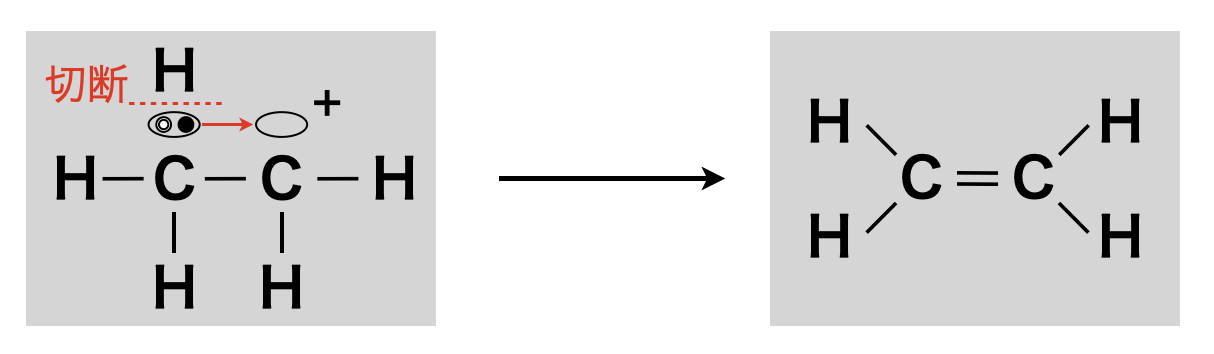
②アルケン生成
約\(\rm{160^\circ C}\)〜\(\rm{170^\circ C}\)で反応させると,\(+\)電荷をもった\(\rm{C}\)原子が隣の\(\rm{C}\)原子の\(\rm{H}\)原子から電子を奪って\(\rm{H^+}\)が脱離し,最終的にはアルケンが生成します.
上の\(2\)つの反応をまとめると,下の図のようになります.
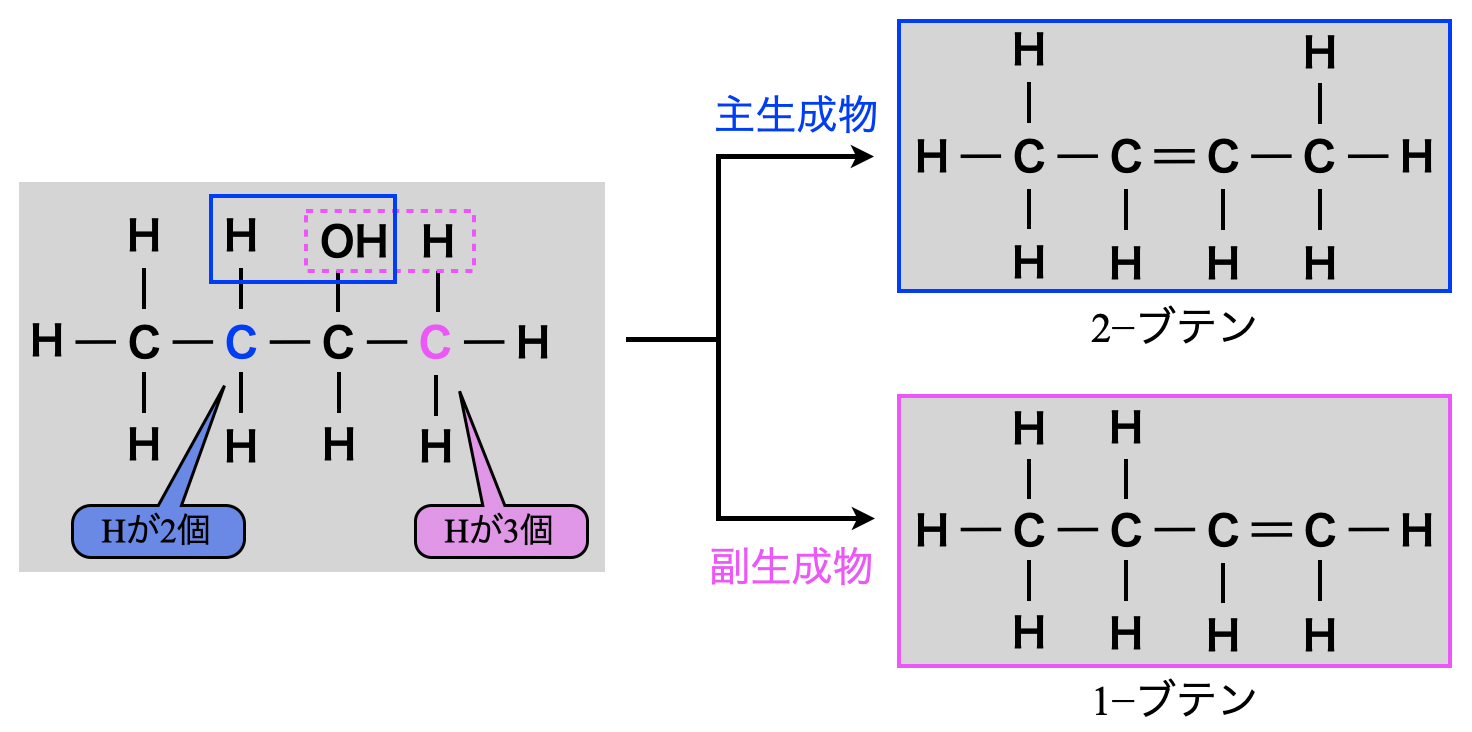
ザイツェフ則とは,アルコールの分子内脱水についての経験則です.
アルコールの分子内脱水では,\(\rm{-OH}\)基の結合した\(\rm{C}\)原子の両隣の\(\rm{C}\)原子のうち,\(\rm{H}\)原子の数の少ない方から\(\rm{H}\)原子が優先的に失われ,主生成物となるものです.
\(\rm{C-H}\)結合の切断
次に\(\rm{C-H}\)結合の切断です.
アルコール中の①・③のいずれの結合も\(\sigma\)結合からできているので,切断しにくいです.そのため電子を奪う能力に長けた\(\rm{K_2Cr_2O_7}\)(二クロム酸カリウム)や\(\rm{KMnO_4}\)(過マンガン酸カリウム)などの強酸化剤を用いることで,①や③の\(\rm{C-H}\)結合をなんとか切断します.
以下のように反応プロセスを理解すると考えやすくなります.
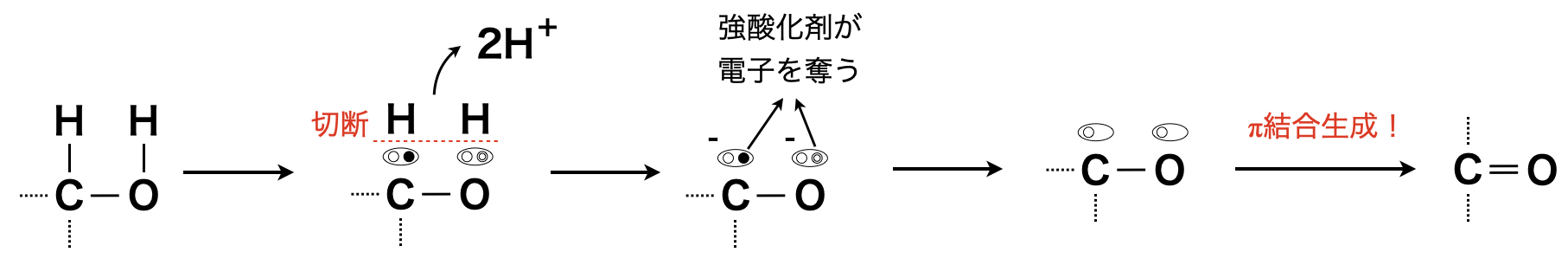
アルコールの酸化反応は級数によって異なります.\(1\)つずつみていきましょう!
第\(1\)級アルコールの酸化
第\(1\)級アルコールを酸化するとアルデヒドになり,さらに酸化するとカルボン酸(酸性物質)になります.
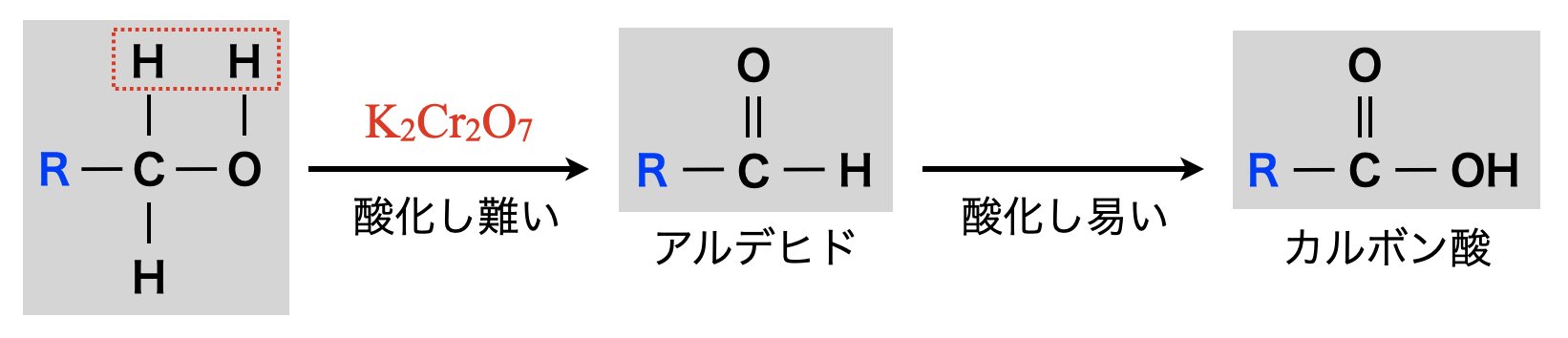
還元剤として働く第\(1\)級アルコールの酸化反応の半反応式を書けるようにしてくださいね!
還元剤:\(\rm{RCH_2OH\ →\ RCHO\ +\ 2H^+\ +\ }\)\(2e^-\)
酸化剤:\(\rm{Cr_2O_7^{2-}\ +\ 14H^+\ +\ }\)\(6e^-\ →\ \rm{7H_2O\ +\ 2Cr^{3+}}\)
さらにアルデヒドからカルボン酸に変化する半反応式は以下のようになります!
\(\rm{RCHO\ +\ H_2O\ →\ RCOOH\ +\ 2H^+\ +\ }\)\(2e^-\)
第\(2\)級アルコールの酸化
第\(2\)級アルコールを酸化すると,ケトン(酸化されにくい中性物質)になります.
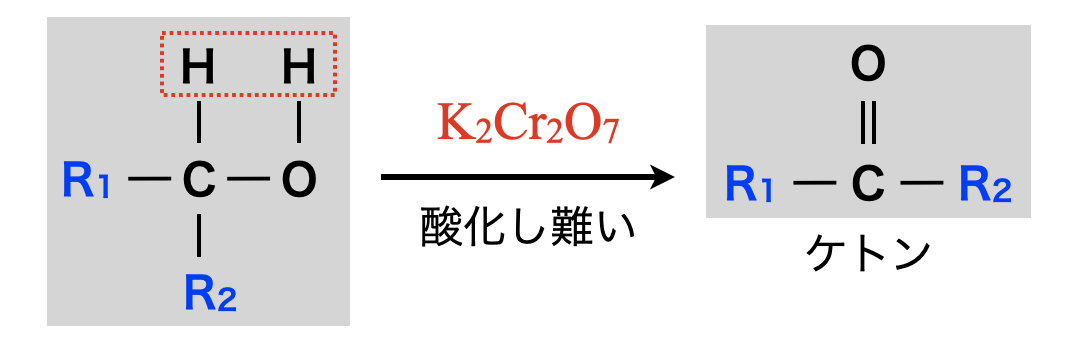
還元剤:\(\rm{R_1CH(OH)R_2\ →\ R_1COR_2\ +\ 2H^+\ +\ }\)\(2e^-\)
酸化剤:\(\rm{Cr_2O_7^{2-}\ +\ 14H^+\ +\ }\)\(6e^-\ →\ \rm{7H_2O\ +\ 2Cr^{3+}}\)
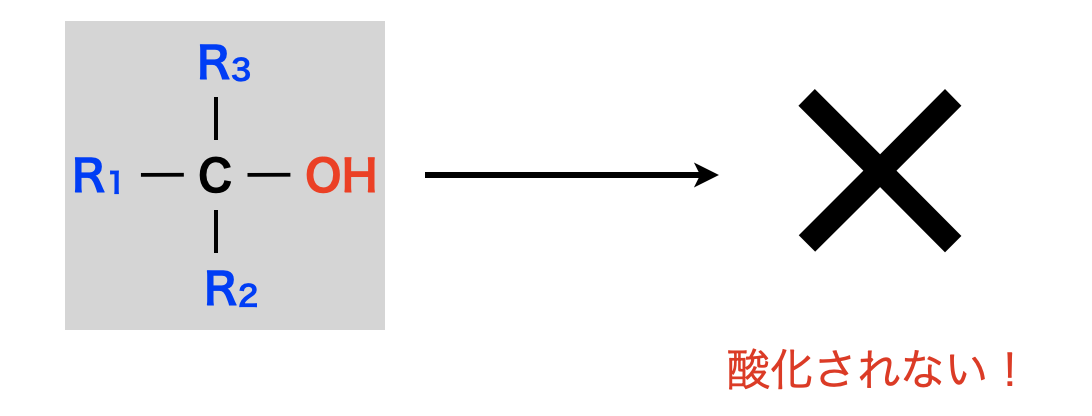
第\(3\)級アルコールの酸化
第\(3\)級アルコールは酸化反応が難しく,無理にやろうとすると燃えて\(\rm{CO_2}\)と\(\rm{H_2O}\)になってしまいます.
第◯級アルコールの区別
第\(1\)級・第\(2\)級・第\(3\)級アルコールの区別ができるようになることが非常に大切です.まずエーテルとアルコールの区別して,第\(1\)級・第\(2\)級・第\(3\)級アルコールの区別をみていきましょう!
アルコールとエーテルの区別
強還元剤である金属\(\rm{Na}\)との反応によって,\(\rm{H_2}\)が発生するかどうかで区別することができます!アルコールは\(\rm{R-OH}\)の\(\rm{H}\)が\(\rm{Na}\)から\(e^-\)を受け取り,\(\rm{H_2}\)を発生します.そして\(\rm{R-OH}\)は\(\rm{R-O^-}\)(アルコキシドイオン)に変化します.
一方で,エーテルは金属\(\rm{Na}\)と反応することができません.
\(\rm{H^+}\)イオンがあれば,アルコールでなくても金属\(\rm{Na}\)との反応によって\(\rm{H_2}\)が発生します.そのためこの考え方を使うためには,カルボン酸(\(\rm{RCOOH}\))やフェノール(\(\rm{C_6H_5OH}\))などの可能性がない中で使う必要があります!アルコール or エーテルの\(2\)択の中で金属\(\rm{Na}\)との反応を使いましょう!!
第\(1\)級アルコールの検出
第\(1\)級アルコールを直接検出することはできません.そのため強酸化剤で酸化させ第\(1\)級アルコールをアルデヒドに変化させることで,銀鏡反応やフェーリング反応を行います.
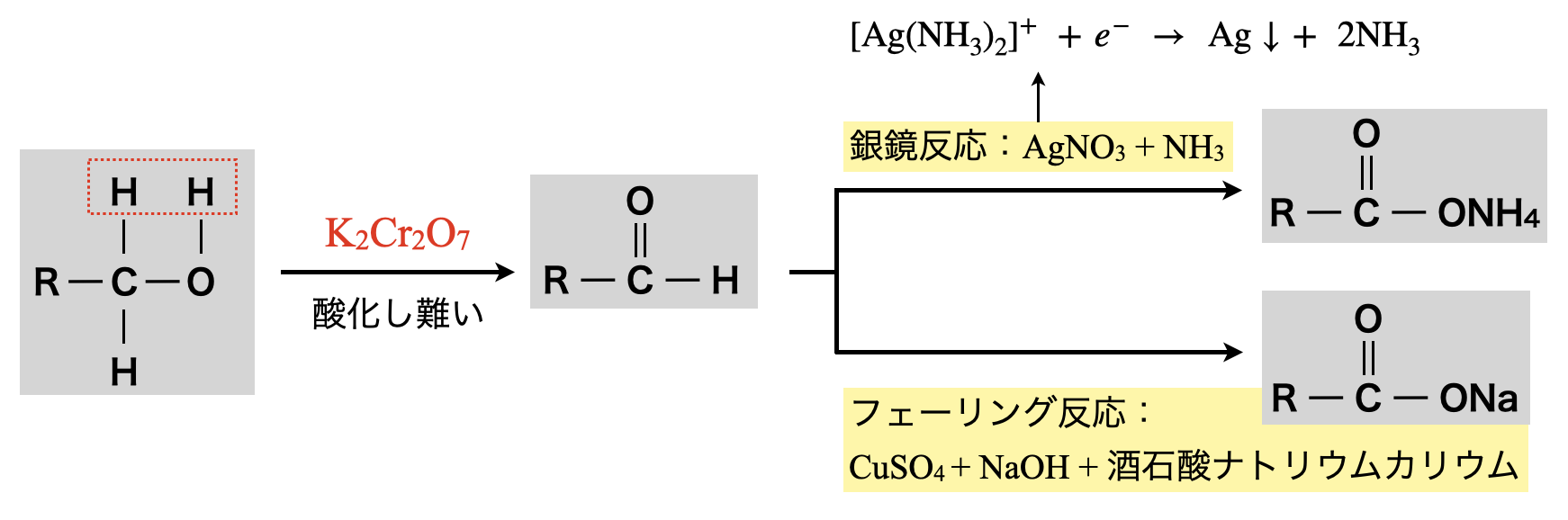
銀鏡反応・フェーリング反応は\(\rm{RCHO}\)(アルデヒド)の酸化反応の応用になります.アルデヒドの反応で得られる\(e^-\)を\(\rm{Ag^+}\)が得て\(\rm{Ag}\)が析出し,\(\rm{Cu^{2+}}\)が得て\(\rm{Cu_2O}\)(赤褐色)が析出します.
〈銀鏡反応〉
還元剤:\(\rm{RCHO\ +\ H_2O\ →\ RCOOH\ +\ 2H^+\ +\ }\)\(2e^-\)
酸化剤:\(\rm{Ag^+\ +\ }\)\(e^-\ →\ \rm{Ag}\)
〈フェーリング反応〉
還元剤:\(\rm{RCHO\ +\ H_2O\ →\ RCOOH\ +\ 2H^+\ +\ }\)\(2e^-\)
酸化剤:\(\rm{2Cu^{2+}\ +\ }\)\(2e^-\ +\ \rm{2OH^-\ →\ Cu_2O↓\ +\ H_2O}\)
第\(2\)級アルコールの検出
第\(2\)級アルコールの中でも端から\(2\)番目の第\(2\)級アルコールの検出方法にヨードホルム反応があります.この反応は,\(\rm{C}\)骨格の端から\(2\)番目の第2級アルコールの検出とアセチル基の検出反応です.ここでのポイントは,第\(2\)級アルコールではなんでも検出できるわけではなく,端から\(2\)番目の第\(2\)級アルコールを検出できるという点です!
検出方法としては,\(\rm{NaOH_{aq}}\)と\(\rm{I_{2aq}}\)を加えて加熱します.すると,特有の臭いをもった\(\rm{CHI_3}\)(ヨードホルム)の黄色沈殿が生じます.この反応をヨードホルム反応といいます.

ここで注意点が\(2\)点あります.
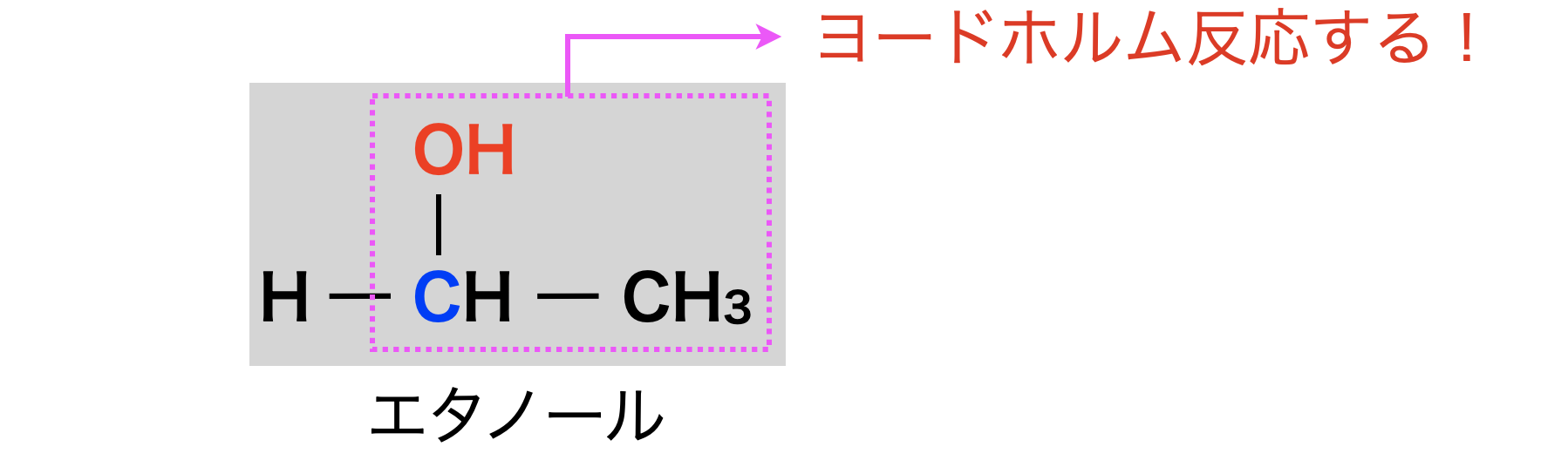
①エタノールのヨードホルム反応
エタノールは第\(1\)級アルコールですが,第\(2\)級アルコールと同じ構造をもつので,ヨードホルム反応します.
ここはひっかけ問題で出る可能性があるので,意識して覚えるようにしてくださいね!
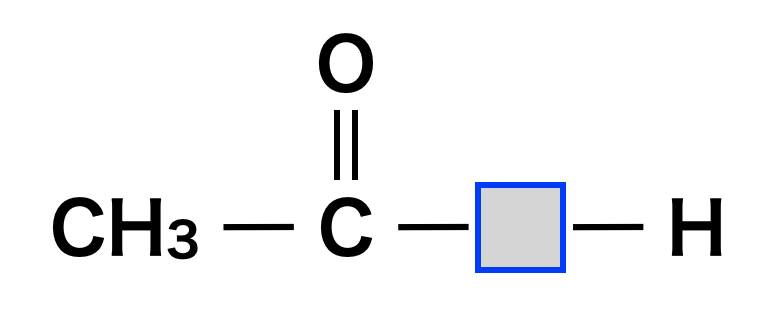
②ヨードホルム反応しないもの
下の図の中の□の中に\(\rm{O\ or\ N}\)がくる化合物はヨードホルム反応しません.理由はとても難しいので,とりあえずこの結果を覚えるようにしてくださいね!




コメント