今回のメニューです。
✅モル分率
✅混合気体の平均分子量
物質の状態には、固体、液体、気体の\(3\)種類がありますが、
その中で今回は「気体」について学んでいきましょう。
物質\(\rm{A}\)と物質\(\rm{B}\)が一緒に混ざっているときの計算方法などを徹底解説していきますので、ぜひ最後までご覧ください。
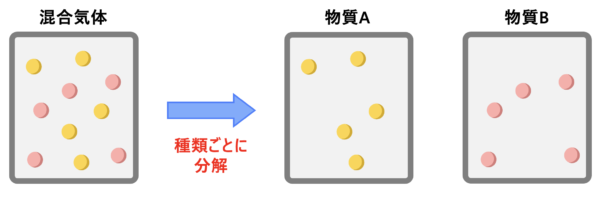
混合気体とは?
互いに化学反応しない気体\(\rm{A}\)と\(\rm{B}\)を同じ容器に入れた状態を混合気体といいます。
混合気体の圧力やモル分率について、徹底解説していきます。
混合気体を考える際のポイントは、\(2\)つの物質を完全に分けて考えることです。
これを頭に入れておくだけで、どんな問題でもしっかりと解くことができますよ。
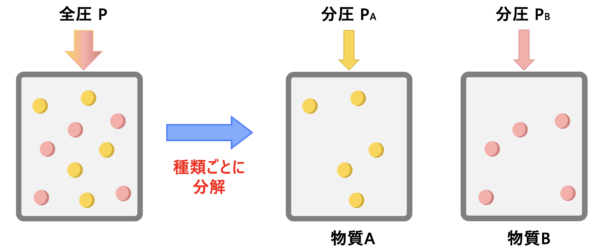
分圧と全圧の違い
それでは、混合気体の圧力について考えていきましょう。
体積\(V\)の容器に気体\(\rm{A}\)と気体\(\rm{B}\)を混合した場合を考えてみます。
混合気体を合わせた場合の圧力を全圧、気体\(\rm{A}\)や気体\(\rm{B}\)がそれぞれの圧力を分圧といいます。
ここで、混合気体を考える際には、ドルトンの分圧の法則というものを使います。
混合気体の全圧\(P\)は、各気体の分圧\(p_{\rm{A}}\)、\(p_{\rm{B}}\)の和になる
\(P = p_{\rm{A}} + p_{\rm{B}}\)
では、ドルトンの分圧の法則がなぜ成り立つのかを一緒に考えてみましょう。
このように、「なぜ?」という視点は非常に重要です。
まずは、体積\(V\ [\rm{L}]\)の容器を用意して、その中に気体\(\rm{A\ }\)\(n_{\rm{A}}\rm{\ [mol]}\)、気体\(\rm{B\ }\)\(n_{\rm{B}}\rm{\ [mol]}\)を入れます。
そして温度は\(T\ \rm{[K]}\)にセットします。
このときのそれぞれの気体の分圧を考えてみましょう。
ここで、\(1\)つポイントがあります。
それは、理想気体で考えているということです。
どういうことかというと、気体\(\rm{A}\)と気体\(\rm{B}\)を同じ容器に封入していますが、理想気体では「粒子体積ゼロで考える」という決まりがあります。
そのため、どちらの気体の体積を考えるときも体積は\(V\ [\rm{L}]\)として考えることができます。
理想気体と実在気体の違いについては、こちらの記事で徹底解説していますので、ぜひそちらをご覧ください。

それでは各気体の分圧を計算していきましょう。
気体\(\rm{A}\):
先ほども説明したように、温度\(T\ \rm{[K]}\)、体積\(V\ \rm{[L]}\)の容器に、物質量 \(n_{\rm{A}}\rm{\ [mol]}\)を入れたとき、気体\(\rm{A}\)の分圧を\(p_{\rm{A}}\ \rm{[Pa]}\)とします。
すると、気体の状態方程式は、\(p_{\rm{A}}\)\( V = n_{\rm{A}}\)\( R T\)となります。
気体\(\rm{B}\):
気体\(\rm{B}\)も同様に考えていきましょう。
温度\(T\ \rm{[K]}\)、体積\(V\ \rm{[L]}\)の容器に、物質量 \(n_{\rm{B}}\rm{\ [mol]}\)を入れたとき、気体\(\rm{B}\)の分圧を\(p_{\rm{B}}\ \rm{[Pa]}\)とします。
すると、気体の状態方程式は、\(p_{\rm{B}}\)\( V = n_{\rm{B}}\)\( R T\)となります。
気体\(\rm{A+B}\):
それでは、混合気体(\(\rm{A+B}\))の状態を考えていきます。
このとき、温度\(T\ \rm{[K]}\)、体積\(V\ \rm{[L]}\)の容器に、気体\(\rm{A}\)と\(\rm{B}\)混合の物質量である\(n_{\rm{A}}\)\( + n_{\rm{B}}\ [\rm{mol}]\)を入れたとき、全圧を\(P\ [\rm{Pa}]\)とします。
すると、気体の状態方程式は、\(P V = (n_{\rm{A}} + n_{\rm{B}}) R T\)となります。
それでは、今までの式を並べて比較してみましょう。
気体\(\rm{A}\):\(p_{\rm{A}}\)\( V = n_{\rm{A}}\)\( R T\)
気体\(\rm{B}\):\(p_{\rm{B}}\)\( V = n_{\rm{B}}\)\( R T\)
全体:\(P V = (n_{\rm{A}} + n_{\rm{B}}) R T\)
気体\(\rm{A}\)と気体\(\rm{B}\)の式を足すと、\((p_{\rm{A}} + p_{\rm{B}}) V = (n_{\rm{A}} + n_{\rm{B}}) R T\)
となり、全圧:\(P = p_{\rm{A}} + p_{\rm{B}}\)であることがわかります。
つまり、それぞれの分圧を考える際には、対象の物質のみを考えていけば\(\rm{OK}\)というわけです。
モル分率
では、次にモル分率という考え方をみていきます。
このモル分率という考え方もマスターすると、問題が非常に解きやすくなるので、ぜひ一緒に理解していきましょう。
どこよりも丁寧に解説していきますね。
物質\(\rm{A}\)について考えてみましょう。
容器全体の物質の中で、物質\(\rm{A}\)の\(\rm{mol}\)数の割合をモル分率といいます。
\(\rm{モル分率=\large \frac{物質Aのmol数}{容器全体のmol数}}\)
このように考えると、非常にシンプルだと思います。
それでは、先ほどの物質\(\rm{A}\)と物質\(\rm{B}\)をもう一度考えていきましょう。
皆さんのお持ちの参考書では、このモル分率について、いろいろ書いていると思いますが、上のモル分率を理解していれば、そんなに悩む必要はありません。
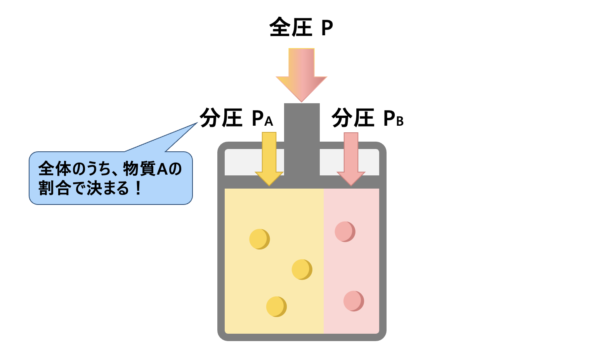
全体で見ると、全圧 \(P\ [\rm{Pa}]\)、物質量 \(n_{\rm{A}} + n_{\rm{B}}\ [\rm{mol}]\)です。
一方で、気体\(\rm{A}\)は分圧 \(p_\rm{A}\ [\rm{Pa}]\)、物質量 \(n_\rm{A}\ [\rm{mol}]\)です。
すると、気体\(\rm{A}\)の分圧\(p_\rm{A}\)は、以下の式で求められます。
\(p_{\rm{A}} = \large \frac{n_{\rm{A}}}{n_{\rm{A}} + n_{\rm{B}}} \small P\)
つまり、気体\(\rm{A}\)の分圧\(p_\rm{A}\)は、全圧のうち気体\(\rm{A}\)の\(\rm{mol}\)数の割合になるというわけです。
混合気体の平均分子量
それでは次に、混合気体の平均分子量について考えていきましょう。
気体\(\rm{A}\)の分子量を\(M_\rm{A}\)、気体\(\rm{B}\)の分子量を\(M_\rm{B}\)とします。
(\(M\)は分子量の英語:\(\rm{Molecular\ weight}\)の頭文字です!)
そして、混合気体の平均分子量を\(M\)とします。
すると、
\(M = M_{\rm{A}} × \large \frac{n_{\rm{A}}}{n_{\rm{A}} + n_{\rm{B}}} \small + M_{\rm{B}} × \large \frac{n_{\rm{B}}}{n_{\rm{A}} + n_{\rm{B}}}\)
で求めることができます。
イメージしてみましょう!
混合気体の分子量を考えるときには、気体\(\rm{A}\)の影響と気体\(\rm{B}\)の影響を足し合わせるというわけです。
気体\(\rm{A}\)の影響:
気体\(\rm{A}\)の分子量のうち、\(\rm{A}\)の割合分
→\(M_{\rm{A}} × \rm{A}\)のモル分率
気体\(\rm{B}\)の影響:
気体\(\rm{B}\)の分子量のうち、\(\rm{B}\)の割合分
→\(M_{\rm{B}} × \rm{B}\)のモル分率
なので、混合気体の分子量\(M\)は、それぞれの影響を足し合わせて、上の式になるというわけです。
常にイメージしながら問題を解いていくようにしましょう。
実践練習
それではここから、混合気体に関する練習問題を解いていきましょう。
今までの解説を理解していれば、どんな問題も簡単に解くことができることを体感してくださいね。
以下の問題では、気体定数\(R\)を\(R=8.3×10^3\ \rm{Pa \cdot L/(K \cdot mol)}\)とします。
問題1
コックを閉じた状態で、\(\rm{5.0\ L}\)の容器\(\rm{A}\)に\(\rm{3.0×10^5\ Pa}\)のエタン(\(\rm{C_2H_6}\))、\(\rm{10.0\ L}\)の容器\(\rm{B}\)に\(\rm{5.0×10^5\ Pa}\)の酸素(\(\rm{O_2}\))を充填した。温度を一定にしてコックを開いたとき、エタンと酸素の分圧および全圧を求めてみましょう。
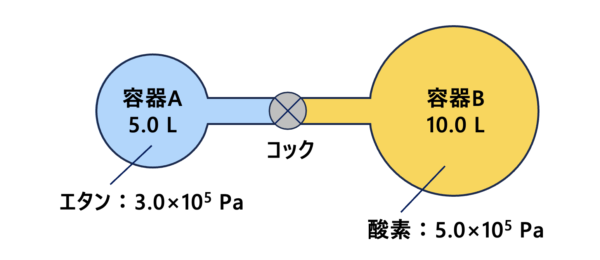
それでは、エタンと酸素の分圧をそれぞれ\(p_\rm{C_2H_6}\)、\(p_\rm{O_2}\)、全圧を\(P\)とします。
エタンの分圧
まずは、エタンから考えていきましょう。
気体の状態方程式:\(PV=nRT\)から\(nRT\)は一定なので、(コック閉の\(PV\))=(コック開の\(PV\))となります。
コックを開くと、エタンの移動空間は\(\rm{5.0\ L}\)から\(\rm{15.0\ L}\)へと広がりました。
\(3.0×10^5 × 5.0 = p_{\rm{C_2H_6}} × 15.0\)
\(p_{\rm{C2H6}} = 1.0 × 10^5\ \rm{Pa}\)
酸素の分圧
同じように、酸素も考えていきましょう。
酸素もコックを開くと、移動空間が\(\rm{5.0\ L}\)から\(\rm{15.0\ L}\)へと広がります。
なので、
\(5.0×10^5 × 10.0 = p_{\rm{O_2}} × 15.0\)
\(p_{\rm{O_2}} = 7.5×10^5\ \rm{Pa}\)
全圧
そして全圧\(P\)は、容器内の各物質の分圧の和なので、
全圧\(P = p_{\rm{C_2H_6}} + p_{\rm{O_2}} = 8.5 × 10^5\ \rm{Pa}\)
このように、分圧の基礎知識があると簡単に解けますね。
また気体の状態方程式を見比べることで、計算量を圧倒的に少なくすることができます。
この問題は非常に基礎的なので、しっかりと理解してくださいね。
問題2
それでは次に、容器\(\rm{A(1.0\ L)}\)と容器\(\rm{B(2.0\ L)}\)を考えていきましょう。
コックを閉じた状態で、容器\(\rm{A}\)にアルゴン(\(\rm{Ar}\))を\(\rm{0.1\ mol}\)、容器\(\rm{B}\)に酸素(\(\rm{O_2}\))を\(\rm{0.5\ mol}\)充填した。
容器\(\rm{A}\)、\(\rm{B}\)ともに温度は\(\rm{27^{\circ}C}\)に保った。
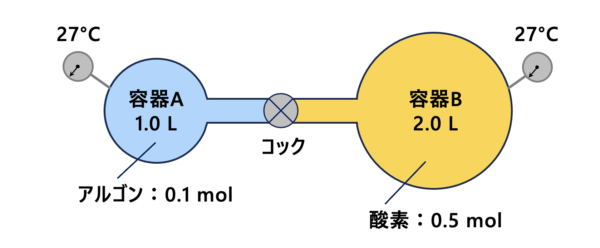
(\(1\)) 容器\(\rm{A}\)の圧力はいくらか?
(\(2\)) 次に、容器\(\rm{A}\)、\(\rm{B}\)を\(\rm{27^{\circ}C}\)に保ったままコックを開け、両気体を混合した。このときのアルゴンの分圧はいくらか?
(\(3\)) さらに、容器\(\rm{A}\)を\(\rm{27^{\circ}C}\)、容器\(\rm{B}\)を\(\rm{227^{\circ}C}\)に保った。十分時間が経過した後の容器B内の圧力はいくらか?
(\(4\)) このとき、容器\(\rm{A}\)内の物質量はいくらか?
少し応用問題になりますが、1つずつ着実に解いていきましょう。
(\(1\))
ここでは、コックを閉じているので、容器\(\rm{A}\)だけを考えていきましょう。
すると、容器\(\rm{A}\)について気体の状態方程式を使えば\(\rm{OK}\)なので、次のようになります。
容器\(\rm{A}\)の圧力を\(p_{\rm{A}}\)とすると、
\(p_{\rm{A}} × 1.0 = 0.1 × 8.3× 10^3 × 300\)
\(p_{\rm{A}} = 2.5 × 10^5\ \rm{Pa}\)
(\(2\))
次は、コックを開いたので、アルゴンの移動できる空間は、\(\rm{1.0\ L\ }\)→\(\rm{\ 3.0\ L}\)に大きくなりました。
アルゴンの分圧を\(p_{\rm{Ar}}\)とすると、
\(p_{\rm{Ar}} × 3.0 = 0.1 × 8.3 × 10^3 × 300\)
(\(1\))の式と比較すると、右辺がまったく同じなので、
\(2.5 × 10^5 × 1.0 = p_{\rm{Ar}} × 3.0\)
となります。
\(p_{\rm{Ar}} = \large \frac{2.5}{3.0} \small × 10^5 = 8.3 × 10^4\ \rm{Pa}\)
「気体の状態方程式を比較する」というのを覚えてくださいね。
(\(3\))
容器\(\rm{A}\)と容器\(\rm{B}\)で温度が異なる少し変わった問題ですが、解き方は今までとまったく同じです。
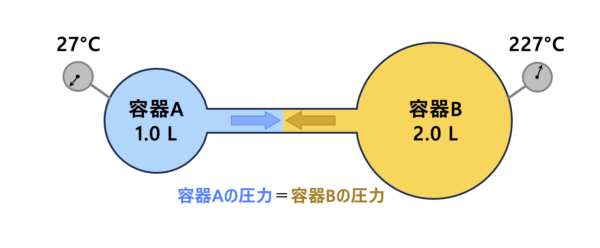
コックを開けているので、(容器\(\rm{A}\)の圧力) \(=\)(容器\(\rm{B}\)の圧力)\(=\)全圧 \(P\)となります。
またコックを開けているので、
(容器\(\rm{A}\)の\(\rm{mol}\))\(=\)(容器\(\rm{B}\)の\(\rm{mol}\))\(\rm{=0.6\ mol}\)
となります。
なので、
\(\large \frac{P\ ×\ 1.0 }{R\ ×\ 300} \small + \large \frac{P\ ×\ 2.0 }{R\ ×\ 500} \small = 0.6\ \rm{mol}\)
これを解くと、
\(P = 6.8 × 10^5\ \rm{Pa}\)
変わらないものに目をつけて、等式を作るのが大切なので、このような解き方も覚えておいてくださいね。
(\(4\))
容器\(\rm{A}\)内の物質量を\(n_{\rm{A}}\ [\rm{mol}]\)とします。
コック開の容器\(\rm{A}\)の状態方程式:\(6.8 × 10^5 × 1.0 = n_{\rm{A}} R × 300\)
コック閉の容器\(\rm{A}\)の状態方程式:\(2.5 × 10^5 × 1.0 = 0.1 R × 300\)
このコック閉は、(\(1\))で作った式になります。
この\(2\)式を比較すると、
\(\large \frac{6.8\ ×\ 10^5}{2.5\ ×\ 10^5} \small = \large \frac{n_{\rm{A}}}{0.1}\)
\(n_{\rm{A}} = 0.27\ \rm{mol}\)
この問題も今までに出てきた式で比較できないかを考えると、短時間で解くことができますね。



コメント