今回のメニューです!
✅どこよりもわかりやすい\(\rm{pH}\)計算の徹底解説
物質の変化の中の「酸・塩基」について徹底解説していきます。
酸・塩基の中で、今回は\(\rm{pH}\)計算の実践編です。
受験で頻出の強酸の希釈や二段階電離、強酸と強塩基の混合を完全解説していくので、
ぜひ最後までご覧だくさい!
\(\rm{pH}\)計算の基礎はこちらの記事で丁寧に解説しているので、ぜひそちらをご覧ください。

問題\(\ 1\):強酸の希釈
\((1)\) \(\rm{0.30\ mol/L}\)の塩酸の\(\rm{pH}\)は?
ただし、\(\rm{log_{10}3=0.48}\)とする。
\((2)\) \(\rm{1.0 × 10^{-5}\ mol/L}\)の塩酸を純水で\(1000\)倍に希釈した溶液の\(\rm{pH}\)は?
ただし、\(\rm{log_{10}1.05=0.02}\)とする。
\((1)\):塩酸の\(\rm{pH}\)
塩酸\(\rm{HCl}\)は強酸なので、完全に電離します。
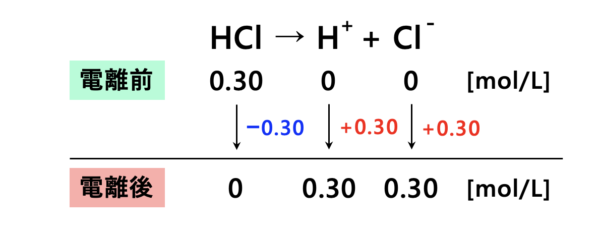
上の図を見ると、\(\rm{[H^+]=0.30\ mol/L}\)となります。
このとき、注意ポイントがあります。
それは水の電離を考える必要があるか?という点です。
この問題は、水に塩酸を溶かしているので、
① \(\rm{HCl}\)の電離による\(\rm{H^+}\)
② 水の電離による\(\rm{H^+}\)
の\(2\)つを考える必要があります。
それでは「② 水の電離」を考慮する必要があるかを考えていきましょう。
水のイオン積から水の電離による\(\rm{H^+}\)は\(\rm{[H^+]=1.0 × 10^{-7}\ mol/L}\)です。
この結果を整理すると、下のようになります。
① \(\rm{HCl}\)の電離:\(\rm{[H^+]=0.30\ mol/L}\)
② 水の電離:\(\rm{[H^+]=1.0 × 10^{-7}\ mol/L}\)
①と②を比較すると、明らかに②が小さいです。(① \(\gg\) ②)
そのため、今回は「②水の電離」を無視して
\(\rm{[H^+]=0.30+1.0×10^{-7}≒0.30\ mol/L}\)
として\(\rm{pH}\)を計算しましょう。
\(\rm{pH=-log_{10}[H^+]=-log_{10}0.30 = -log_{10}3+1=0.52}\)
答え:\(\rm{pH=0.52}\)
\((2)\):塩酸の希釈
では次に、\(\rm{1.0 × 10^{-5}\ mol/L}\)の\(\rm{HCl}\)を希釈した場合を考えてみましょう。
ここで、まず間違った解答を示します。
塩酸\(\rm{HCl}\)は強酸なので、完全に電離します。
すると、\(\rm{[H^+]=1.0 × 10^{-5}\ mol/L}\)
そして、\(1000\)倍に希釈するので、\(\rm{[H^+]=1.0×10^{-8}\ mol/L}\)
これを\(\rm{pH}\)に変換して、\(\rm{pH=8}\)(塩基性)とする人が多くいます。
塩酸は酸性ですが、水で希釈することで塩基性になることはありません。
では、ここから正解を一緒に考えていきましょう。
先ほどと同様に\(\rm{HCl}\)と水の電離を考えてみましょう。
① \(\rm{HCl}\)の電離:\(\rm{[H^+]=1.0 × 10^{-8}\ mol/L}\) (\(1000\)倍の希釈より)
② 水の電離:\(\rm{[H^+]=1.0 × 10^{-7}\ mol/L}\) (水のイオン積より)
①と②を比較すると、①と②の差がほとんどないので、\((1)\)と違って②を無視できません。
そこで、\(\rm{HCl}\)の電離に加えて、水の電離も考慮していきましょう。
このように、極めて薄い酸の電離を考えるときには、水の電離も考慮する必要があります。
水の電離も考慮した\(\rm{pH}\)の求め方を\(3\)ステップで解説していきます。
① 水の電離による\(\rm{[H^+]=}\)\(x\ \rm{mol/L}\)とおく
[HClと水の電離を図として書く]
水の電離を考慮すると、
\(\rm{[H^+]=}\)\( x + 10^{-8}\ \rm{mol/L}\)
\(\rm{[OH^-]=}\)\(x\ \rm{mol/L}\)
となります。
② 水のイオン積を活用する
\(\rm{[H^+]}\)、\(\rm{[OH^-]}\)が表現できたので、
これを水のイオン積\(K_w = \rm{[H^+][OH^-] = 1.0×10^{-14}\ (mol/L)^2}\)に代入しましょう。
\(K_w = \rm{[H^+][OH^-]} =\)\((x + 10^{-8})x = 10^{-14}\ \rm{(mol/L)^2}\)
これを式変形すると、
\(x^2 + 10^{-8}x -10^{-14} = 0\)
と\(x\)の\(2\)次方程式になります。
解の公式を使うと、
\(x = \large \frac{-10^{-8} + \sqrt{10^{-16} + 4×10^{-14}}}{2}\)\(\rm{=9.5 × 10^{-8}\ mol/L}\)
(ここで、\(x\)は必ず正なので、\(\sqrt{}\)の前の符号は\(+\)にしています。)
③ \(\rm{[H^+]}\)から\(\rm{pH}\)を求める
\(x\)が求められたので、
\(\rm{[H^+]=9.5 ×10^{-8} + 10^{-8} =1.05 × 10^{-7}\ mol/L}\)
となります。
これから最後に\(\rm{pH}\)を求めていきましょう。
\(\rm{pH=-log_{10}[H^+] = log_{10}(1.05 × 10^{-7}) = 7 – log_{10}1.05 = 6.98}\)
答え:\(\rm{pH=6.98}\)
\(\rm{pH\ 7}\)を超えることはなく、最終的には中性\(\rm{pH=7}\)に近づくことがわかると思います。
問題\(\ 2\):二段階電離
二酸化炭素が水に溶けると水溶液中で炭酸が生成し、二段階電離し平衡状態になる。
\(\rm{H_2CO_3 ⇄ H^+ + {HCO_3}^-}\) ①
\(\rm{{HCO_3}^- ⇄ H^+ + {CO_3}^{2-}}\) ②
ただし、①の電離定数\(K_1\)は\(\rm{5.0×10^{-7}\ mol/L}\)、②の電離定数\(K_2\)は\(\rm{5.0×10^{-11}\ mol/L}\)である。
\((1)\) \(\rm{25°C}\)の水\(\rm{1.0\ L}\)に対して、\(\rm{1.0×10^5\ Pa}\)の二酸化炭素は最大\(\rm{3.5×10^{-2}\ mol}\)溶解する。この水溶液の炭酸の電離度と、水素イオン濃度は?
\((2)\) この水溶液の炭酸イオン\(\rm{{CO_3}^{2-}}\)の濃度は?
こちらは二段階電離の典型問題です。
二段階電離のポイントを徹底解説していきます。
\((1)\):炭酸の電離度
各段階の電離定数\(K_1\)と\(K_2\)を比較すると、\(K_1 \gg K_2\)であることがわかります。
・\(K_1\) 大 → 平衡がより右に進む → \(\rm{H^+}\)がより生成する
・\(K_2\) 小 → 平衡がほとんど右に進まない → \(\rm{H^+}\)がほとんど生成しない
そのため、\(K_1 \gg K_2\)の\(\rm{pH}\)は、第\(1\)電離のみを考えれば\(\rm{OK}\)です。
一般に、\(\frac{K_1}{K_2} \small ≧ 10^4\)であれば、第\(2\)電離は無視して\(\rm{OK}\)です!
ではここから、溶解した\(\rm{CO_2}\)の濃度を\(C\ \rm{[mol/L]}\)、第\(1\)電離の電離度を\(\alpha\)として電離定数\(K_1\)を表現していきましょう。
① 電離定数\(K_1\)を表現する
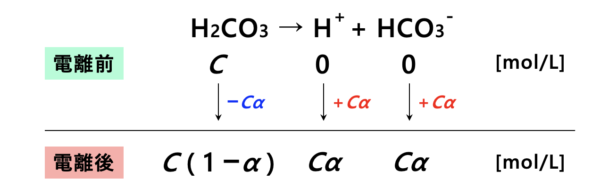
上の図から、
\(K_1 = \large \rm{\frac{[H^+][{HCO_3}^-]}{[H_2CO_3]}} \small =\) \(\large \frac{C \alpha \cdot C \alpha}{C(1 – \alpha)} \small = \large \frac{C \alpha ^2}{1 – \alpha}\)
② 電離定数\(\alpha \ll 1\)と近似して電離度\(\alpha\)を求める
電離度\(\alpha\)が\(\alpha \ll 1\)であるとすると、\(1 – \alpha ≒ 1\)と近似できます。
なので、
\(K_1 = C \alpha ^2\)
となり、電離度は
\(\alpha = \sqrt{\large \frac{K_1}{C}}\)
で求めることができます。
溶解した\(\rm{CO_2}\)の濃度は\(C=3.5×10^{-2}\ \rm{mol/L}\)なので、これを代入していきましょう。
電離度は\(\alpha = \sqrt{\large \frac{K_1}{C}} \small = \sqrt{\large \frac{5.0×10^{-7}}{3.5×10^{-2}}} \small ≒3.8×10^{-3}\)
③ 近似が正しかったか確認する
最後に、電離度\(\alpha \ll 1\)の近似が正しかったかを確認します。
この確認は非常に大切なので、必ずするようにしてくださいね。
電離度\(\alpha\)が\(0.05\)より小さいとき、近似して\(\rm{OK}\)でした。
電離度\(\alpha \leq 0.05\)というのは、水溶液中で\(5\%\)以下しか電離していないという意味です。
\(5\%\)以下、つまりほとんど電離していないので、電離度が極端に小さいと近似できるわけですね。
今回の場合も確認すると、電離度\(\alpha = 0.0038 \lt 0.05\)なので、この近似は\(\rm{OK}\)ですね!
では最後に、水素イオン濃度\(\rm{[H^+]}\)も求めておきましょう。
\(\rm{[H^+] =}\)\( C \alpha =3.5 × 10^{-7} ×3.8 ×10^{-3} ≒ 1.3 × 10^{-4}\ \rm{mol/L}\)
答え:\(\alpha = 0.0038\)、\(\rm{[H^+]=1.3 × 10^{-4}\ mol/L}\)
\((2)\):炭酸イオン濃度
この問題のポイントは以下となります。
\(\rm{[{CO_3}^{2-}]}\)は電離定数\(K_2\)から求めることができます。
ただし、\((1)\)で求めた\(\rm{[H^+]}\)は第\(2\)電離を無視して第\(1\)電離だけで考えました。
そのため、今回は第\(2\)電離をしっかりと考慮してあげる必要があります。
それでは、\((1)\)の\(\rm{[H^+]}\)を利用して第\(2\)電離も考慮した\(\rm{[H^+]}\)を求めていきましょう。
第\(2\)電離で\(x\ \rm{[mol/L]}\)平衡が移動するとすると、電離平衡後は次のようになります。
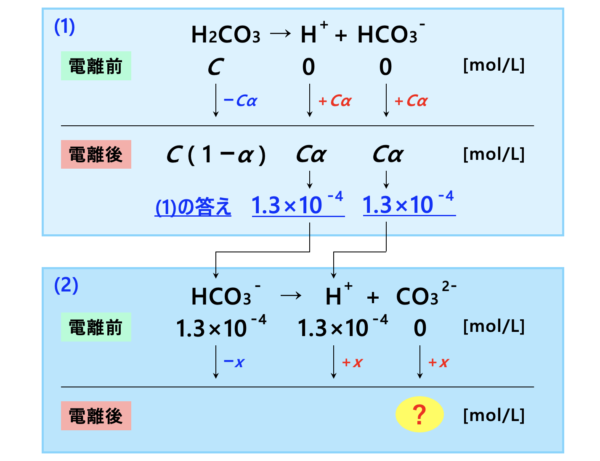
ここで、\(K_2\)は極端に小さいので、
・\(\rm{[{HCO_3}^-]=}\)\(1.3 × 10^{-4} – x≒1.3 × 10^{-4}\ \rm{mol/L}\)
・\(\rm{[H^+] =}\)\( 1.3 × 10^{-4} + x ≒ 1.3 × 10^{-4}\ \rm{mol/L} \)
として考えることができます。
これらを電離定数\(K_2\)の式に代入して、\(x\)を求めていきます。
\(K_2 = \large \rm{\frac{[H^+] [{CO_3}^{2-}]}{[{HCO_3}^-]}} \small =\) \(x = 5.0 ×10^{-11}\ \rm{mol/L}\)
よって、\(\rm{[{CO_3}^{2-}] = 5.0 ×10^{-11}\ mol/L}\)となります。
どこで近似をしてよいかをしっかりと理解してくださいね。
答え:\(\rm{[{CO_3}^{2-}] = 5.0 ×10^{-11}\ mol/L}\)
問題\(\ 3\):強酸と強塩基の混合
それぞれの溶液の\(\rm{pH}\)を求めよ。
\((1)\) \(\rm{0.10\ mol/L}\)の塩酸\(\rm{20.0\ mL}\)に、\(\rm{0.10\ mol/L}\)の水酸化ナトリウム水溶液\(\rm{30.0\ mL}\)を混合した溶液の\(\rm{pH}\)は?
\((2)\) \(\rm{pH\ 1.0}\)の塩酸\(\rm{100\ mL}\)と\(\rm{pH\ 4.0}\)の塩酸\(\rm{100\ mL}\)を混合した溶液の\(\rm{pH}\)は?
\((1)\):強酸と強塩基の混合
強酸と強塩基を混合した溶液の\(\rm{pH}\)を求める問題です。
まずは、それぞれの電離を考えていきます。
\(\rm{HCl}\)、\(\rm{NaOH}\)ともに電離度は\(1\)なので、次のように完全に電離します。
\(\rm{HCl → H^+ + Cl^-}\)
\(\rm{NaOH → Na^+ + OH^-}\)
溶液を混合する問題では、それぞれの\(\rm{H^+}\)、\(\rm{OH^-}\)の\(\rm{mol}\)を考えていきましょう!
\(\rm{H^+:0.10 × 20.0 = 2\ mmol}\)
\(\rm{OH^-:0.10 × 30.0 = 3\ mmol}\)
これから\(\rm{H^+}\)の\(\rm{2\ mmol}\)は\(\rm{OH^-}\)と完全に中和して、溶液中には\(\rm{OH^- = 1\ mmol}\)が残ることがわかります。
ここから、水酸化物イオン濃度\(\rm{[OH^-]}\)を求めていきます。
溶液中の\(\rm{OH^-}\)の物質量を溶液の全体量で割ると、濃度を求めることができます。
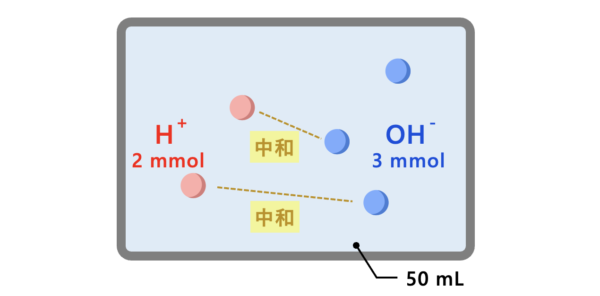
\(\rm{[OH^-] = \large \frac{1\ mmol}{50.0\ mL} \small = 2.0 × 10^{-2}\ mol/L}\)
ここから水のイオン積\(K_w = \rm{[H^+][OH^-] = 1.0×10^{-14}\ (mol/L)^2}\)を使って、\(\rm{[H^+]}\)を求めていきましょう。
\(\rm{[H^+] = }\)\(\large \frac{K_w}{\rm{[OH^-]}} \small = \large \frac{1.0×10^{-14}}{2.0 × 10^{-2}} \small = \large \frac{1}{2} \small ×10^{-12}\ \rm{mol/L}\)
よって、
\(\rm{pH = -log_{10} \left(\large \frac{1}{2} \small ×10^{-12} \right) = 12 + \log_{10}2 = 12.3}\)
となります。
答え:\(\rm{pH=12.3}\)
\((2)\):\(\rm{pH}\)の異なる塩酸の混合
\(\rm{pH}\)の異なる塩酸を混合した溶液の\(\rm{pH}\)を求める問題です。
この問題のポイントも\((1)\)とまったく同じです。
今回は、塩基がないので、それぞれの\(\rm{H^+}\)の物質量を考えていきましょう。
・\(\rm{pH\ 1.0}\)の塩酸の\(\rm{H^+}\):
\(\rm{pH\ 1.0}\)のとき、\(\rm{[H^+] = 10^{-1}\ mol/L}\)なので、
\(\rm{H^+}\):\(\rm{10^{-1} × 100 = 10\ mmol}\)
・\(\rm{pH\ 4.0}\)の塩酸の\(\rm{H^+}\):
\(\rm{pH\ 4.0}\)のとき、\(\rm{[H^+] = 10^{-4}\ mol/L}\)なので、
\(\rm{H^+}\):\(\rm{10^{-4} × 100 = 10^{-2}= 0.010\ mmol}\)
以上から、溶液を混合すると、
\(\rm{H^+}\)の\(\rm{mol}\):\(\rm{10 + 0.010 = 10.010\ mmol}\)
溶液の量:\(\rm{100 + 100 = 200\ mL}\)
よって、
\(\rm{[H^+] = \large \frac{10.010}{200} \small = 0.0501 ≒ 0.050\ mol/L}\)
\(\rm{pH =- log_{10}0.050 = -log_{10}(2^{-1} × 10^{-1}) = 1 + log_{10}2 = 1.3}\)
答え:\(\rm{pH=1.3}\)



コメント