
水・氷の\(2\)大性質
水・氷の重要な性質は\(2\)つあります.
- 氷は正四面体構造をとり水素結合している
- 水の密度 \(>\) 氷の密度
これらの\(2\)大性質を詳しく解説していきます.
氷は正四面体構造をとり水素結合している
まずは\(1\)つ目の性質です.
氷の結晶では,\(1\)コの水分子が他の\(4\)コの水分子と水素結合によって正四面体構造をとっています.
ポイントは,この\(1\)文がすべてです.笑
というわけにもいかないので,補足説明もしていきましょう.氷の結晶構造は図のようになっています.
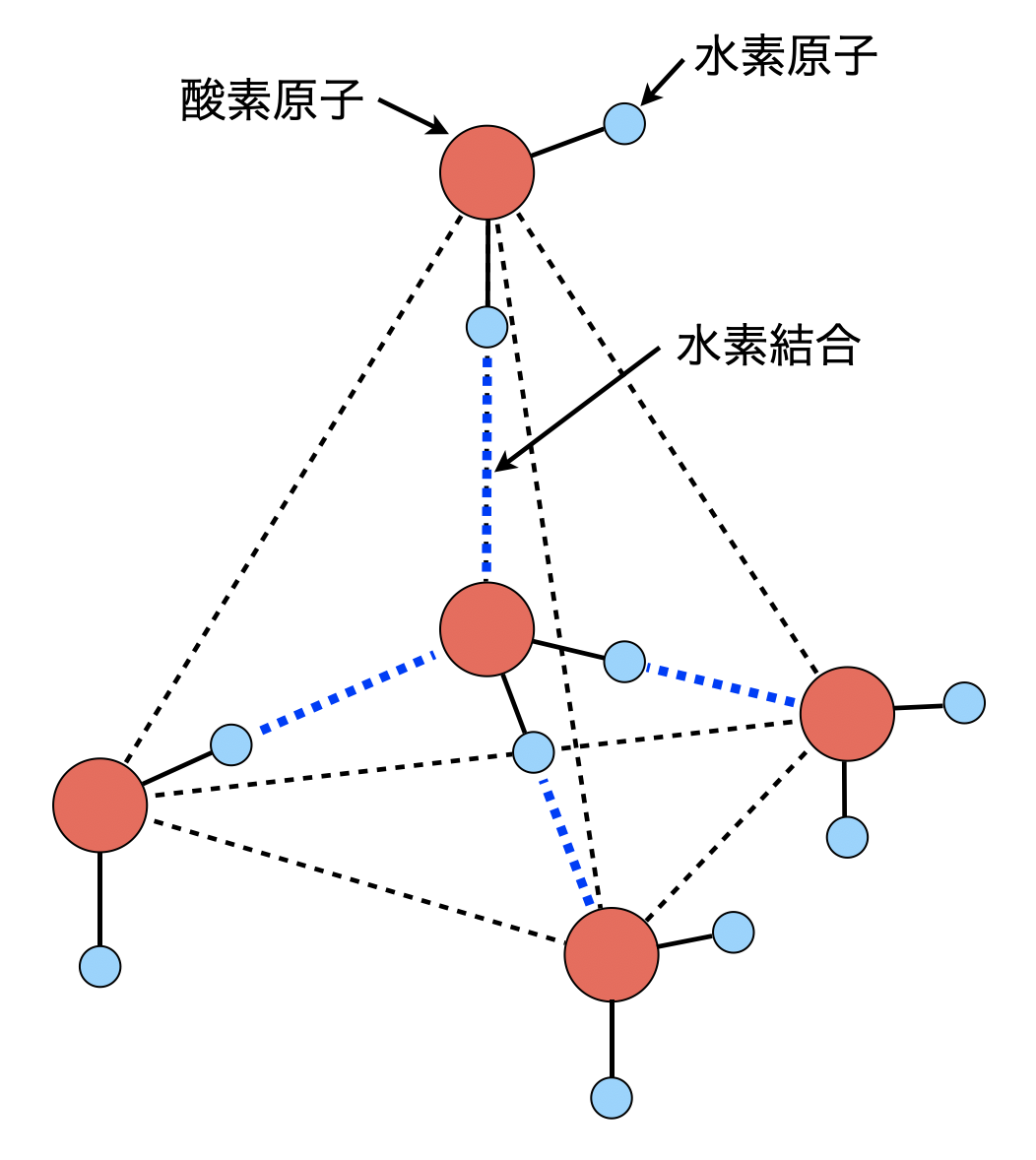
氷の結晶は配位数が\(4\)であるため,かなりすきまの多い構造をしています.これは水素結合に方向性があるためです.
ここで\(1\)つ注意点があります.
それは\(\rm{H_2O1}\)分子あたりの水素結合を数えるときは,\(2\)コになるという点です.これは下のように図を書くと,すぐに納得できます.
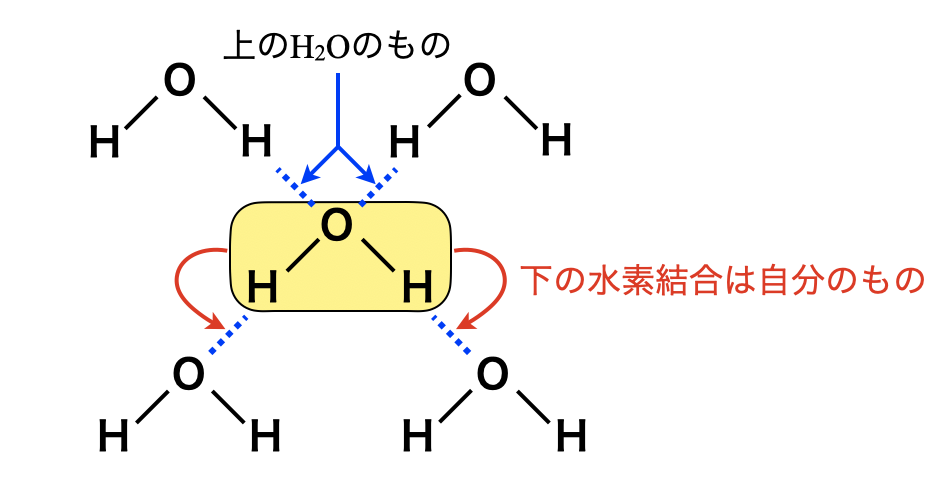
\(1\)分子あたりの水素結合を\(4\)コとすると,水素結合を重複して数えていることになります.この図で\(\rm{H-O-H}\)の下にある結合を自分のもの,上にあるものを自分の上にある\(\rm{H_2O}\)のものとすると,重複せずに数え上げることができますね!ここは入試でも頻出の部分なので,必ず理解しておきましょう!
水の密度 \(>\) 氷の密度
一般的な物質は,固体の密度 \(<\) 液体の密度となっていますが,水の場合には,水の密度 \(>\) 氷の密度となります.
コップに入れた水に氷を入れると,浮くという経験をしたことのある方は多いと思います.これで覚えてしまいましょう!ここで,浮く \(=\) 密度が小さいということです.
ではなぜ,水の密度 \(>\) 氷の密度と一般的な物質とは異なる性質を示すのでしょうか?
それは氷の構造にあります.先ほども説明したように,氷は水分子が水素結合で結びついて,すきまの多い構造になっています.一方で,水の場合は水分子の水素結合の一部が切断され,そのすきまに水分子が入ろうとしてきます.そのため密度が大きくなり,密度の逆転が起こるというわけです.
\(\rm{4^\circ C}\)で密度最大
次は,密度と温度の関係をみていきましょう!
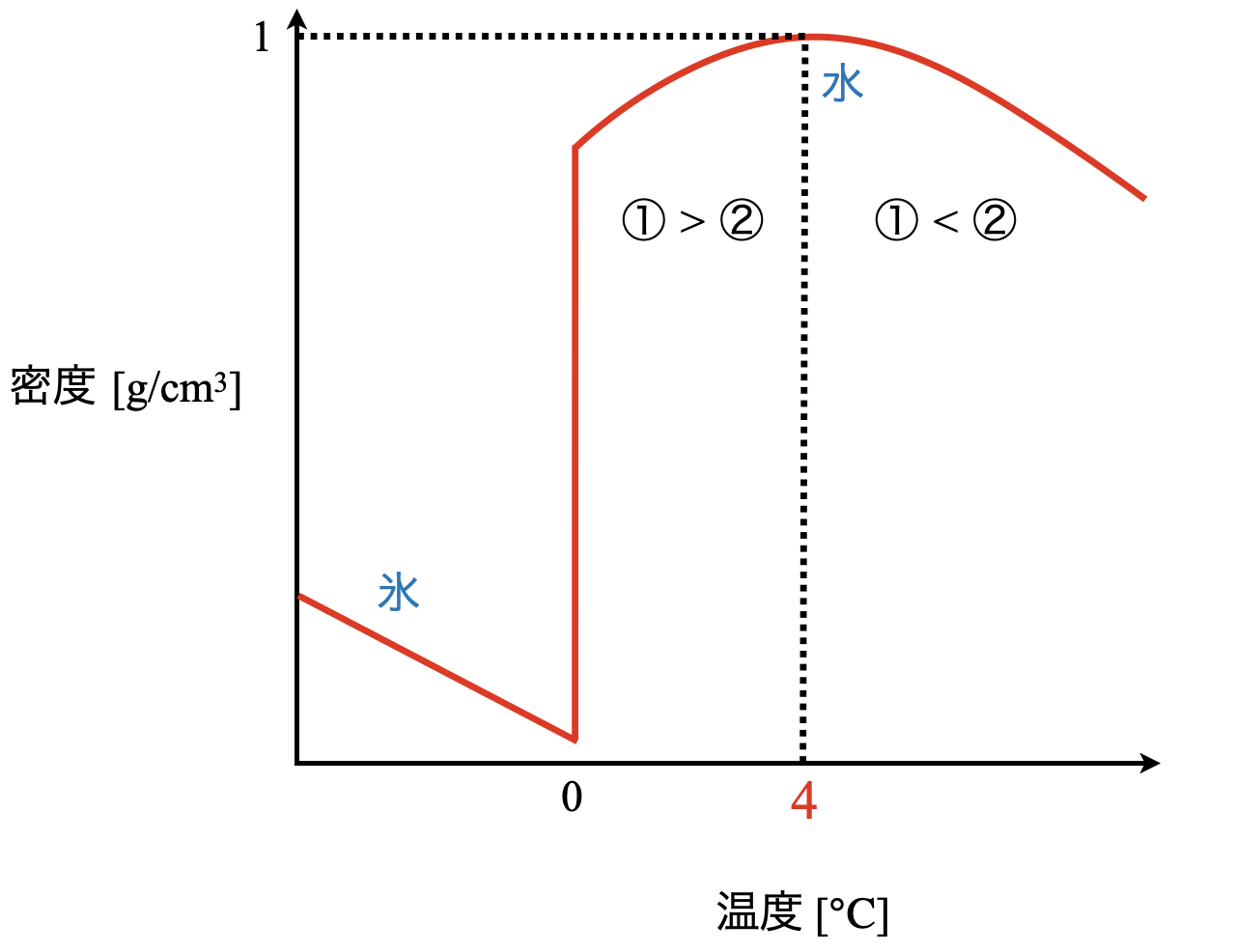
水の密度は,\(\rm{4^\circ C}\)で最大となります.
この理由を考えてみましょう.
まず\(\rm{0^\circ C}\)で氷から水に状態変化するとき,急激に体積が減少します.これは氷の水素結合の一部が切断され,その隙間を埋めるように自由になった水分子が入り込むためです.体積が減少するということは,逆に密度は増加しています.
これは単位を見ると簡単にわかります.密度の単位は一般的に\(\rm{g/cm^3}\)になりますが,分母の\(\rm{cm^3}\)が減少すると,\(\rm{g/cm^3}\)は全体的に増加することがわかります.ここまでが\(\rm{0^\circ C}\)の変化でした.
そして,\(\rm{0^\circ C}\)を過ぎると\(2\)つの効果が拮抗します.
①液体の水の中には部分的な水分子の塊であるクラスター構造が残っているため,温度を上げるとこの構造がこわれさらに体積が減少(密度が増加)する.
②温度が上がると水分子の運動が激しくなり,分子が占める空間の増加によって,体積が増加(密度が減少)する.
\(\rm{4^\circ C}\)以下では,① \(>\) ②,\(\rm{4^\circ C}\)以上では,① \(<\) ②となります.そのため① \(=\) ②となるのが\(\rm{4^\circ C}\)のときで,このとき密度が最大となります.
今日は簡潔に水・氷の構造を解説しました.必ず覚えてほしいことは,説明した\(2\)大性質です.そしてそれに付随する性質やその理由なども覚えていきましょう!



コメント