
- 酸化剤・還元剤にはどんなものがあるのか?
- 反応式をどのように考えていけばいいのか?
- 酸化剤かつ還元剤の物質の考え方
を特にポイントとしています.昨日の自分より少しでもレベルアップしていきましょう!
酸化剤・還元剤
酸化剤と還元剤の定義についてみておきましょう!
反応相手の物質(\(\rm{O}\))を還元するものを還元剤(\(\rm{Reducing\ agent}\)),反応相手の物質(\(\rm{R}\))を酸化するものを酸化剤(\(\rm{Oxidizing\ agent}\))といいます.これを電子の移動で考えると,\(e^-\)を出す側を還元剤,\(e^-\)を受け取る側を酸化剤といいます.
\(e^-\)の移動:還元剤(\(\rm{R}\))→酸化剤(\(\rm{O}\))
これが最も重要な酸化還元の定義になります.
具体的に還元剤(\(\rm{R}\))と酸化剤(\(\rm{O}\))を下の表にまとめてみました!問題を解いていきながら少しずつ覚えていきましょう!
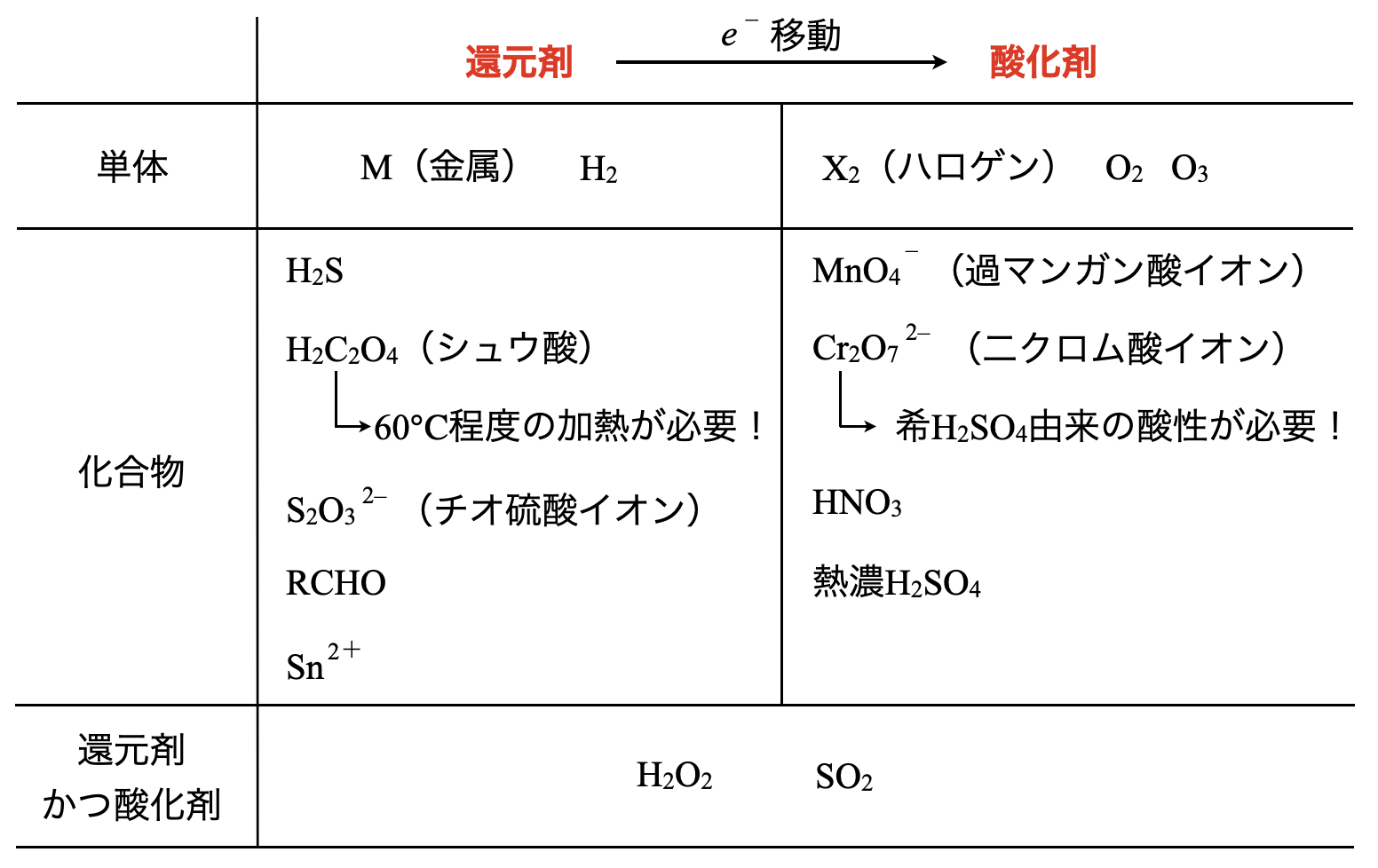
これらの各物質についてそれぞれ下で解説していきますね!
還元剤
まずは金属(\(\rm{Metal:M}\))です.金属は\(e^-\)を放出して陽イオンとなるので,必ず還元剤です.
\({\rm{M:M\ →\ }}{\rm{M}}^{n+}\)\(\ +\ ne^-\)
水素に関しても還元剤です.
\(\rm{H_2:H_2\ →\ 2H^+ }\)\(\ +\ 2e^-\)
次に,\(\rm{S^{2-}}\)です.
\(\rm{S^{2-}\ →\ S\ }\)\(+\ 2e^-\)
一般的に\(\rm{S-S}\)結合は生成しやすいということを頭の片隅に入れておいてくださいね!そしてこれを応用することで,\(\rm{{S_2O_3}^{2-}}\)(チオ硫酸イオン)についても考えることができます.
\(\rm{{S_2O_3}^{2-}}\)(チオ硫酸イオン)\(\rm{:{S_2O_3}^{2-}\ →\ {S_4O_6}^{2-} }\)\(\ +\ 2e^-\)
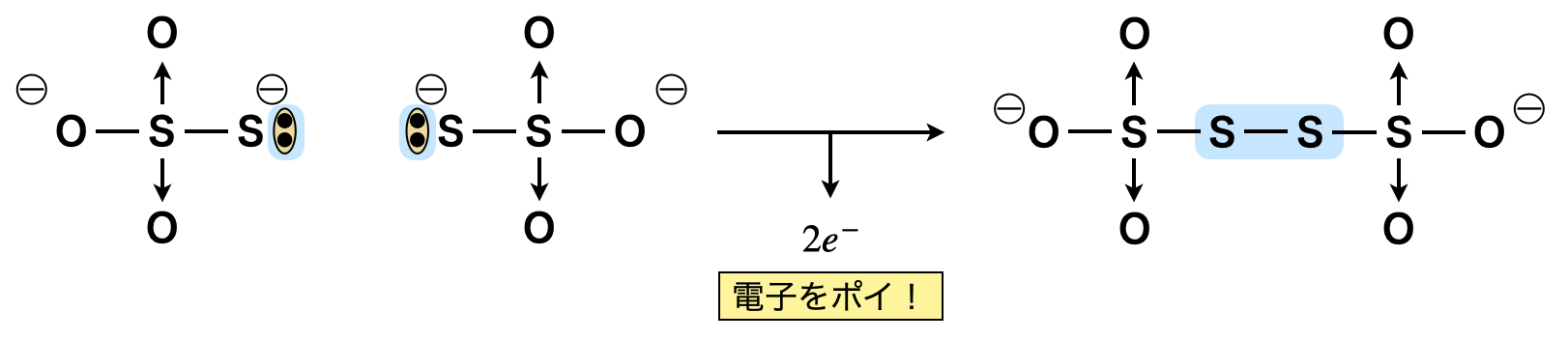
\(2\)つの\(\rm{{S_2O_3}^{2-}}\)が合体して,その間にある電子がポイと捨てられるイメージです!そして\(\rm{{S_4O_6}^{2-}}\)が生成されます.\(\rm{{S_2O_3}^{2-}}\)は\(\rm{{SO_4}^{2-}}\)の\(\rm{O}\)が\(1\)つ\(\rm{S}\)(ラテン語でチオ)に置き換わったものと考えることができますね!
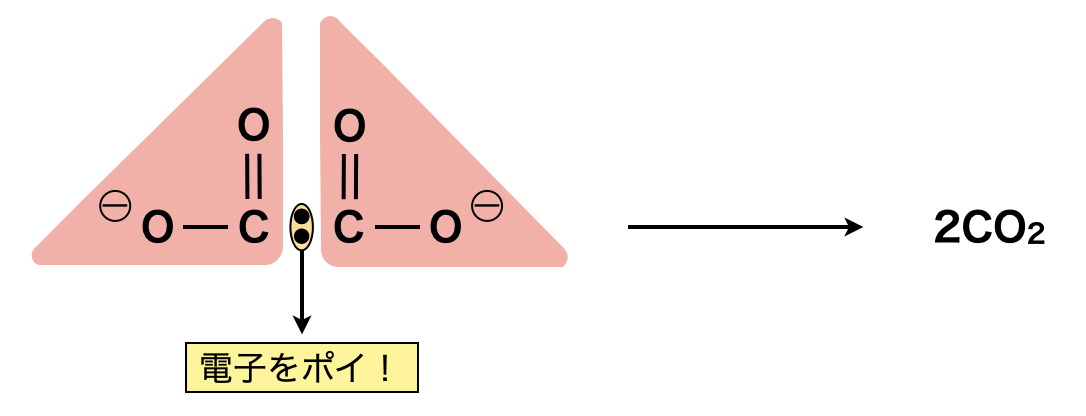
さらに\(\rm{{C_2O_4}^{2-}}\)は\(2\)つの\(\rm{CO_2}\)が生成されるときに,その間の電子がポイと捨てられるイメージで覚えておきましょう!
\(\rm{{C_2O_4}^{2-}\ →\ 2CO_2\ }\)\(+\ 2e^- \)
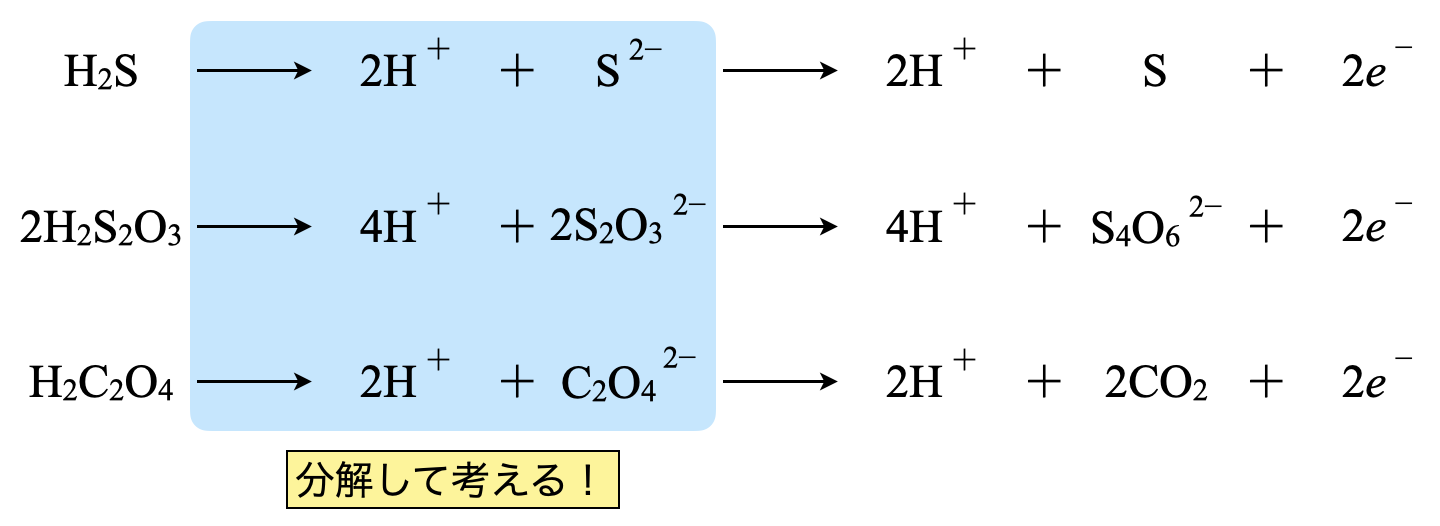
次は,これらを応用した\(\rm{H_2S}\),\(\rm{H_2S_2O_3}\),\(\rm{H_2C_2O_4}\)です.これらを考えるときには,まず\(\rm{H^+}\)とそれ以外というふうに\(2\)段階で考えます!具体的には,\(\rm{H^+}\)と\(\rm{S^{2-}}\),\(\rm{H^+}\)と\(\rm{{S_2O_3}^{2-}}\),\(\rm{H^+}\)と\(\rm{{C_2O_4}^{2-}}\)です.
すると,残りは今まで学習してきたイオンなので\(e^-\)を放出する反応を書くことができますね!
最後に\(\rm{Sn^{2+}}\)と\(\rm{RCHO}\)についておさえておきましょう!
\(\rm{Sn^{2+}:Sn^{2+}\ +\ 4Cl^-\ →\ SnCl_4 }\)\(\ +\ 2e^-\)
\(\rm{Sn}\)の安定酸化数は\(+4\)です.酸化数\(+4\)の\(\rm{Sn}\)は\(\rm{Cl^-}\)と化合して\(\rm{SnCl_4}\)を形成します.よって,\(\rm{Sn^{2+}}\)は還元剤として作用します.
\(\rm{RCHO:RCHO\ +\ H_2O\ →\ RCOOH\ +\ 2H^+ }\)\(\ +\ 2e^-\)
これは有機化学で非常に大切な反応なので,確実に覚えておいてくださいね!
酸化剤
次は酸化剤について少しずつ区切って解説していきます.
まずはハロゲン,\(\rm{O_2}\),\(\rm{O_3}\)についてです.
\(\rm{X_2}\)(ハロゲン)\(\rm{:X_2\ }\)\(+\ 2e^-\ →\ \rm{2X^-}\)
\(\rm{O_2}\)(酸性条件)\(\rm{:O_2\ +\ 4H^+\ }\)\(+\ 4e^-\ →\ \rm{2H_2O}\)
\(\rm{O_2}\)(中性条件)\(\rm{:O_2\ +\ 2H_2O\ }\)\(+\ 4e^-\ →\ \rm{4OH^-}\)
\(\rm{O_3}\)(酸性条件)\(\rm{:O_3\ +\ 2H^+\ }\)\(+\ 2e^-\ →\ \rm{O_2\ +\ H_2O}\)
\(\rm{O_3}\)(中性条件)\(\rm{:O_3\ +\ H_2O\ }\)\(+\ 2e^-\ →\ \rm{O_2\ +\ 2OH^-}\)
酸素が酸化剤として作用すると,\(\rm{O_2\ →\ O^{2-}}\)となります.\(e^-\)についても考えると以下のようになります.
\(\rm{O_2\ }\)\(+\ 4e^-\ →\ \rm{2O^{2-}}\)
ここで\(\rm{O^{2-}}\)イオンは\(\rm{H^+}\)イオンを受け取る能力が非常に高いので,酸性条件では\(\rm{H_2O}\)に,中性条件では\(\rm{OH^-}\)へと変化します.
酸性条件\(\rm{:O^{2-}\ →\ H_2O}\)
これに\(\rm{H^+}\)を加えると以下のようになります.
\(\rm{O^{2-}\ +\ 2H^+\ →\ H_2O}\)
これらの反応式を合わせると,下のようになります.
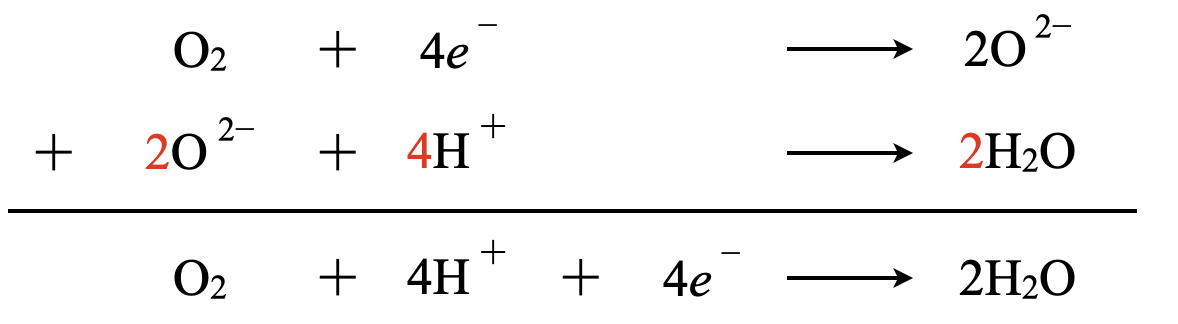
中性条件\(\rm{:O^{2-}\ →\ OH^-}\)
\(\rm{O^{2-}\ +\ H_2O\ →\ 2OH^-}\)
これらの反応式を合わせると,下のようになります.
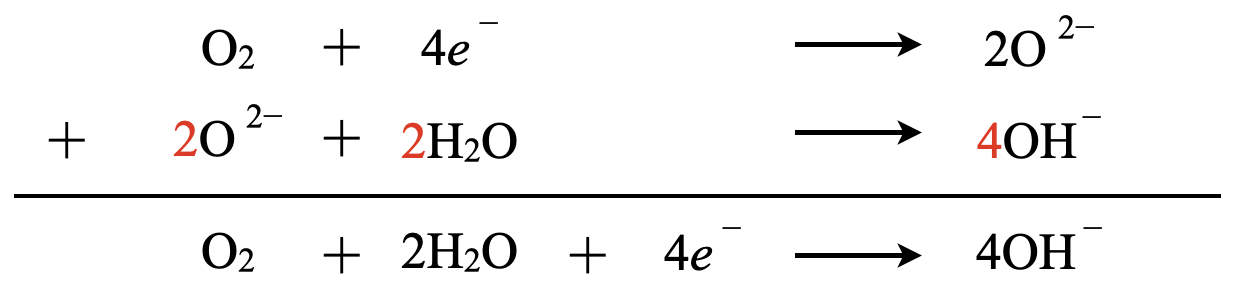
\(\rm{O_3}\)は\(\rm{O_2}\)と\(\rm{O}\)原子に分解されます.そしてO^{2-}を先程説明したように酸性・中性条件で考えるとそれぞれの反応を完成させることができます.
\(\rm{O_3\ }\)\(+\ 2e^-\ →\ \rm{O_2\ +\ O^{2-}}\)
酸性条件\(\rm{:O^{2-}\ →\ H_2O}\)
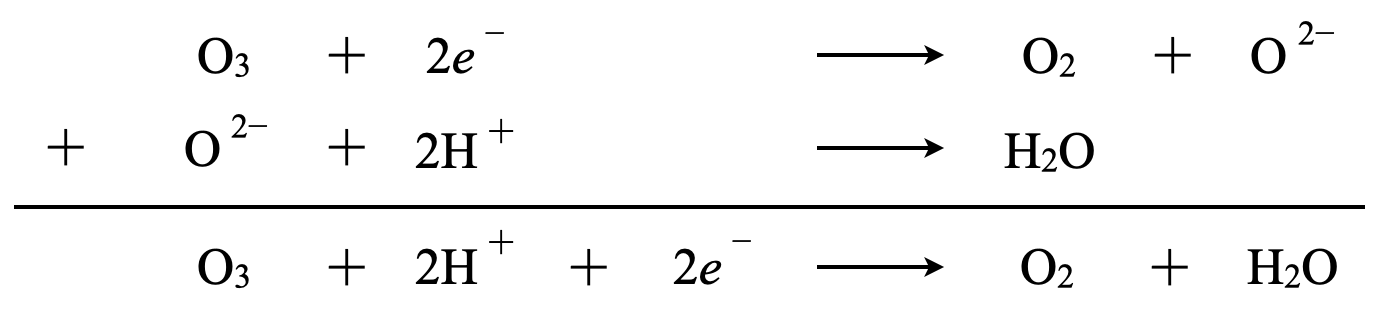
中性条件\(\rm{:O^{2-}\ →\ OH^-}\)
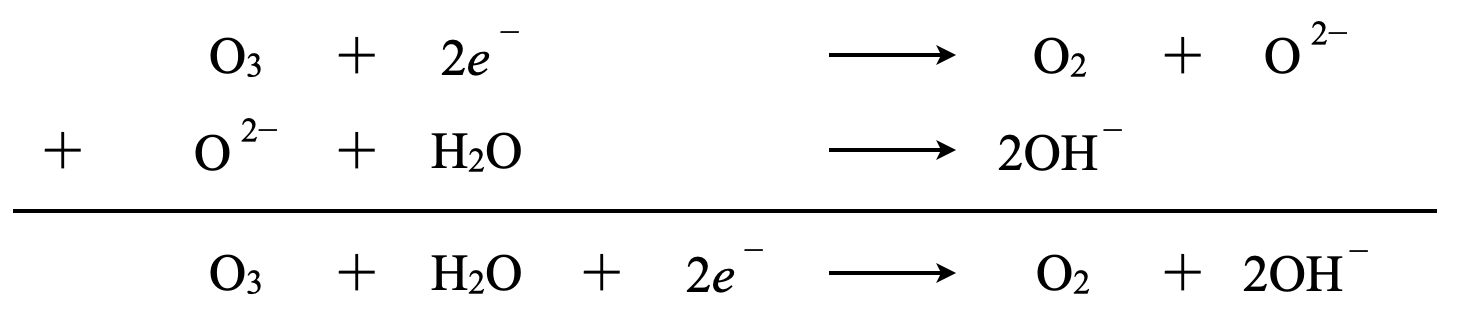
このように考えていくと,暗記の量を減らしながら理解していくことができますね!
\(\rm{{MnO_4}^-}\)(硫酸酸性条件)\(\rm{:{MnO_4}^-\ +\ 8H^+\ }\)\(+\ 5e^-\ →\ \rm{Mn^{2+}\ +\ 4H_2O}\)
\(\rm{{MnO_4}^-}\)(中性条件)\(\rm{:{MnO_4}^-\ +\ 2H_2O\ }\)\(+\ 3e^-\ →\ \rm{MnO_2\ +\ 4OH^-}\)
\(\rm{{Cr_2O_7}^{2-}}\)(硫酸酸性条件)\(\rm{:{Cr_2O_7}^{2-}\ +\ 14H^+\ }\)\(+\ 6e^-\ →\ \rm{2Cr^{3+}\ +\ 7H_2O}\)
\(\rm{Mn}\)の酸化数は大きく変化し,\(0\)から\(+7\)まであります.
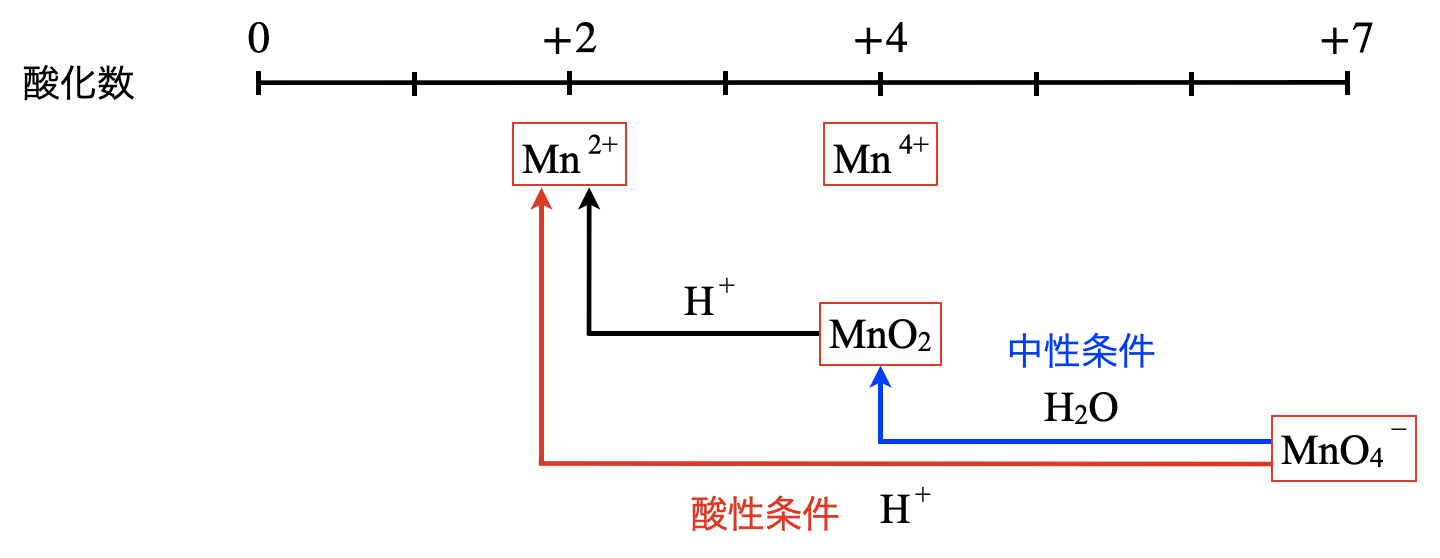
酸性条件であれば,\(\rm{H^+}\)が十分にあるので,\(\rm{{MnO_4}^-}\)のすべての\(\rm{O^{2-}}\)は中和されます.そして\(\rm{Mn^{2+}}\)へ変化します.
\(\rm{{MnO_4}^-\ +\ 8H^+\ }\)\(+\ 5e^-\ →\ \rm{Mn^{2+}\ +\ 4H_2O}\)
一方で,中性条件では\(\rm{H^+}\)がそんなに多くはありませんよね.そのため\(\rm{O^{2-}}\)がすべて脱離することはなく途中の\(\rm{MnO_2}\)となり沈殿します.そしてこのときの\(\rm{H^+}\)は\(\rm{H_2O}\)由来なので,一手間かける必要がありますね!
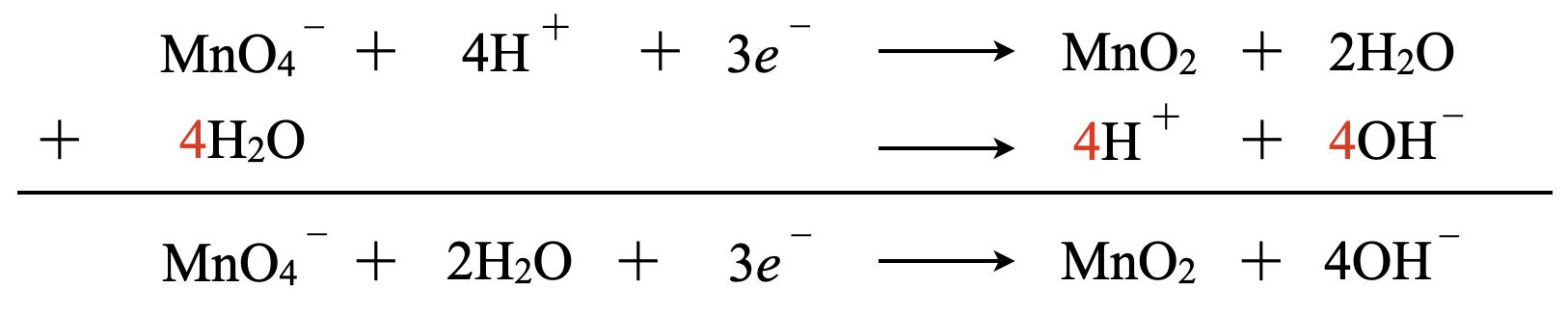
希硝酸\(\rm{:{NO_3}^-\ +\ 4H^+\ }\)\(+\ 3e^-\ →\ \rm{NO\ +\ 2H_2O}\)
濃硝酸\(\rm{:HNO_3\ +\ H^+\ }\)\(+\ e^-\ →\ \rm{NO_2\ +\ H_2O}\)
熱濃硫酸\(\rm{:H_2SO_4\ +\ 2H^+\ }\)\(+\ 2e^-\ →\ \rm{SO_2\ +\ 2H_2O}\)
硝酸から考えていきましょう.
\(\rm{HNO_3}\)が酸化剤として作用するときは,\(\rm{NO_2\ or\ NO}\)までにしかなりません.ただ,この\(\rm{NO_2}\)に水が多量に存在するときには,以下の反応が起こります.
\(\rm{3NO_2\ +\ H_2O\ →\ 2HNO_3\ +\ NO}\)
そのため希硝酸(水分を多く含む硝酸)は,\(\rm{NO}\)まで還元され,濃硝酸(水分をあまり含まない硝酸)は\(\rm{NO_2}\)までしか還元されないと覚えておきましょう!
\(\rm{H_2SO_4}\)は強い酸であり,とても安定しています.そのため通常はこの\(\rm{S}\)が酸化剤として働くことはありません.この\(\rm{H_2SO_4}\)を水分が少ない状態(濃\(\rm{H_2SO_4}\))でさらに加熱していくことで,分解していくことができます.
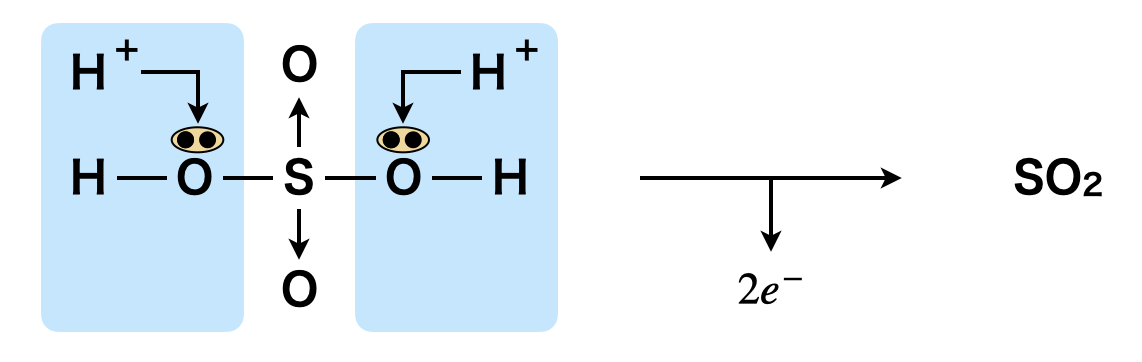
酸化剤かつ還元剤
\(\rm{H_2O_2}\)
- 酸化剤
- 酸性条件:\(\rm{H_2O_2\ +\ 2H^+\ }\)\(+\ 2e^-\ →\ \rm{2H_2O}\)
- 中性条件:\(\rm{H_2O_2\ }\)\(+\ 2e^-\ →\ \rm{2OH^-}\)
- 還元剤
- \(\rm{H_2O_2\ →\ O_2\ +\ 2H^+\ }\)\(+\ 2e^-\)
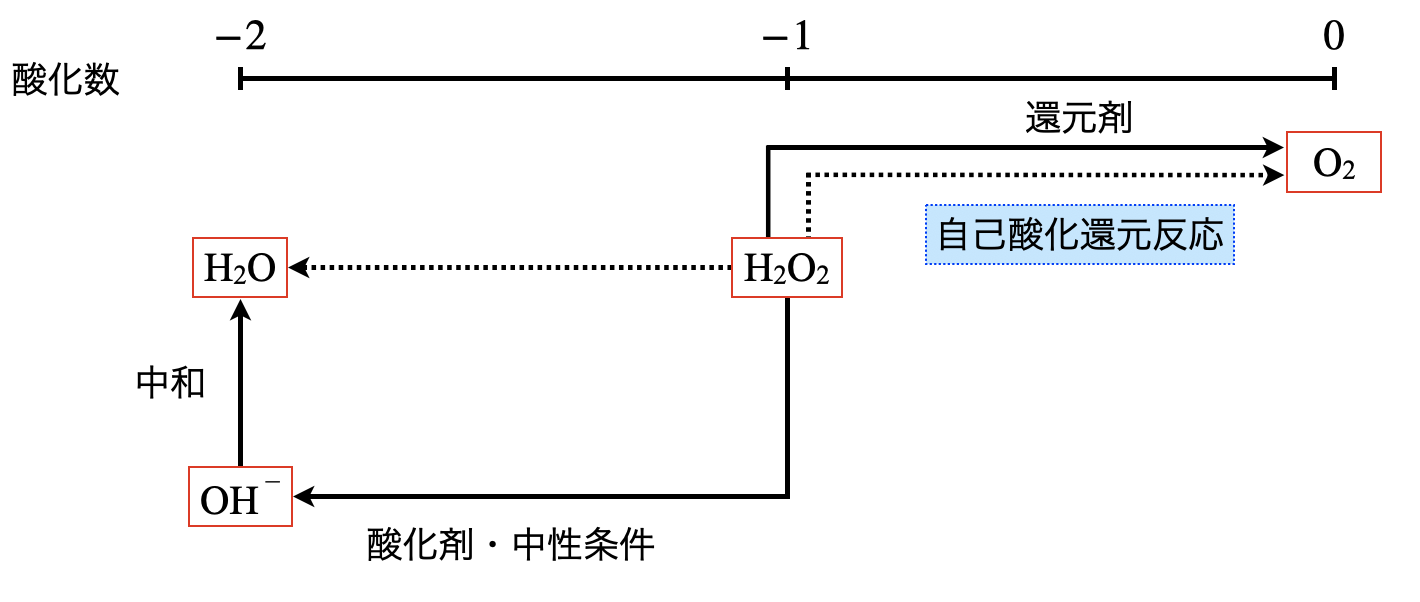
\(\rm{H_2O_2}\)の\(\rm{O}\)の酸化数は\(-1\)で,不安定です.そのため,酸化剤として働く(電子を奪う)と酸化数は\(-2\)に,還元剤として働く(電子を放出する)と酸化数は\(0\)になります.
①酸化剤
酸化剤として働くときは,\(\rm{H_2O_2}\)は\(\rm{OH^-}\)イオンに変化します.
\(\rm{H_2O_2\ }\)\(+\ 2e^-\ →\ \rm{2OH^-}\)
そして酸性条件の場合には,さらに中和されて\(\rm{H_2O}\)となります.
\(\rm{OH^-\ +\ H^+\ →\ H_2O}\)
先程の半反応式と合わせると,酸性条件では以下のようになります.
\(\rm{H_2O_2\ +\ 2H^+\ }\)\(+\ 2e^-\ →\ \rm{2H_2O}\)
②還元剤
一方で還元剤として働くときは,\(\rm{H_2O_2}\)は\(\rm{O_2}\)に変化します.
\(\rm{H_2O_2\ →\ O_2\ +\ 2H^+\ }\)\(+\ 2e^-\)
③自己酸化還元反応
また反応相手として酸化剤や還元剤が他に存在しないときは,\(\rm{H_2O_2\ →\ H_2O_2}\)というように自分自身で\(e^-\)がいったりきたりします.これを自己酸化還元反応といいます.自己酸化還元反応では\(\rm{H_2O_2\ →\ O_2}\)へと変化します.
\(\rm{H_2O_2\ +\ H_2O_2\ →\ 2H_2O\ +\ O_2}\)
\(\rm{SO_2}\)
- 酸化剤
- \(\rm{SO_2\ +\ 4H^+\ }\)\(+\ 4e^-\ →\ \rm{S\ +\ 2H_2O}\)
- 還元剤
- \(\rm{SO_2\ +\ 2H_2O\ →\ SO_4^{2-}\ +\ 4H^+\ }\)\(+\ 2e^-\)
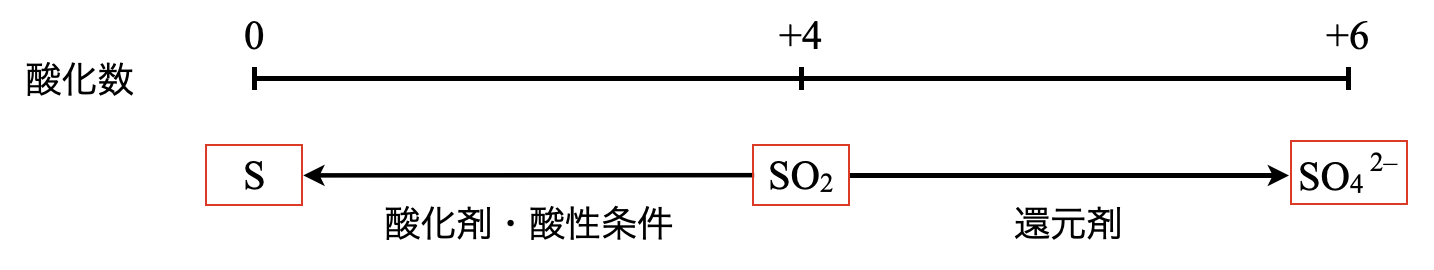
\(\rm{SO_2}\)の酸化数は\(+4\)であるため,酸化剤として酸化数\(0\)に変化するか,還元剤として\(+6\)に変化する\(2\)通りが存在します.
①酸化剤
酸化剤として作用するには,酸性条件が必要となります.
\(\rm{SO_2\ +\ 4H^+\ }\)\(+\ 4e^-\ →\ \rm{S\ +\ 2H_2O}\)
②還元剤
\(\rm{SO_2\ +\ 2H_2O\ →\ SO_4^{2-}\ +\ 4H^+\ }\)\(+\ 2e^-\)
ここで覚えておいてほしいのは,還元性気体といえば,\(\rm{H_2S}\)と\(\rm{SO_2}\)ということです.これはすぐに浮かぶようにしておいてくださいね!
さて,酸化剤にも還元剤にもなりうる\(\rm{H_2O_2}\)と\(\rm{SO_2}\)ですが,これらがともに存在するときには,どちらが酸化剤,還元剤になるのでしょうか?
それは\(\rm{H_2O_2}\)が酸化剤,\(\rm{SO_2}\)が還元剤として作用し,\(\rm{H_2SO_4}\)が生成します.
ハロゲン元素
最後に頻出のハロゲン元素についてまとめておきます.
ハロゲン元素の電気陰性度は\(\rm{F(4.0) > Cl(3.0) > Br(2.8) > I(2.5)}\)となり,単体の酸化剤としての強さは,\(\rm{F_2 > Cl_2 > Br_2 > I_2}\)となります.酸化剤は電子を引き付けるのが好きなため,電気陰性度の順番通りになるのですね!
還元剤として作用するときの強さは,酸化剤の順番の逆になり,\(\rm{I^- > Br^- > Cl^- > F^-}\)となります.
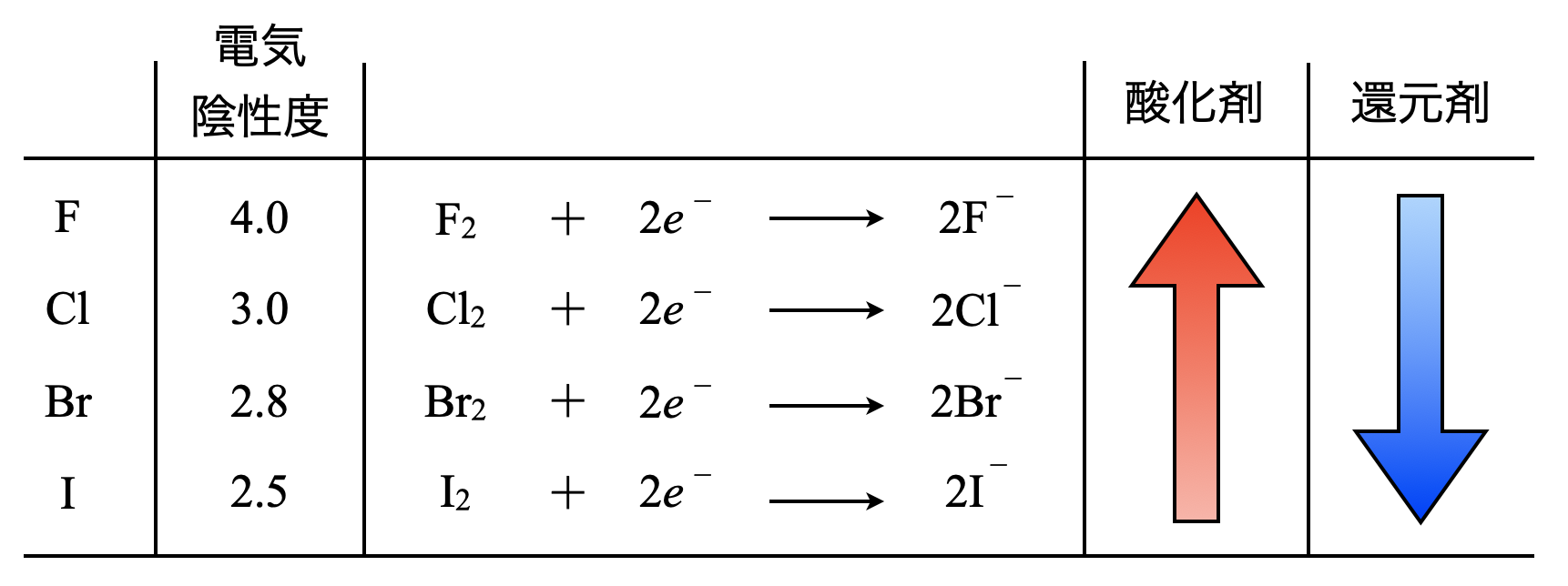
ハロゲン元素のうち\(\rm{I_2}\)は酸化剤として働きますが,\(\rm{I^-}\)は還元剤としての働きもありますよ!
今回は酸化剤や還元剤についてまとめました!まずは最初にまとめた表を頭に入れて,その反応式についても書けるようにしていきましょう!少しずつ努力することが点数アップに近づきますよ!



コメント