今回のメニューです。
✅原子量
✅分子量
✅式量
今回の記事を読んでいただくと、化学の超基礎かつ超基本である原子量について完全に理解することができます。最後まで丁寧に解説していくので、ぜひ最後までご覧ください!
また、わからないことはぜひコメント欄までお願いします。
解説してほしい分野があればぜひ次の記事のコメント欄で教えてくださいね!

原子量
原子量を理解する前に、「絶対質量」と「相対質量」について理解していきましょう!
絶対質量
絶対質量とは、原子の実際の質量のことをいいます。
下の表のように、原子\(1\)個の質量は\(\rm{10^{-23}\ g\ }\)程度と非常に小さい値です。絶対質量の単位は、\(\rm{[g]}\)です。
|
原子
|
絶対質量 \(\rm{[g]}\)
|
|
\(\rm{^1H}\)
|
\(1.6735×10^{-24}\)
|
|
\(\rm{^{12}C}\)
|
\(1.9926×10^{-23}\)
|
|
\(\rm{^{16}O}\)
|
\(2.6560×10^{-23}\)
|
このような小さな値を扱うことは非常に大変です。実際に毎回\(10^{-23}\)と書くのはめんどくさいですよね。
そのために作られたのが、次に紹介する相対質量です。
原子の実際の質量であり、単位は\(\rm{g}\)!
相対質量
まずは、相対という辞書的な意味を調べてみましょう。
相対とは、「他のものとの関係の中で成り立つものやこと」とあります。
つまり、相対質量とは、実際の原子の質量を比で表したものです。
もっと詳しくみていきましょう。
この基準となる原子を\(\rm{C}\)原子とし、この相対質量を\(12\)と定めました。
そうすると、\(\rm{H}\)原子、\(\rm{O}\)原子の相対質量は下のように求められます。
\(\rm{H}\)原子の相対質量:\(12× \large \frac{1.6735×10^{-24}}{1.9926×10^{-23}} \small =1.0078\)
\(\rm{O}\)原子の相対質量:\(16× \large \frac{2.6560×10^{-23}}{1.9926×10^{-23}} \small =15.995\)
相対質量はあくまで\(\rm{C}\)原子との質量の比なので、単位はありません。
|
原子
|
絶対質量 \(\rm{[g]}\)
|
相対質量
|
|
\(\rm{^1H}\)
|
\(1.6735×10^{-24}\)
|
\(1.0078\)
|
|
\(\rm{^{12}C}\)
|
\(1.9926×10^{-23}\)
|
\(12\)
|
|
\(\rm{^{16}O}\)
|
\(2.6560×10^{-23}\)
|
\(15.995\)
|
各原子の重さの比であり、単位なし!
原子量
それでは、次に原子量を解説していきます。
多くの元素には、同位体、つまり相対質量の異なる原子が存在しています。
なので、元素の原子量を求めるには、この存在比率を加味して求める必要があります。
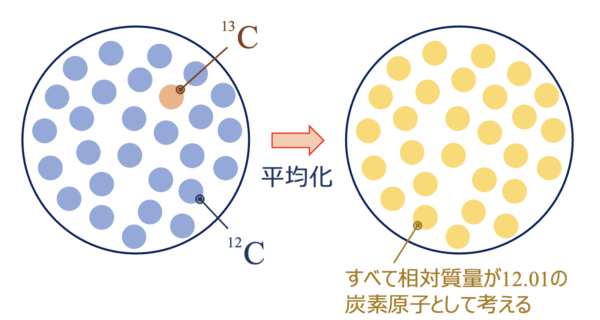
まずは、簡単に考えていきましょう。複雑な問題ほど簡単化することが重要です。
ここに\(\rm{A}\)原子が\(5\)個あるとします。
そしてそれぞれの相対質量が\(12\)、\(12\)、\(12\)、\(13\)、\(13\)であるとします。
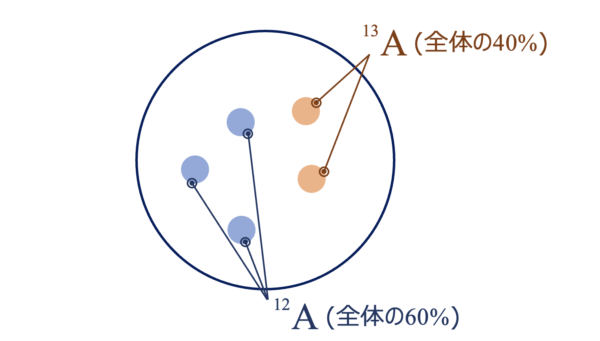
この場合、
相対質量が\(12\)の\(\rm{A}\)原子は\(\large \frac{3}{5} \small =60 \%\)
相対質量が\(13\)の\(\rm{A}\)原子は\(\large \frac{2}{5} \small =40 \%\)
であることがわかります。
なので、この割合を加味すると、
\(\rm{A}\)原子の原子量:\(12×0.6+13×0.4=12.4\)
と求めることができます。
では、実際の問題を解いてみましょう。
先ほどの解説と全く同じように考えることで、解くことができます。
\(\rm{^{35}Cl}\)(相対質量\(34.97\))と\(\rm{^{37}Cl}\)(相対質量\(36.97\))の\(2\)種類の同位体からなり、それぞれの存在比は\(75 \%\)、\(25 \%\)である。塩素の原子量は?
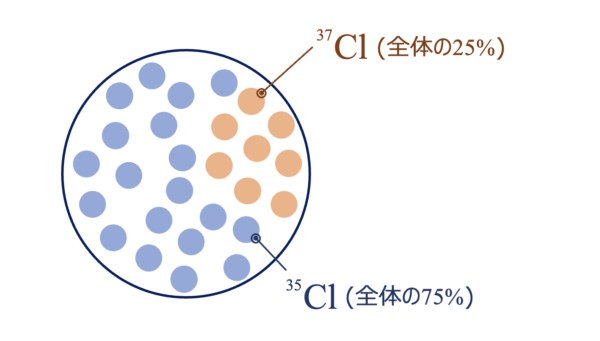
このような図を書くと、先ほど説明した問題とまったく同じように考えることができます。
\(\rm{^{35}Cl}\)(相対質量:\(34.97\)):\(75 \%\)
\(\rm{^{37}Cl}\)(相対質量:\(36.97\)):\(25 \%\)
\(\rm{Cl}\)の原子量:\(34.97×0.75+36.97×0.25=35.47\)
相対質量×存在比率で求める!単位なし!
分子量
次は、分子量について解説していきます。
原子量を理解できれば、分子量も簡単に理解することができます。
分子量とは、\(\rm{C}\)原子(相対質量 \(12\))を基準としたときの分子\(1\)個の相対質量のことをいいます。
分子量は原子量と同じ基準で考えているので、原子の原子量の総和として求めることができます。
例として、\(\rm{CO_2}\)の分子量を考えてみましょう。
\(\rm{CO_2}\)の分子量:(\(\rm{C}\)原子量)\(+\)(\(\rm{O}\)原子量)\(×\ 2=12+16×2=44\)
と簡単に求めることができます。
分子内の原子の原子量を合計したもの!単位なし!
式量
それでは最後に、式量について解説します。
イオンからなる物質や金属は、物質を表すのに組成式が用いられます。
組成式に含まれる原子の原子量の総和を式量といいます。
式量も簡単に求めることができます。
例として、\(\rm{NaCl}\)を考えてみましょう。
\(\rm{NaCl}\)の式量:(\(\rm{Na}\)原子量)\(+\)(\(\rm{Cl}\)原子量)\(=23.0+35.5=58.5\)
となります。
組成式に含まれる原子の原子量の合計!単位なし!
まとめ
今回は、化学の基本である原子量、分子量、式量について解説しました。
そしてこれらを理解するための必要道具である絶対質量と相対質量の違いについても解説しました。
特に、一般的には相対質量で考えていくので、しっかりと理解しておきましょう。
ここが理解できれば、あとは簡単です。
・分子の相対質量→分子量
・イオン、金属の相対質量→式量
になるというわけです。
私はYouTubeでも高校化学の解説をしているので、ぜひそちらもご覧ください。



コメント