今回は,緩衝溶液の実践編になります.
実際の計算問題について習得していきましょう!
緩衝溶液の解説編についてはこちらにあります.
緩衝溶液の基礎をまだ理解できていない方は,是非こちらからご覧ください.
緩衝溶液(解説編)
それでは今日も頑張っていきましょう!
緩衝溶液(パターン1)
今回は以下の問題について考えていきましょう.
\(\rm{CH_3COOH}\)の\(K_{\rm{a}} = 2.0 × 10^{-5}\ \rm{mol/L}\)
こちらの溶液は\(\rm{CH_3COOH}\)と\(\rm{CH_3COONa}\)の混合であるため,緩衝溶液です.
緩衝溶液の平衡定数は,以下のようになります.
\(K_{\rm{a}} = \large \frac{n_{\rm{CH_3COO}^-}}{n_{\rm{CH_3COOH}}} \small [\rm{H}^+] \)
\(\rm{CH_3COOH}\)のモル \(= 0.1 × 10 = 1.0\ \rm{mmol}\)
\(\rm{CH_3COO}^-\)のモル \(= 0.1 × 20 = 2.0\ \rm{mmol}\)
ここで,「mmol」という単位を使うことがポイントです!!
「mmol」という単位が出てきましたが,タイプミスではありませんよ!
「mm」や「mg」などはみなさん使ったことありますよね!?
この「m」は10-3倍という意味です.
なので,答案で書かなければ,自分で考える上ではこちらの方が計算しやすくベターです!
これから\([\rm{H}^+]\)を求めることができます.
\(K_{\rm{a}} = \large \frac{2.0}{1.0} \small [\rm{H}^+] = 2.0 × 10^{-5}\)
\([\rm{H}^+] = 1.0 × 10^{-5}\ \rm{mol/L}\)
このように解くと,非常に簡単に解けますね!!
今回の溶液に加えた\(\rm{HCl}\)の物質量をまず初めに計算しておきましょう!
\(\rm{HCl}\)のモル\( = 0.1 × 1 = 0.1\ \rm{mmol}\)
\(\rm{CH_3COOH}\ +\ \rm{CH_3COONa}\)の溶液に\(\rm{HCl}\)を加えると,以下の反応が進行します.
CH3COONa + HCl → CH3COOH + NaCl
この反応での物質量変化を考えてみましょう!
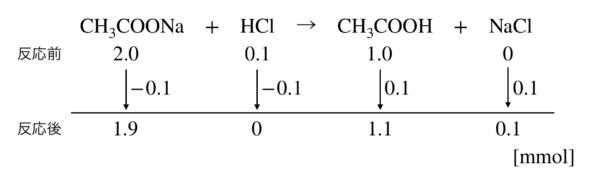
上の反応式では,\(\rm{NaCl}\)の反応前が\(0\)となっているため,反応が進行します.
\(\rm{CH_3COONa}\)と\(\rm{HCl}\)で先に「\(0\)」となったところで反応は終了します.
そのため上の反応式では,反応が\(0.1\ \rm{mmol}\)だけ進行しています.
これから
\(K_{\rm{a}} = \large \frac{1.9}{1.1} \small [\rm{H}^+] = 2.0 × 10^{-5}\)
\([\rm{H}^+] = 1.06 × 10^{-5}\ \rm{mol/L}\)
と求まります.
ここで,\([\rm{H}^+]\)を比較してみましょう.
ほとんど\([\rm{H}^+]\)が変化していないことが分かりますね!
\(\rm{pH}\)に直すと,\(0.03\)しか変化していないことになります.
これが緩衝溶液の効果となります.
緩衝溶液(パターン2)
では,次のパターンの問題を解いていきましょう.
先程とは少し違いますが,解き方は同じですよ!
\(\rm{CH_3COOH}\)の\(K_{\rm{a}} = 2.0 × 10^{-5}\ \rm{mol/L}\)
今回の問題は一見するとどのように解けばよいかわからないかもしれません,
しかし,一緒に考えていきましょう!
\(\rm{CH_3COOH}\)の一部が\(\rm{NaOH}\)と中和反応し,\(\rm{CH_3COONa}\)が生成されます.
ということは,溶液中には\(\rm{CH_3COOH}\)と\(\rm{CH_3COONa}\)が存在するため,緩衝溶液ですね!
CH3COOH + NaOH → CH3COONa + H2O
こちらの反応式の物質量変化を見てみましょう.
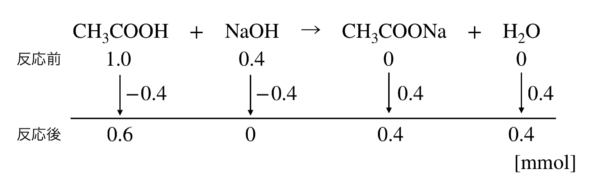
これより,
\(\rm{CH_3COOH}\)のモル \(= 0.6\ \rm{mmol}\)
\(\rm{CH_3COONa}\)のモル \(= 0.4\ \rm{mmol}\)
となりますので,
\(K_{\rm{a}} = \large \frac{0.4}{0.6} \small [\rm{H}^+] = 2.0 × 10^{-5}\ \rm{mol/L}\)
\([\rm{H}^+] = 3.0 × 10^{-5}\ \rm{mol/L}\)
と求められます.
緩衝溶液(パターン3)
次は,塩基性のパターンについて考えていきましょう!
これが最後の問題です.
最後まで頑張りましょう!
\(\rm{NH_3}\)の\(K_{\rm{b}} = 2.0 × 10^{-5}\ \rm{mol/L}\)
\(\rm{NH_3}\)に\(\rm{HCl}\)を加えると,以下のような反応が起こります.
NH3 + HCl → NH4Cl
物質量変化を考えると,下のようになります.
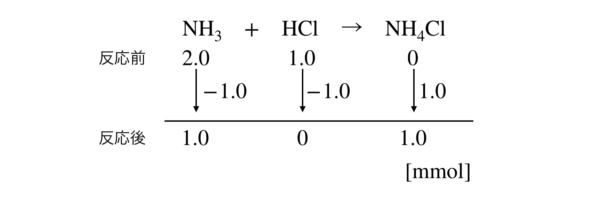
ここで,\(K_{\rm{b}}\)の式を確認してみましょう.
\(K_{\rm{b}}\)は以下の反応式の平衡定数です.
NH3 + H2O ⇄ NH4+ + OH–
これより,
\(K_{\rm{b}} = \large \frac{[\rm{NH_4^+}][\rm{OH}^-]}{[\rm{NH_3}]}\)
です.
この式にそれぞれの物質量(モル)を代入していきましょう.
\(K_{\rm{b}} = \large \frac{1.0}{1.0} \small [\rm{OH^-}] = 2.0 × 10^{-5}\)
\([\rm{OH^-}] = 2.0 × 10^{-5}\ \rm{mol/L}\)
となります.
\([\rm{H^+}] = \large \frac{K_{\rm{w}}}{[\rm{OH^-}]} \small = \large \frac{1.0 × 10^{-14}}{2.0 × 10^{-5}} \small = 5.0 × 10^{-10}\ \rm{mol/L}\)
本日は以上になります.
物質量を使えば非常に簡単で理解もしやすいと思います.
みなさんが今持っている参考書を見てみてください.
もっと長い解説が書いてあるはずです.
このやり方を完全にマスターして,緩衝溶液もスラスラ解けるように頑張っていきましょう!



コメント