
今回は電子親和力について解説していきます.
- 電子親和力に対する本質的な理解
- 電子親和力のグラフの理解
を特にポイントとしています.昨日の自分より少しでもレベルアップしていきましょう!
基礎事項を学習するにあたって
基礎的な内容である原子半径やイオン化エネルギーを学習するときに,暗記しておけばいいじゃん!と思っている方も多いかもしれませんが,それでは断片的な知識となってしまいます.今回の記事を読んでいただくとわかると思いますが,原子半径やイオン化エネルギーといった基礎的な事項はすべて密接に関係しています.
そのため,今回でいえば原子半径のなぜ?を理解できていれば,イオン化エネルギーについては簡単に理解してテストで点数が取れるようになると思います!
「急がば回れ」ということで,基礎をしっかりと理解して得点を伸ばしていきましょう!
電子親和力とは
電子親和力とは,原子が電子\(1\)コを取り込んで,\(1\)価の陰イオンになるときに放出されるエネルギーのことをいいます.
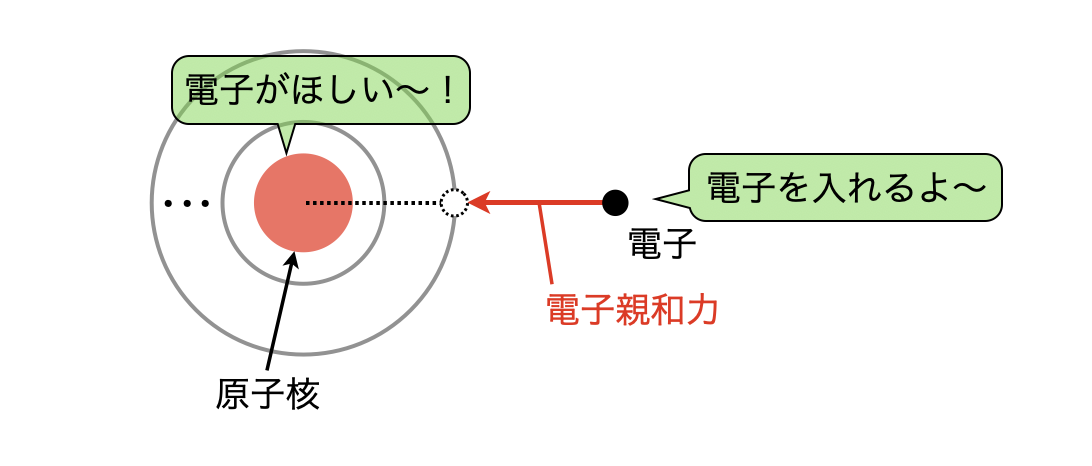
ということは,
電子親和力の大小 → 最外殻に電子を加えるのに必要なエネルギーの大小
と考えることができます.つまり,ポイントはイオン化エネルギーと同様に,原子と電子の間に作用する力です.この点をしっかりと理解した上で周期表をもとに解説していきます.
同一周期(横)における電子親和力の大小関係
周期表を横に見るときのポイントは,原子半径を意識しながら考える点でした.原子半径については以下の記事でまとめています!\(5\)分程度で読めるため,復習と思ってぜひ読んでみてください!

上の記事を読んでいただくとわかるのですが,原子半径は右にいくほど小さくなります.これは最外殻の電子に作用する引力が強くなるためでした.
そしてこの理由が,「陽子数の増加」です.
つまり原子の中心にあるプラス電荷をもつ陽子が増加するため,より強く引き付けられるというわけです.
次に,電子親和力を考えていきましょう.
プラス電荷をもつ陽子の多い原子は,強く電子を引き付けてくれます.そして原子核が電子を引き付ける力が大きいほど,陰イオンになるときには多くのエネルギーが発生します.そのため電子親和力も大きくなるというわけです.
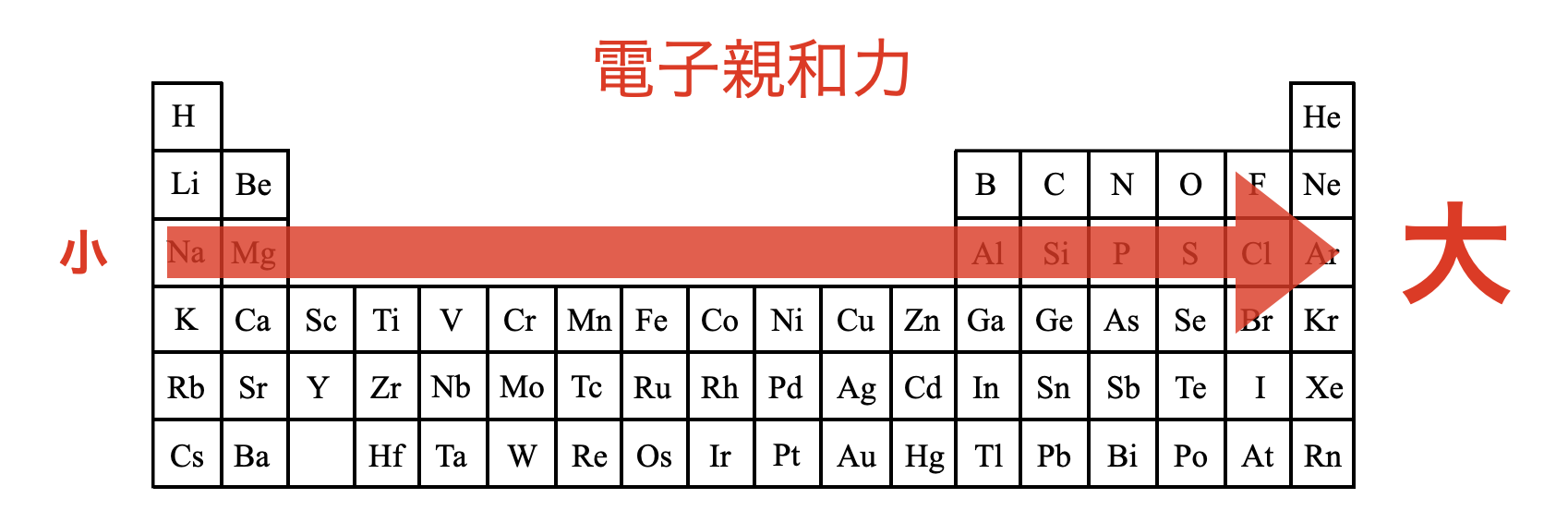
右にいくとプラス電荷をもつ陽子が多くなる
→電子が強く引き付けられる
→多くのエネルギーが発生する
→電子親和力が大きくなる
原子が電子\(1\)コを取り込むときに放出されるエネルギーが電子親和力となります.そのため文字通り「放出」なのでこれは発熱反応となります.
テストで聞かれることがあるのでおさえておきましょう!
電子親和力の注意点
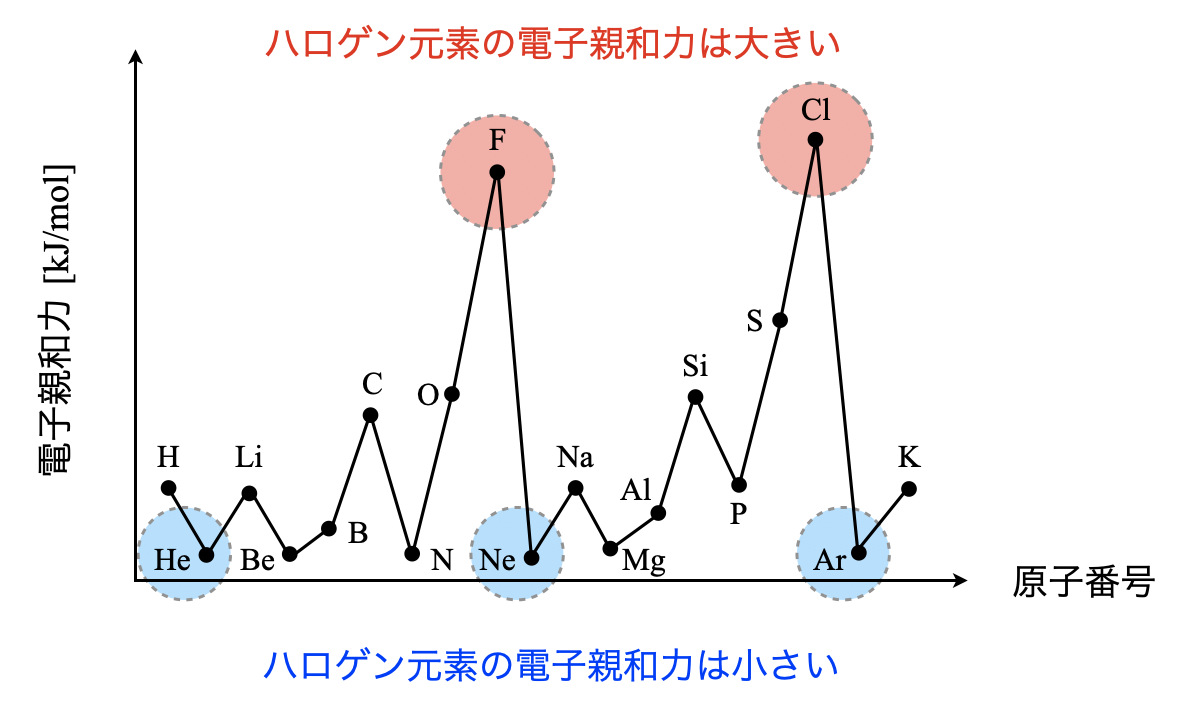
ここでの注意点は,電子親和力はハロゲンが最大で希ガスが最小になるという点です.この理由についても解説していきます.
イオン化エネルギーや電子親和力の大小関係を考えるときのポイントは,希ガス配置に着目!でした.希ガス配置になった原子やイオンはとても安定しているので,ちょっとやそっとでは電子を出し入れすることはできないためです.
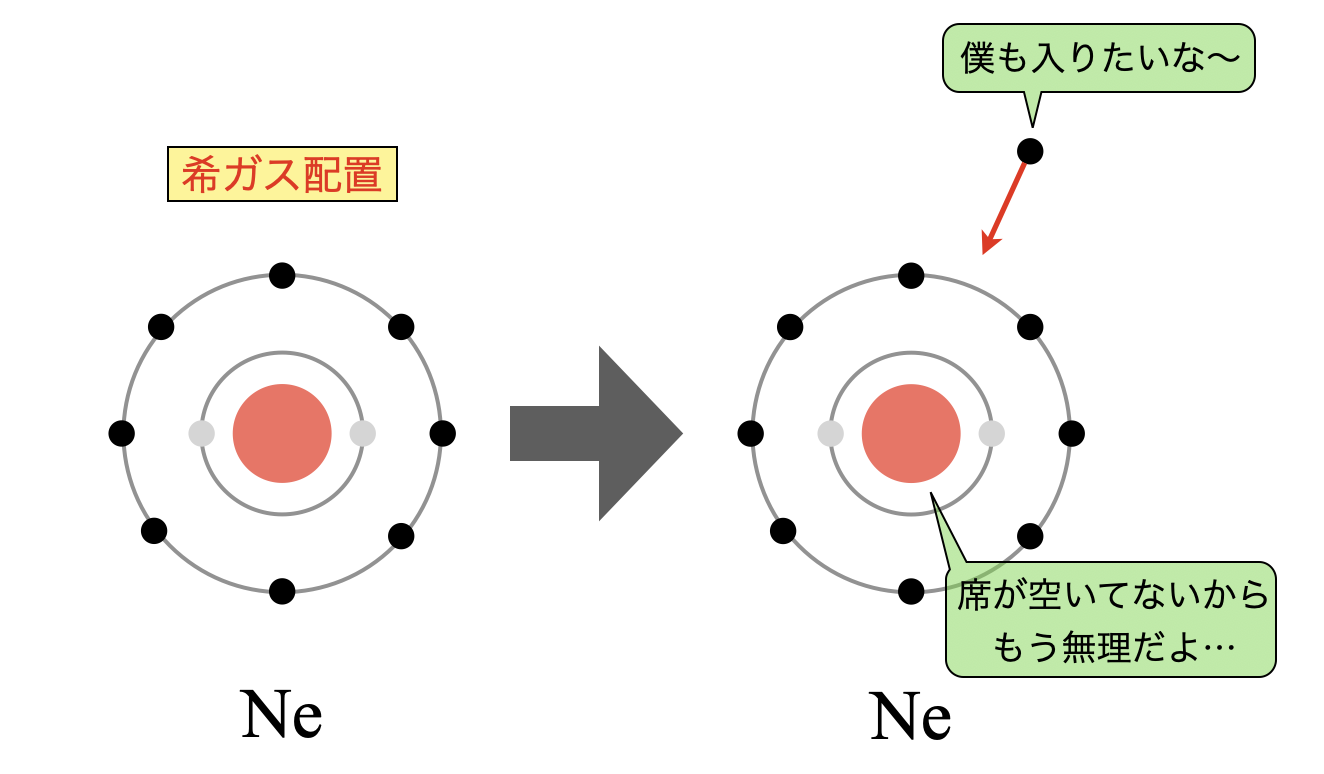
希ガス元素
希ガス元素はすでに希ガス配置であり同一周期で最も安定しているので,その中にさらに電子を押し付けることはできません.そのため希ガスの電子親和力は最小になります.
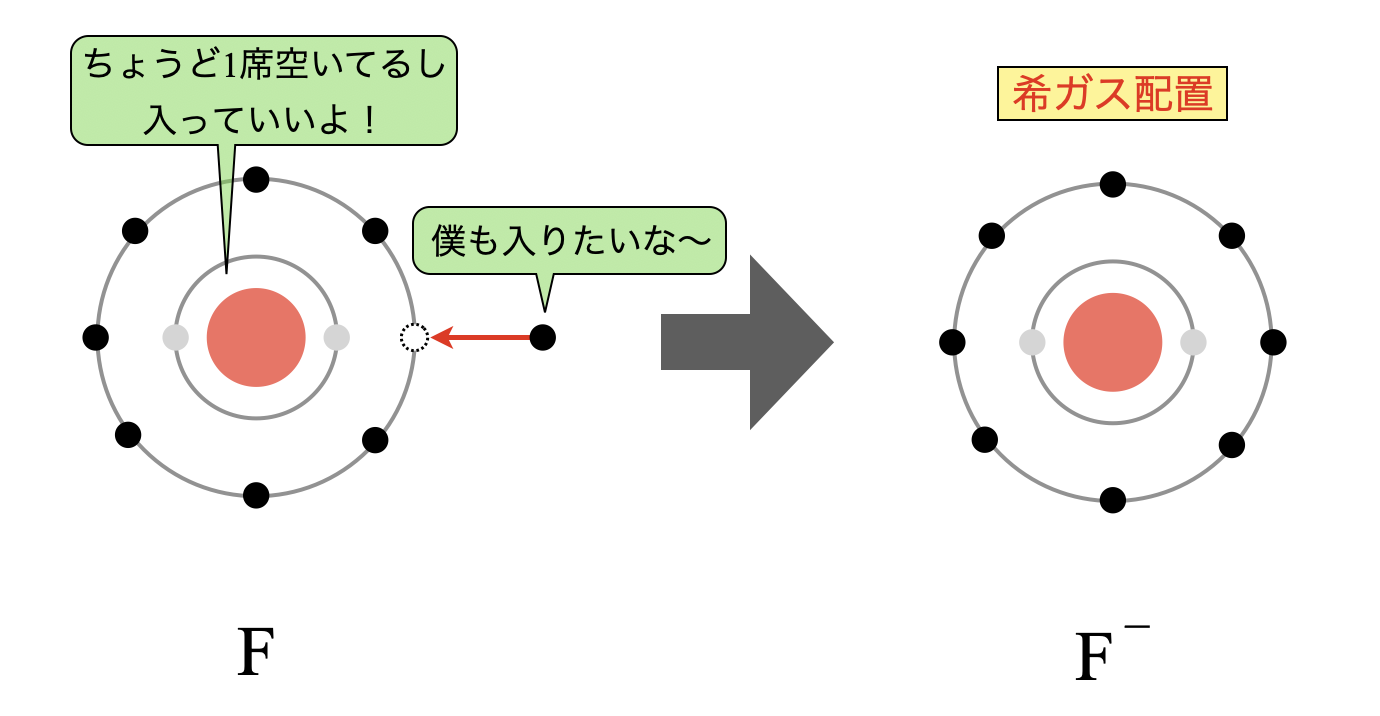
ハロゲン元素
一方で,ハロゲン元素はちょうど電子の席が\(1\)つ空いていて,これが埋まることで希ガス配置になり逆に安定します.そのためハロゲン元素は電子を引き付けやすくなり,電子親和力が大きくなります.
電子親和力のまとめ
同一周期において
- ハロゲン元素で電子親和力最大
- 希ガス元素で電子親和力最小
と覚えておいてくださいね!イオン化エネルギーは右にいくほど最大だったので,希ガスが最小になるという点が覚えておくべきポイントですね!
問題で頻出のグラフを示しておきます.
原子半径・イオン化エネルギー・電子親和力それぞれの関係性
原子半径は原子核に存在する陽子と電子の引力に関する考え方でした.そのため原子半径の考え方は,イオン化エネルギーの記事でも書きましたが,イオン化エネルギーや電子親和力を理解するもととなります.そして原子半径をもととして,
- イオン化エネルギー:電子を取り去るエネルギー
- 電子親和力:電子を他から奪い取ろうとするエネルギー
となります.
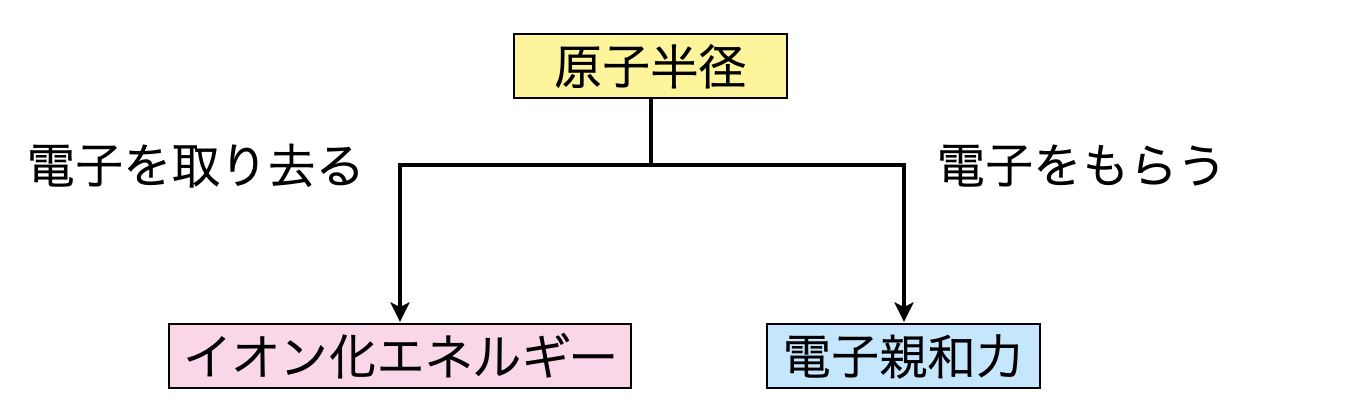
この考え方を頭に入れることで,それぞれの知識を1つにまとめることができますよ!
これからも皆さんのためになるような記事を発信していきます!
よければ\(\rm{Twitter}\)(chem_story1)のフォローもお願いしますね!



コメント