
\(\rm{You Tube}\)でも解説動画をあげているので,ぜひご覧ください!
濃度のあれこれ
濃度を学ぶ基礎として,まずは「溶媒」「溶質」「溶液」について解説していきましょう!
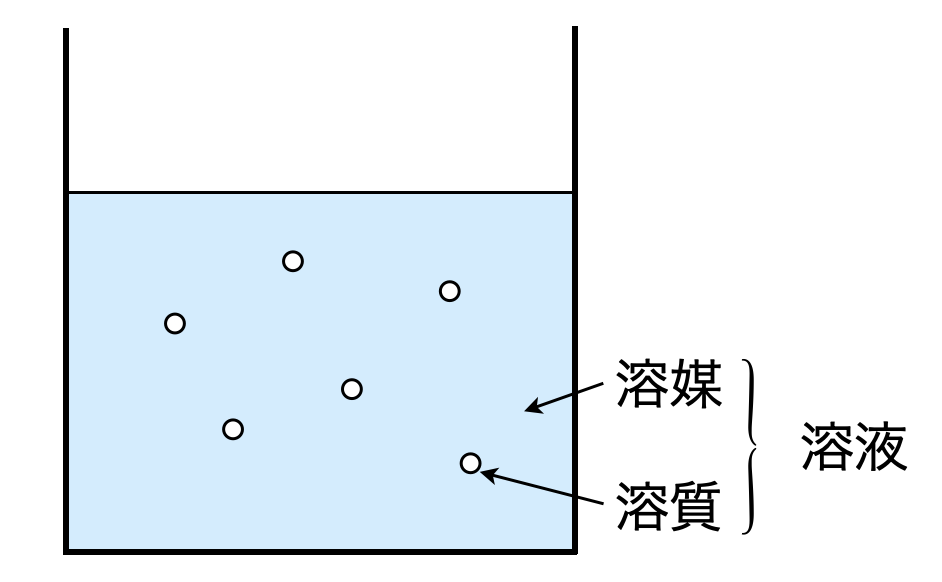
図のように液体中にある物質が混合して均一な液体となる現象を溶解といいます.そして溶液中の各物質には名前があります.溶けている物質:溶質,溶質を溶かす液体:溶媒,溶質+溶媒:溶液
これらの名前は言葉として覚えるのではなく,上図のようなイメージで覚えるようにしましょう!
それでは各濃度について求め方を見ていきましょう!
ここで,濃度について勉強するときの鉄則をお伝えします.
それは,
「濃度を求めるときはまず単位を考える」
ということです.
質量パーセント濃度
質量パーセント濃度は,溶液(=溶質+溶媒)に溶けている溶質の割合を表したものです.これを数式で表すと,以下のようになります.
\(\large \frac{溶質\ [\rm{g}]}{溶質\ [\rm{g}]+\ 溶媒\ [\rm{g}]}\ \small [\%]\)
この式は,溶液全体の中で溶けている物質で(溶質)がどれだけの割合存在しているのか,という意味です.
単位についてですが,\(\%\)は割合を意味していますが,「質量パーセント濃度」という言葉から質量:\(\rm{g}\)についての割合ということです!
モル濃度
モル濃度からはピンとこない人も多いと思いますので,ここでしっかりと覚えるようにしましょう!
モル濃度とは,溶液\(\rm{1\ L}\)中に溶けている溶質の物質量(モル)で表した濃度です.単位は\(\rm{mol/L}\)です.
モル濃度:\(\large \frac{溶質\ [\rm{mol}]}{体積\ [\rm{L}]}\)
モル濃度の単位は\(\rm{mol/L}\)ということを覚えておけば,最悪公式を忘れてしまっても思い出すことができますよ!
質量モル濃度
最後が質量モル濃度になります.
質量モル濃度とは,溶媒\(\rm{1\ kg}\)に溶けている溶質の物質量(モル)で表した濃度です.単位は\(\rm{mol/kg}\)です.
質量モル濃度:\(\large \frac{溶質\ [\rm{mol}]}{溶媒\ [\rm{kg}]}\)
練習問題
では,先ほど覚えた公式をもとに,濃度計算を実際にしてみましょう!
濃度を求めるときに大切なことを下にまとめておきます!
\(\rm{STEP1}\):求める濃度の単位確認!
まず,単位の確認が一番大切になります.
- 質量パーセント濃度\(→\%\)
- モル濃度\(\rm{→mol/L}\)
- 質量モル濃度\(\rm{→mol/kg}\)
\(\rm{STEP2}\):溶媒計算
要求される単位に合わせて溶媒を計算していきます!
\(\rm{STEP3}\):溶質計算
最後に溶質を計算することで,濃度を求めることができます.
\(\rm{STEP2}\)と\(\rm{STEP3}\)の溶媒・溶質についてはどちらを先に計算しても問題ありません!!
\(\rm{Na_2CO_3 \cdot 10H_2O\ 1\ mol}\)を\(\rm{1\ kg}\)の水に溶解した.この溶液の質量モル濃度は?
\(\rm{STEP1}\)
まずは求める濃度の単位の確認です.
質量モル濃度なので,\(\rm{mol/kg}\)ですね!
今回の問題では,\(\rm{Na_2CO_3 \cdot 10H_2O\ 1\ mol}\)が水に溶解すると,\(\rm{Na_2CO_3}\)が\(\rm{1\ mol}\),\(\rm{H_2O}\)が\(\rm{10\ mol}\)生じます.この点を注意して\(\rm{STEP2 \cdot STEP3}\)に進んでいきましょう!
\(\rm{STEP2}\):溶質
\(\rm{Na_2CO_3}\)が\(\rm{1\ mol}\)ですね!はい,これで溶質は完了!!
\(\rm{STEP3}\):溶媒
溶媒は\(\rm{H_2O}\)になります.最初の\(\rm{1\ kg}\)に加えて,\(\rm{Na_2CO_3 \cdot 10H_2O}\)が溶解したときに生じた\(\rm{H_2O}\)を加えて考える必要があります.そのため,
\(\rm{H_2O}:1\ +\ 10\ ×\ 18\ ×\ 10^{-3} = 1.18\ \rm{kg}\)
最後に質量モル濃度は溶質/溶媒なので,これを公式に当てはめればOKです!
\(\large \frac{1\ \rm{mol}}{1.18\ \rm{kg}} \small = 0.85\ \rm{mol/kg}\)
\(8.0 \%\)の\(\rm{NaCl}\)水溶液の密度は\(\rm{1.04\ g/cm^3}\)である.式量は\(\rm{NaCl=58.5}\)とする.
(\(1\))モル濃度は?
(\(2\))質量モル濃度は?
(\(1\))
\(\rm{STEP1}\)
求める濃度の単位は\(\rm{mol/L}\)です.ところが,問題文に\(\rm{L}\)の情報がありません.
そこで,このような問題は\(\rm{1\ L}\)であると仮定して解き進めていきましょう!
自分で数値を決めるときに,どんな状況でもいいというわけではありません.
今回の問題を見てみると,濃度を求める\(=\)溶液全体に占める溶質の割合を求めるということです!
このように割合を求めるときは,問題文に数値が与えられていなければ,自分で値を仮定して解いても答えは変わりません!そのため,溶液全体を\(\rm{1\ L}\)としても問題ありません!もし,\(\rm{2\ L}\)とすれば,下で計算する全ての値が\(2\)倍になりますが,割合は変わりませんよ!!!
\(\rm{STEP2}\):溶媒
\(\rm{1\ L}\)と決めて計算しているため,このままで\(\rm{OK}\)です!
\(\rm{STEP3}\):溶媒
単位の確認からすると,\(\rm{L→cm^3→g→mol}\)へと変換していく必要があります.
まずは,\(\rm{L→cm^3}\)です.
\(\rm{1\ L}\)とは,\(\rm{cm^3}\)の単位で表すと,\(\rm{1\ L = 1000\ cm^3}\)です!これは確実に覚えておきましょう!
次に,\(\rm{cm^3→g}\)です.
\(\rm{NaCl}\)水溶液の密度は\(\rm{1.04\ g/cm^3}\)であるため,溶液全体としては
\(\rm{1000\ cm^3\ ×\ 1.04\ g/cm^3 = 1040\ g}\)
となります.まず,ここまでついてこれていますか?
ただ,ここで求めた\(\rm{g}\)は溶液全体の質量になります.この中の\(8.0 \%\)が溶質:\(\rm{NaCl}\)なので,
\(\rm{NaCl}\)の質量:\(\rm{1040\ ×\ \large \frac{8.0}{100} \small = 83.2\ g}\)
となります.
最後に\(\rm{g→mol}\)に変換していきます.
式量が\(58.5\)なので,モル質量は\(\rm{58.5\ g/mol}\)です.よって,\(\rm{1\ L}\)あたりの\(\rm{NaCl}\)の物質量は,
\(\rm{\large \frac{83.2\ g}{58.5\ g/mol} \small = 1.42\ mol}\)
以上より,\(\rm{1.42\ mol/L}\)となります.
(\(2\))
\(\rm{STEP1}\)
質量モル濃度の単位は\(\rm{mol/kg}\)です.
\(\rm{STEP2}\):溶質
溶質の物質量は,先ほど求めた通り,\(\rm{1.42\ mol}\)です.
\(\rm{STEP3}\):溶媒
溶液全体は\(\rm{1040\ g}\)でした.これは,溶質+溶媒の質量です.そのため,
溶媒の質量 \(\rm{= 1040\ g\ -\ }\)溶質\(\rm{ = 1040\ -\ 83.2\ =\ 956.8\ g = 0.9568\ kg}\)
単位を間違えないようにしてくださいね!
よって,
\(\rm{\large \frac{1.42\ mol}{0.9568\ kg} \small = 1.48\ mol/kg}\)
みなさん,練習問題はどうでしたか?
要求される濃度の単位から必要となる値を求めていけば必ず求めることができます.この分野は練習あるのみですので,お手持ちの問題集でしっかりと復習してくださいね!私が厳選した参考書や問題集を紹介しているので,そちらも合わせて読んで,一緒にレベルアップしていきましょう!!




コメント