このような悩みをしっかりと解決していきます!
本記事では,溶解度積を図でスッキリと理解できるようにします!
それでは今日も最後まで一緒に頑張りましょう!!
溶解度積とは?
まずは,溶解度積の基礎から理解していきましょう!
難溶性の塩として,\(\rm{A_aB_b(s)}\)について一般的に考えてみましょう.
AaBb(s) ⇄ aA+ + bB–
ここで,sは固体(solid)を意味しています.
このときの平衡定数を溶解度積といいます.
\(K_{\rm{sp}} = [\rm{A}^+]^a [\rm{B}^-]^b\)
溶解度積(solubility product)は温度のみの関数であり,物質固有の定数です.
\([\rm{A}^+]^aと[\rm{B}^-]^b\)という溶解度のそれぞれの積で表しているので,溶解度積といいます.
溶解度積は,溶解度の積である\([\rm{A}^+]^a [\rm{B}^-]^b\)が\(K_{\rm{sp}}\)の値まで水に溶解できるということを表しています.
図で表すと考えやすいのです!
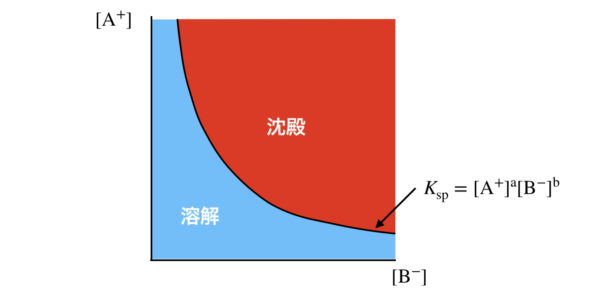
そんなに難しく考える必要はありませんよ!
ここで溶解度積の表し方についてみてみましょう!
一般的には平衡反応では,
\(K = \large \frac{[\rm{A}^+]^a [\rm{B}^-]^b}{[\rm{A_aB_b(s)}]}\)
となります.
ここで,\([\rm{A_aB_b(s)}]\)は固体のモル濃度であるため,一定とみなすことができます.
そのため,両辺に\([\rm{A_aB_b(s)}]\)をかけると,
\(K_{\rm{sp}} = K [\rm{A_aB_b(s)}] = [\rm{A}^+]^a [\rm{B}^-]^b\)
となります.
溶解度積(計算編①)
ではまず簡単な問題から解いてみましょう!
この溶液中に塩化銀が\(1.43 × 10^{-3}\ \rm{g}\)溶解している.
\(\rm{AgCl}\)の溶解度積は?
\(\rm{AgCl}\)のモル質量は\(143\ \rm{g/mol}\)である.
(\(2\))(\(1\))の溶液に,\(0.10\ \rm{mol/L}\)の塩酸(\(\rm{HCl}\))\(0.10\ \rm{mol/L}\)加えた.
このとき溶解している銀イオン濃度\([\rm{Ag^+}]\)は?
(\(1\))
まず,この溶液に何\(\rm{mol/L\ AgCl}\)が溶解しているのかを考えてみましょう.
\(1.0\ \rm{L}\)の溶液であるので,
\(\large \frac{1.43 × 10^{-3}\ \rm{g}}{1.0\ \rm{L}} \small = 1.43 × 10^{-3}\ \rm{g/L} = \large \frac{1.43 × 10^{-3}}{143.5} \small = 1.00 × 10^{-5}\ \rm{mol/L}\)
となります.
つまり,\([\rm{Ag^+}] = [\rm{Cl^-}] = 1.00 × 10^{-5}\ \rm{mol/L}\)となって,溶解平衡に達したことがわかります.
関係性を表すと,下のようになります.

これより,
\(K_{\rm{sp}} = [\rm{Ag^+}][\rm{Cl^-}] = 1.00 × 10^{-10}\ \rm{(mol/L)^2}\)
となります.
(\(2\))
続いて,\(\rm{HCl}\)を加えたときについて考えていきましょう!
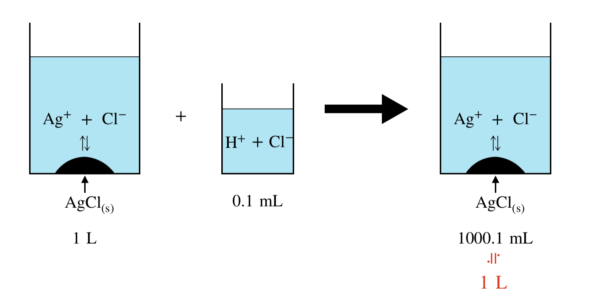
上の図では,加えた\(\rm{HCl}\)をだいぶ大きく書きましたが,実際は\(0.1\ \rm{mL}\)なので,
加えた後の溶液体積は\(1\ \rm{L}\)と近似して考えて問題ないです!
化学の問題では,よく近似して計算することがありますが,実際にどれほどの値のときに近似してよいのかを迷ってします人がたくさんいると思います.
実際に受験生のとき私もそのような経験があります!
具体的には,\(A+B\)や\(A-B\)において,\(\large \frac{B}{A} \le \frac{1}{100}\)の場合は,
近似することができ\(A+B \approx A,A-B \approx A\)となります.
ここで,上の分数の意味ですが,これは,\(A\)が\(B\)よりも100倍以上大きいという意味を表しています!
今回の場合は問題なく近似できますね!
それでは,話を問題に戻しましょう.
今回は溶液の体積が増加するため,「モル」で考えた方が簡単になり,ミスも減ります!
加えた\(\rm{HCl}\)のモルは,\(0.01\ \rm{mmol}\)となります.
この「\(\rm{mmol}\)」という単位を是非使いこなせるようにして下さいね!
この溶液は(\(1\))が終わった段階で,溶解平衡に達していました.
そこへ\(\rm{HCl}\)を加えることで,\(\rm{Cl^-}\)が加えられたため,ル・シャトリエの原理より平衡が左に移動して再び溶解平衡となります.
平衡移動が\(x\ [\rm{mmol}]\)とすると,以下のようになります.
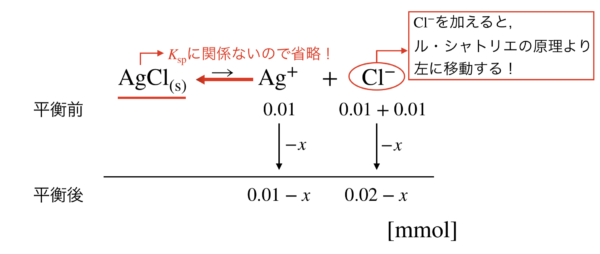
これらの値を濃度に直し,\(K_{\rm{sp}} = [\rm{Ag^+}][\rm{Cl^-}]\)の式に代入して,\(x\)を求めていきます.
\(K_{\rm{sp}} = [\rm{Ag^+}][\rm{Cl^-}] =\)\(\large \frac{0.01 – x}{1000} \cdot \frac{0.02 -x}{1000} \small = 1.00 × 10^{-10}\)
\(x^2 – 0.03 x + 1.00 × 10^{-4} = 0\)
\(x = \large \frac{3 – \sqrt{5}}{2} \small × 10^{-2}\ \rm{mmol}\)
ここで.求めた\(x\)の単位は\(\rm{mmol}\)になるので,注意して下さい!
これから\([\rm{Ag^+}]\)は,
\([\rm{Ag^+}] = \left(0.01 – \large \frac{3 – \sqrt{5}}{2} \small × 10^{-2} \right) × 10^{-3} = \large \frac{\sqrt{5} – 1}{2} \small × 10^{-5}\ \rm{mol/L} = 6.2 × 10^{-6}\ \rm{mol/L}\)
となります.
少し計算がややこしかったと思いますが,練習すれば必ずできるようになるので,何度も練習して下さいね!
次回は溶解度積についてもう少し解説したい定番の問題がありますので,そちらを解説していきますね!
今日はお疲れ様でした!



コメント