
- 酸化数ってなんで考えるの?
- 実際に酸化数の求め方を知りたい!
- ポーリングの電気陰性度使った考え方
を特にポイントとしています.昨日の自分より少しでもレベルアップしていきましょう!
酸化還元反応の定義
酸化還元反応には,酸素基準と電子基準,水素基準の\(3\)通りがあり,一般的には電子基準が,有機化学では水素基準が使われています.それらを下の表にまとめておきますね!
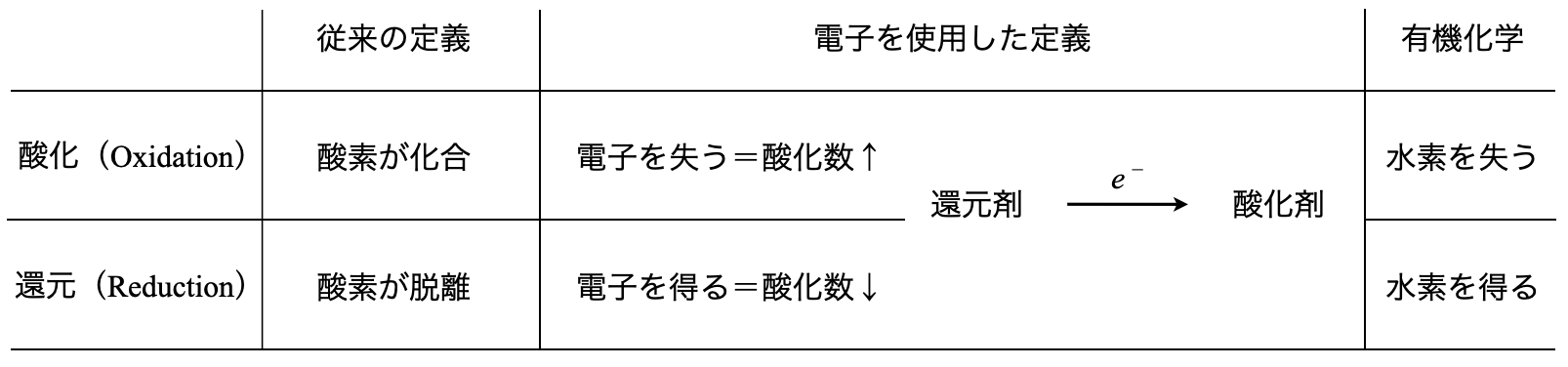
これらをしっかりと覚えてその都度使い分けができるようになっておきましょう.以下では,それぞれについて詳細に解説していきます!
酸素基準から電子基準
従来の考え方では,酸素と化合するのが酸化,酸素が脱離するのが還元と定義されていました.ところが,これでは酸素を使わない反応に対しては定義できません.そこで,原子の構造が解明されるにつれて,電子のやりとりで酸化還元を定義するようになりました.
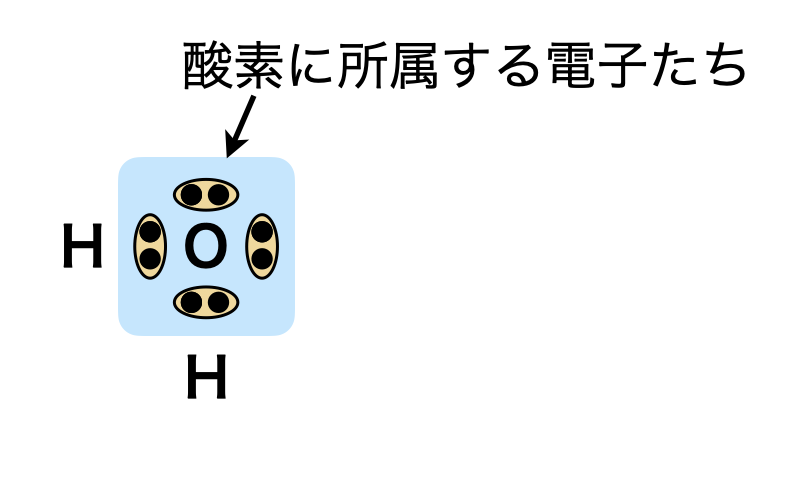
例えば水素と酸素で水が生成する反応を考えてみましょう.
\(\rm{2H_2\ +\ O_2\ →\ 2H_2O}\)
従来の考え方では,水素は酸素と化合するので,「酸化される」ということになります.ただ,電子を取り入れた新しい考え方では,ポーリングの電気陰性度という考え方を使います.この考え方についての詳細は,後日記事にしますが,数値については頻出の物質については覚えておいても損はありませんよ!
\(\rm{O:3.5}\),\(\rm{H:2.1}\)なので,\(\rm{H_2O}\)の結合中の電子は\(\rm{O}\)に引き付けられていることがわかります!つまり,水素からすれば酸素に電子を奪われたことになるというわけです.
水素基準
水素による酸化還元の考え方については,主に有機化学で活用します.下の反応を見てみましょう.
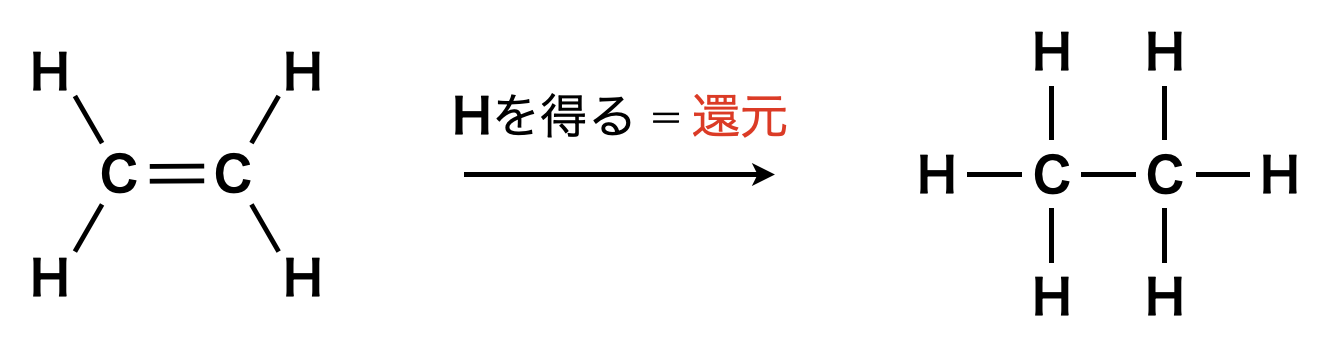
ポーリングの定義によると,炭素の電気陰性度は\(2.5\)で,水素(\(2.1\))より大きいので,炭素は水素から電子を奪うことになります.つまり,炭素は水素と化合すると還元されます.
酸化数
酸化数ってなんなの?
酸化還元反応では,思いもよらぬところで\(e^-\)が移動することが多いです.そのため反応式を見ただけでは,酸化剤や還元剤を見分けることはできません.そこで,すべての電子が結局はどの元素に所属しているのかをはっきりとさせておく必要があります.
ここで,共有結合については先程解説した電気陰性度を考えることで,電子の所属をはっきりとさせることができます.つまり,電気陰性度の大きい元素の方に共有電子対が引き付けられるので,そちら側の元素の方に所属すると考えていきましょう.
そこで,電子の所属をはっきりと示した数値を酸化数と呼びます.これは物質によって固有の値ではなく,状況によって変化するので,次に紹介する計算方法を理解しておきましょう!
酸化数の計算方法
酸化数の計算方法のポイントは下の\(4\)点です.これによって,ほぼすべての酸化数を計算することができるので,こちらについては少しずつ慣れていってくださいね!
- 単体:例外なく\(0\)
- 単原子イオン:イオンの価数
- 酸素:単体は\(0\),\(\rm{H_2O_2}\)の\(\rm{O}\)は\(-1\),それ以外は\(-2\)
- 水素:単体は\(0\),\(\rm{MH}\)(金属化合物)は\(-1\),それ以外は\(+1\)
上のポイントを参考にして下の例題を解いてみましょう!実践練習を積むことで,実力もアップしていきますよ!
次のそれぞれの物質の酸化数を求めよ.
(\(1\))\(\rm{Fe}\)の酸化数:\(\rm{Fe}\),\(\rm{FeSO_4}\),\(\rm{Fe_2(SO_4)_3}\)
(\(2\))\(\rm{Pb}\)の酸化数:\(\rm{Pb}\),\(\rm{PbSO_4}\),\(\rm{PbO_2}\)
(\(3\))\(\rm{Mn}\)の酸化数:\(\rm{MnSO_4}\),\(\rm{MnO_2}\),\(\rm{MnO_4^{2-}}\),\(\rm{MnO_4^-}\)
(\(4\))\(\rm{Cr}\)の酸化数:\(\rm{CrCl_2}\),\(\rm{Cr_2(SO_4)_3}\),\(\rm{CrO_4^{2-}}\),\(\rm{Cr_2O_7^{2-}}\)
(\(5\))\(\rm{Fe}\)の酸化数:\(\rm{[Fe(CN)_6]^{3-}}\),
\(\ \rm{Co}\)の酸化数:\(\rm{[CoCl(NH_3)_5]Cl_2}\)
(\(1\))
- \(\rm{Fe}\)は単体なので\(0\)
- \(\rm{SO_4:-2}\),\(\rm{FeSO_4}\)は全体でみると\(\rm{0\ ⇨\ Fe:+2}\)
- \(\rm{SO_4:-2}\),\(\rm{Fe_2(SO_4)_3:0\ ⇨\ Fe:+3}\)
\(\rm{Fe}\)が入試に出るときの価数は\(2\)価\(\rm{\ or\ 3}\)価です!
(\(2\))
- \(\rm{Pb}\)は単体なので\(0\)
- \(\rm{SO_4:-2}\),\(\rm{PbSO_4:0\ ⇨\ Pb:+2}\)
- \(\rm{O:-2}\),\(\rm{PbO_2:0\ ⇨\ Pb:+4}\)
\(\rm{Pb}\)の安定酸化数は\(+2\)です!
(\(3\))
- \(\rm{SO_4:-2}\),\(\rm{MnSO_4:0\ ⇨\ Mn:+2}\)
- \(\rm{O:-2}\),\(\rm{MnO_2:0\ ⇨\ Mn:+4}\)
- \(\rm{O:-2}\),\(\rm{MnO_4^{2-}:-2\ ⇨\ Mn:-2\ -\ (-2 × 4) = +6}\)
- \(\rm{O:-2}\),\(\rm{MnO_4^-:-1\ ⇨\ Mn:-2\ -\ (-2 × 4) = +7}\)
\(\rm{Mn}\)の安定酸化数は\(+2\)です!酸化数が\(+6\)の\(\rm{MnO_4^{2-}}\)をマンガン酸イオン,酸化数が\(1\)つ大きくなって\(+7\)になった\(\rm{MnO_4^-}\)を過マンガン酸イオンといいます.
(\(4\))
- \(\rm{Cl:-1}\),\(\rm{CrCl_2:0\ ⇨\ Cr:+2}\)
- \(\rm{SO_4:-2}\),\(\rm{Cr_2(SO_4)_3:0\ ⇨\ Cr:+3}\)
- \(\rm{O:-2}\),\(\rm{CrO_4^{2-}:-2\ ⇨\ Cr:-2\ -\ (-2 × 4) = +6}\)
- \(\rm{O:-2}\),\(\rm{Cr_2O_7^{2-}:-2\ ⇨\ Cr:\{-2\ -\ (-2 × 7)\}÷2 = +6}\)
\(\rm{Cr}\)の安定酸化数は\(+3\)です!
\(\rm{CrO_4^{2-}}\)はクロム酸イオンといい黄色,\(\rm{Cr_2O_7^{2-}}\)は\(2\)クロム酸イオンといい橙色に呈色します.\(\rm{CrO_4^{2-}}\)は\(\rm{SO_4^{2-}}\)の\(\rm{S}\)が\(\rm{Cr}\)に置き換わったものと理解しておきましょう!
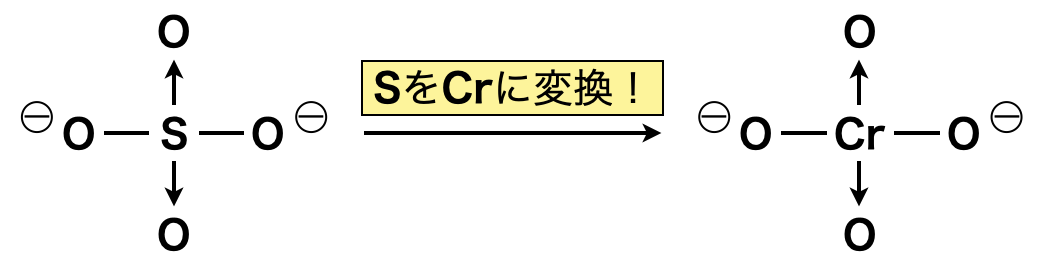
\(\rm{CrO_4^{2-} → Cr_2O_7^{2-}}\)の変化を確認しておきましょう.
\(\rm{CrO_4^{2-}}\)は酸性条件で縮合して\(\rm{Cr_2O_7^{2-}}\)に変化します.逆に,\(\rm{Cr_2O_7^{2-}}\)は塩基性条件で解離して,\(\rm{CrO_4^{2-}}\)に戻ります.この場合\(\rm{Cr}\)の酸化数が変化しないので,これは酸化還元反応ではありません!

(\(5\))
- \(\rm{CN:-1}\),\(\rm{[Fe(CN)_6]^{3-}}:-3\ ⇨\ Fe:-3 – (-6) = +3\)
- \(\rm{Cl:-1}\),\(\rm{NH_3:0}\),\(\rm{[CoCl(NH_3)_5]Cl_2:0\ ⇨\ Co:0 – (-2-1) = +3}\)
今回は以上となります.酸化還元の本当に基礎となる部分について解説してきました!基礎は簡単ではなく,どの分野にも共通する土台なので,軽視することはなく丁寧に学んだいきましょう!



コメント