前回までで強酸や1価の弱酸の[H+]計算について学んできました!
今日は最後の2価の弱酸について詳しく説明していきます!
このシリーズも今日で最後なので,しっかりと頑張っていきましょう!!
強酸や1価の弱酸についてまだ読んでいない方は,是非こちらもご一読ください!
[H+]計算を完全マスター!①
[H+]計算を完全マスター!②
弱酸(2価)
弱酸(2価)・(近似解)
2価の弱酸というのは,2回電離するということです.
詳しいことは下の問題で見ていきますが,2価になると化学平衡が2回起きるようになります.
ということは,平衡定数も2個出てくるというわけです!
このような問題は,難関大などで頻出ですが,しっかりと解説していきますので,大丈夫ですよ!!
それでは,2価の弱酸の近似解の場合について考えていきます.
まずは,\(\rm{H_2S}\)の2段階電離を考えてみましょう!
H2S ⇄ HS– + H+
HS– ⇄ S2- + H+
2段階電離のときは,各電離の起こりやすさを比較してみることが大切です!
\(K_{\rm{a1}} = 1.0 × 10^{-7}\ \rm{mol/L}\)で\(K_{\rm{a2}} = 1.0 × 10^{-13}\ \rm{mol/L}\)ということは,
第1電離の方が\(1.0 × 10^6\)倍起こりやすいということです!
つまり,第2電離は考えなくていいということです!
ここが非常に大切で,ほとんどの場合,第2電離は無視することができます!
第2電離を無視すると,次のようになります!
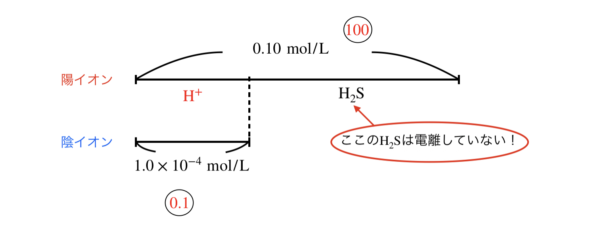
\([\rm{H}^+]\)を近似解で求めると,
\([\rm{H}^+] = \sqrt{0.1 × 1.0 × 10^{-7}} = 1.0 × 10^{-4}\ \rm{mol/L}\)
となります!
いつものように,最後の確認までしてくださいね!
全体:\([\rm{H}^+] = 0.1:1.0 × 10^{-4} = 100:0.1\)
これより,近似解を使うのはOKですね!!
弱酸(2価)・(厳密解)
いよいよ,最後のパターンになりました!
次は2段階電離する弱酸で近似解が使えないバージョンです!
少し難しいですが,あともう少しです!
頑張りましょう!!
炭酸の2段階電離は次のようになります!
CO2 + H2O ⇄ HCO3– + H+
HCO3– ⇄ CO32- + H+
ここで,注意点があります.
H2CO3とは書かずに,CO2+H2Oと書きます!
さて,再び各電離の起こりやすさを比較してみましょう!
\(K_{\rm{a1}} = 5.0 × 10^{-7}\ \rm{mol/L}\)で\(K_{\rm{a2}} = 5.0 × 10^{-11}\ \rm{mol/L}\)ということは,
第1電離の方が\(1.0 × 10^4\)倍起こりやすいということです!
つまり,第2電離は考えなくていいということです!
そうすると,図は次のようになります!
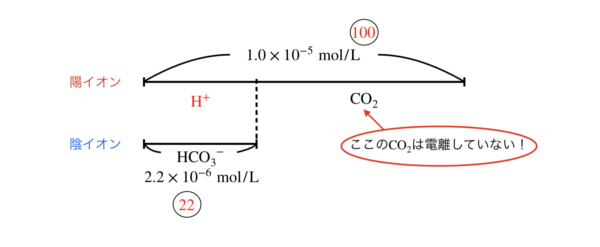
\([\rm{H}^+]\)を近似解で求めると,
\([\rm{H}^+] = \sqrt{1.0 × 10^{-5} × 5.0 × 10^{-7}}=2.2 × 10^{-6}\ \rm{mol/L}\)
となります!
ここで終わってはいけませんよ!
全体:\([\rm{H}^+]\)の比を考えてみましょう!
全体:\([\rm{H}^+] = 1.0 × 10^{-5}:2.2 × 10^{-6} = 100:22\)
これは\(100:5\)以上となるので,近似解を使ってはいけません!!!
ここが先ほどの問題と違うところです!
近似解を用いない方法は以前学習しましたね!?
図にすると下のようになります.
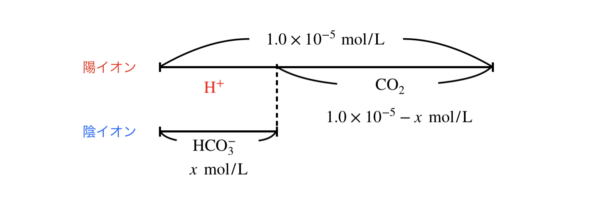
ただし,\(K_{\rm{a1}} >> K_{\rm{a2}}\)となるので,第1電離の方のみ考えればいいのは変わりませんよ!
\([\rm{H}^+] = [\rm{HCO3}^-] = \)\(x\ \rm{mol/L}\),\([\rm{CO_2}] = \)\(1.0 × 10^{-5} – x\ \rm{mol/L}\)を\(K_{\rm{a1}}\)の式に代入すると,
\(K_{\rm{a1}} = \large \frac{x \cdot x}{1.0 × 10^{-5} -x} \normalsize = 5.0 × 10^{-7}\)
\(x^2 + 5.0 × 10^{-7} x – 5.0 × 10^{-12} = 0 \)
これは因数分解できます!
\((x – 2.0 × 10^{-6})(x + 2.5 × 10^{-6}) = 0\)
\(x = [\rm{H}^+] = 2.0 × 10^{-6}\ \rm{mol/L}\)
となります!
今回で酸の電離については,全てのパターンを学習しました!
あとは,何度も復習して確実に解けるようにしてくださいね!!
今回はお疲れ様でした!



コメント