このような疑問をしっかりと解決していきます!
本記事では,まずは塩の加水分解についてしっかりと説明し,その後問題解説をしていきます!
本記事を最後まで読むと,塩の加水分解について必ず理解できるようになります!
それでは今日も最後まで一緒に頑張りましょう!!
塩の加水分解
まずは,塩の加水分解について説明していきましょう!
ある物質中に酸由来のHや塩基由来のOHがないのに,水溶液中で水と反応し,もとの酸や塩基に戻ろうとすることを塩の加水分解といいます.
っとこれでは,よくわかりませんよね…
言葉が難しすぎます…
かみくだいて解説していきますね!
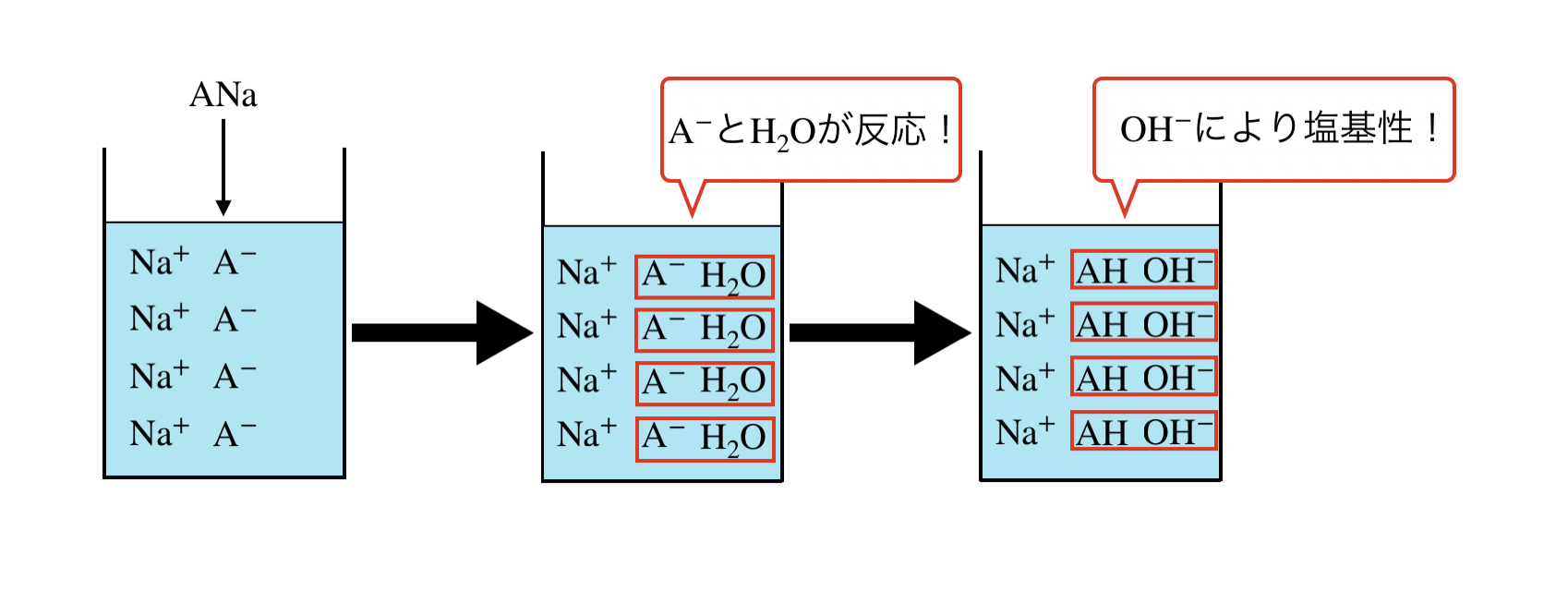
ANa(CH3COONaというイメージです:A– = CH3COO–)という物質を例にとって考えてみましょう.
ANa → A– + Na+
この反応は完全に進行します.
次に,A–が水溶液中のH2Oと反応し,次の平衡状態になります.
A– + H2O ⇄ HA + OH–
これを見るとわかりますが,OH–が生じるので,溶液は塩基性になります.
溶液内のイメージを図にすると,下のようになります.
化学平衡の法則を適用すると,平衡定数は次のようになります.
\(K_{\rm{h}} = \large \frac{[\rm{HA}][\rm{OH}^-]}{[\rm{A}^-]}\)
この平衡定数を加水分解定数といい,Khと表します.
このhは加水分解(salt hydrolysis)を表しています.
そうすると,\([\rm{OH}^-] = \sqrt{C K_{\rm{h}}} \)
となります.
ここで,問題があります!
一般的に問題中に\(K_{\rm{h}}\)の値が示されていないということです…!
与えられている値は下の平衡状態の\(K_{\rm{a}}\)になります.
HA ⇄ A– + H+
これより,
\(K_{\rm{a}} = \large \frac{[\rm{A}^-][\rm{H}^+]}{[\rm{HA}]}\)
です.
この\(K_{\rm{a}}\)を用いると,\(K_{\rm{h}}\)は次のように分解できます.
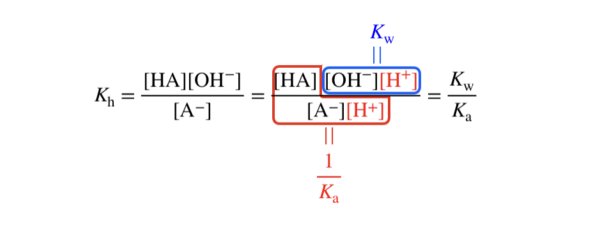
つまり,\(K_{\rm{a}} K_{\rm{h}} = K_{\rm{w}}\)の関係から\(K_{\rm{h}}\)を求めることができます!
これを必ず覚えておきましょう!!
この式を使うことで,\([\rm{OH}^-]\)を求めることができますね!
塩の加水分解の計算
塩の加水分解の計算には,主に\(\rm{CH_3COONa}\)と\(\rm{NH_4Cl}\)という2つの物質が特に出てきます.
実際の例で計算できるようにしていきましょう!
CH3COONa
まず,\(\rm{CH_3COONa}\)の反応について考えましょう!
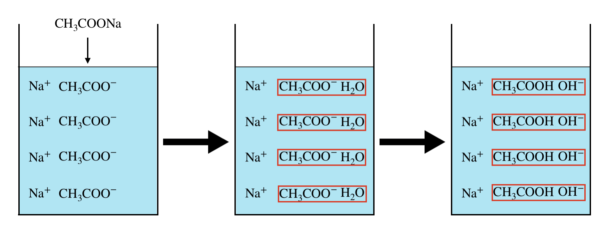
\(\rm{CH_3COONa}\)を水に溶かすと,まず以下の反応が起こり,この反応は完全に進行します.
CH3COONa → CH3COO– + Na+
次に,\(\rm{CH_3COO^-}\)が\(\rm{H_2O}\)と反応し,平衡状態になります.
CH3COO– + H2O ⇄ CH3COOH + OH–
これらの反応をイメージすると,下のようになります.
次に,先ほどの要領で\(K_{\rm{h}}\)を求めていきましょう!
\(K_{\rm{h}} = \large \frac{K_{\rm{w}}}{K_{\rm{a}}} \small = \large \frac{1.0 × 10^{-14}}{2.0 × 10^{-5}} \small = 0.5 × 10^{-9}\ \rm{mol/L} \)
これから,\([\rm{OH}^-] = \sqrt{0.10 × 0.5 × 10^{-9}} = \large \frac{1}{\sqrt{2}} \small × 10^{-5}\ \rm{mol/L}\)
最後に全体:\([\rm{OH}^-]\)について確認しておきましょう!
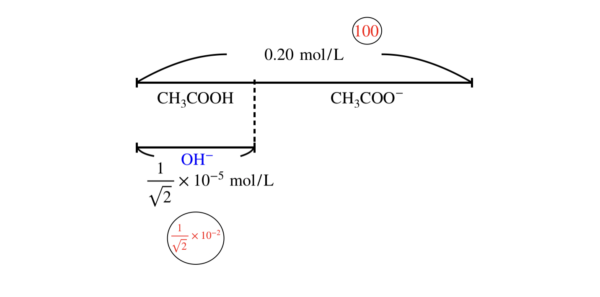
全体:\([\rm{OH}^-] = 0.1:\large \frac{1}{\sqrt{2}} \small × 10^{-5} = 100:\large \frac{1}{\sqrt{2}} \small × 10^{-2}\)
となりますので,全く問題ないですね!
\([\rm{H}^+] = \large \frac{K_{\rm{w}}}{[\rm{OH}^-]} = \frac{1.0 × 10^{-14}}{\frac{1}{\sqrt{2}} × 10^{-5}} \small = 1.4 × 10^{-9}\ \rm{mol/L}\)
このよう問題のように塩の加水分解の問題では,全体に対して\([\rm{H}^+] \cdot [\rm{OH}^-]\)は微小なので,例外として確認しなくてOKですよ!
NH4Cl
次は,NH4Clについて見ていきましょう!
\(\rm{NH_4Cl}\)も完全に反応が進行します.
NH4Cl → NH4+ + Cl–
次に,\(\rm{NH_4^+}\)が水溶液中の\(\rm{H_2O}\)と反応し,次の平衡状態になります.
NH4+ + H2O ⇄ NH3 + H3O+
これを見るとわかりますが,\(\rm{H_3O}^+\)(以下\(\rm{H}^+\))が生じるので,溶液は酸性になります.
溶液内のイメージを図にすると,下のようになります.
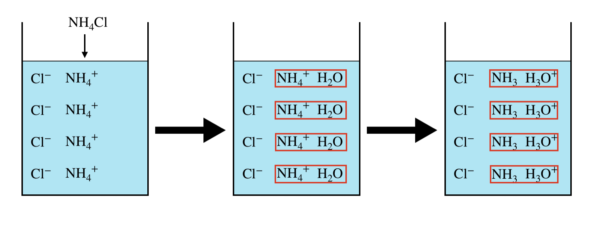
また,化学平衡の法則を適用すると,平衡定数は次のようになります.
\( K_{\rm{h}} = \large \frac{[\rm{NH_3}][\rm{H}^+]}{[\rm{NH_4}^+]} \)
次に,\(K_{\rm{h}}\)を求めていきます!
問題で与えられているKbは以下の式の平衡定数です.
NH3 + H2O ⇄ NH4+ + OH–
\(K_{\rm{b}} = \large \frac{[\rm{NH_4}^+][\rm{OH}^-]}{[\rm{NH_3}]}\)
この\(K_{\rm{b}}\)を用いると,酸性のときと同じようにして\(K_{\rm{h}}\)を求めることができます.
\(K_{\rm{h}} = \large \frac{K_{\rm{w}}}{K_{\rm{b}}} \small = \large \frac{1.0 × 10^{-14}}{2.0 × 10^{-5}} \small = 0.5 × 10^{-9}\ \rm{mol/L}\)
\(K_{\rm{h}}\)を使うことで,\([\rm{H}^+]\)を求めることができます!
\([\rm{H}^+] = \sqrt{C K_{\rm{h}}} = \sqrt{0.20 × 0.5 × 10^{-9}} = 1.0 × 10^{-5}\ \rm{mol/L}\)
先程みたように,塩の加水分解では全体:\([\rm{H}^+]\)は確認しなくて良いので,今回も考えていません.
その分だけ時間を節約していきましょう!
本日は以上になります!
塩の加水分解は苦手な人が多いですが,この記事の内容を覚えておけば,確実に周りの人と差をつけることができます!
次回も頑張っていきましょう!



コメント