
〇〇熱や〇〇エネルギーといった基礎の理解が非常に大切になります!
それでは,今日も頑張っていきましょう!!
熱化学の原理
化学の反応では,物質が結合したり脱離したりというのを繰り返しています.
そして物質それぞれによって「相性」というものがあり,結合した方がエネルギーが低かったり,脱離した方がエネルギーが低くなるというものがあります.
このエネルギーというものを化学の世界では,位置エネルギーとして考えます.
下の図より,原子自体に変化は起きていませんが,原子の組み替えが起こったときに,その位置エネルギーは変化します.
つまり,物質同士の相性は変化するということですね!
これは人間界でも同じですね!
相性が合う人もいれば,合わない人もいると思います.
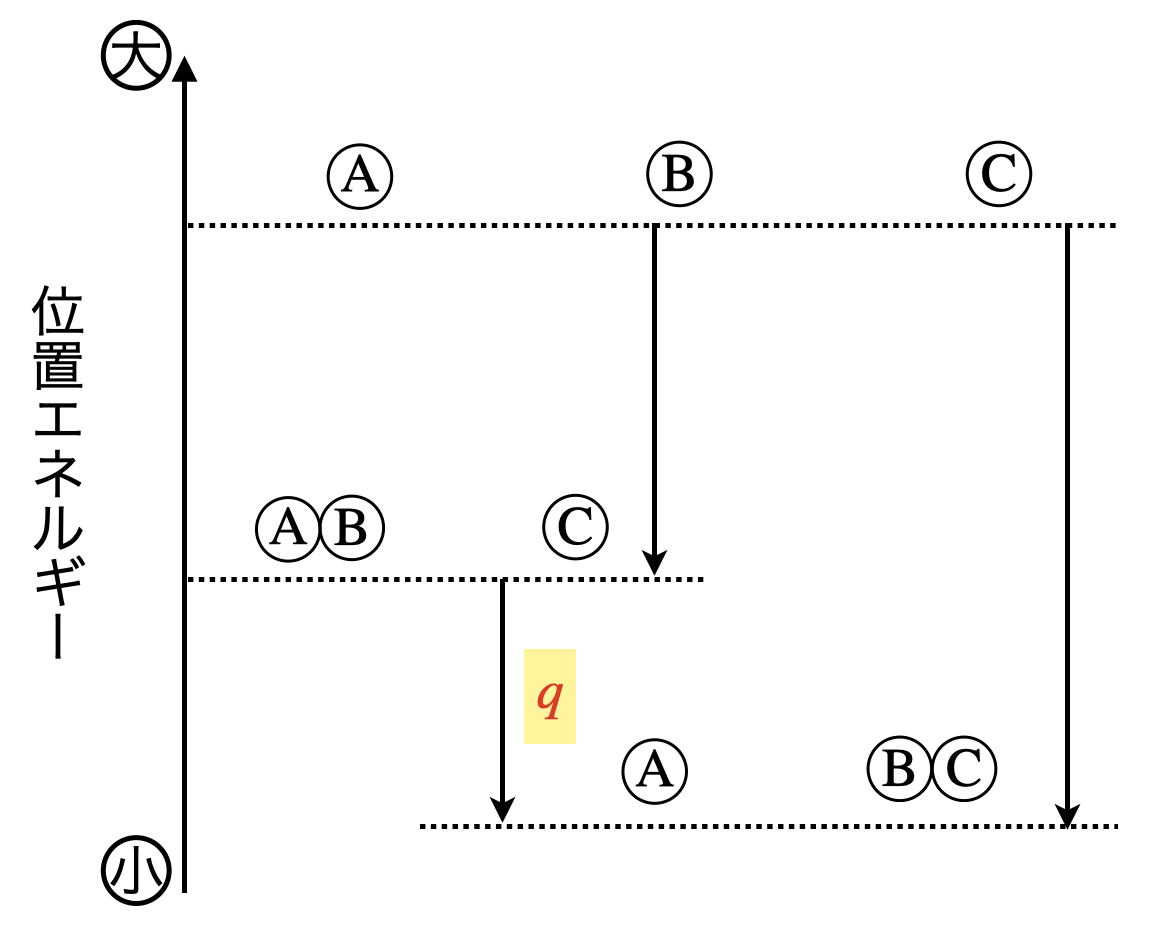
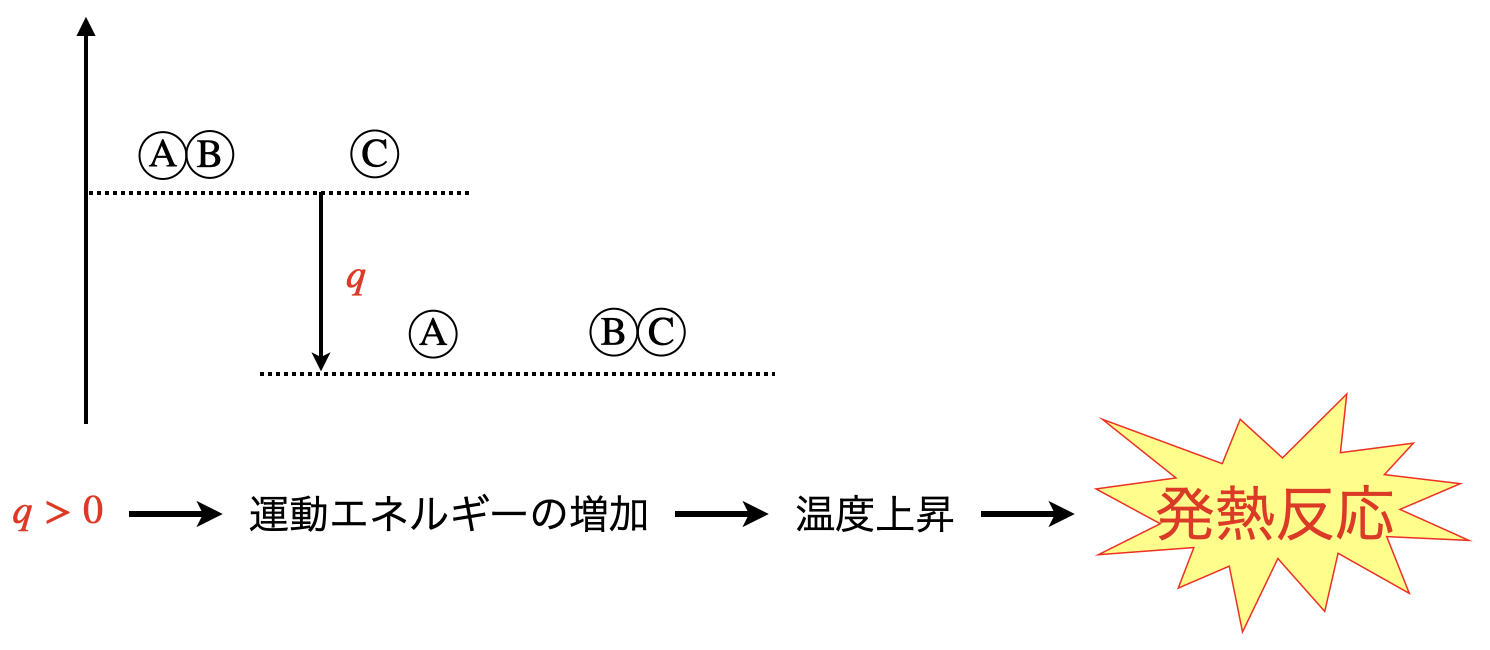
そして,このエネルギーの差分である\(q\)は,それぞれの物質の運動エネルギーの増加に変化にします.
さらに運動エネルギーが増加することで,粒子同士の衝突が多くなり,温度上昇が引き起こされます.
そして最終的には,全体的に熱が発生したと考えられます.
これを私たちは,「発熱反応」と読んでいます.
下の図で,もう一度整理してくださいね!
一方で,発生する熱が\(q\ <\ 0\)のときは,粒子の運動エネルギーが位置エネルギーの上昇に使用され,温度が減少します.そのため,これを「吸熱反応」と呼びます.
熱化学方程式
熱化学の勉強を進めていくにあたり,熱化学方程式というものが登場します.
そのため,熱化学方程式のきまりについて詳しくみていきましょう!
熱化学方程式の意味
熱化学方程式では,反応前後の熱量について表しています.
化学反応式では,反応前後を「\(→\)」で表しますが,熱化学方程式では「\(=\)」で表します.
名前も熱化学「反応式」ではなく,熱化学「方程式」であるため,「\(=\)」を使うのも理解しやすいですね!
反応式の係数
熱化学方程式に表される反応熱は,着目する物質\(1\ \rm{mol}\)あたりの値で表されています.
そのため他の物質については小数・分数もOKです!
ここが,化学反応式と違うところなので,しっかり覚えてくださいね!
物質の状態
反応熱は,物質の状態によって変化します.
そのため熱化学方程式では,物質の状態を記すことが非常に大切です.
固体:\(\rm{solid\ →\ s}\),液体:\(\rm{liquid\ →\ l}\),気体:\(\rm{gas\ →\ g}\)と表記します!
特に指定がない場合は,\(1.013\ ×\ 10^5\ \rm{Pa},25^\circ \rm{C}\)(これを熱化学の標準状態といいます!)での反応熱となっています.
以上の\(3\)つのきまりを使うと,下のような熱化学方程式ができます!
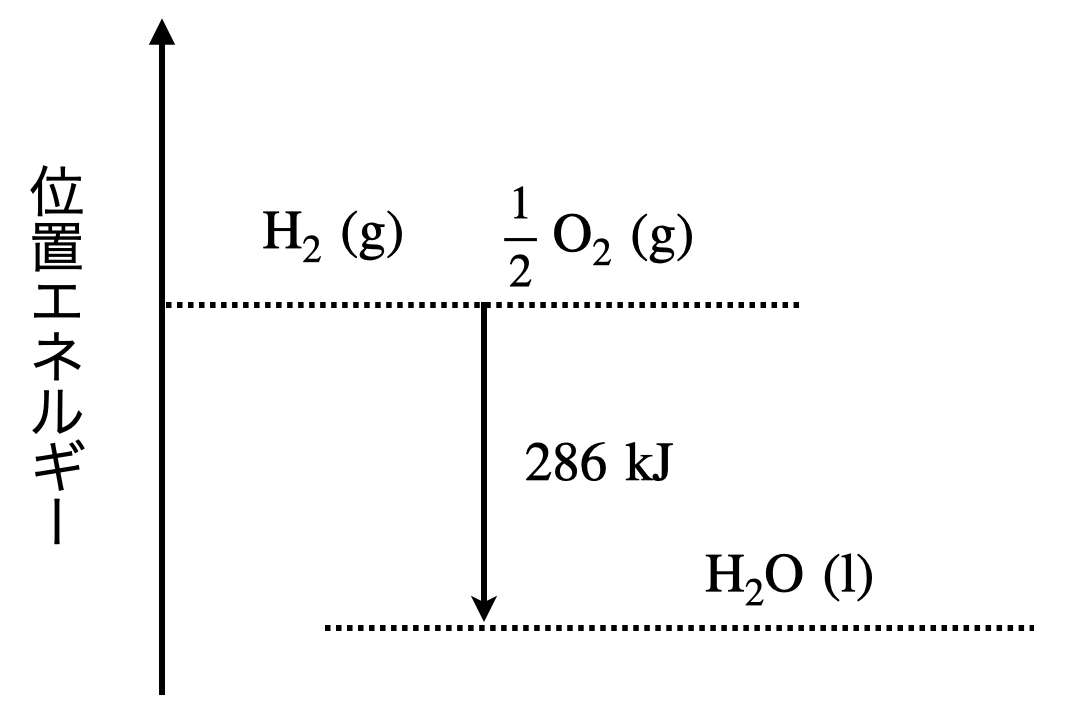
\(\rm{H_2(g)\ +\ \large \frac{1}{2} \small O_2(g)\ =\ H_2O(l)\ +\ 286\ kJ}\)
これをエネルギー図で表すと,以下のようになります.
エネルギー図については,しっかりと使いこなせることが重要なので,この後しっかりと説明していきますね!
下の問題で,熱化学方程式の書き方を練習してみましょう.
エタノール(\(\rm{C_2H_5OH}\))を燃焼させると,二酸化炭素と水が発生し,そのときの発熱量は\(1370\ \rm{kJ}\)となります.このときの熱化学反応式を書いてみてください!
まず,化学反応式を考えてみてください!
\(\rm{C_2H_5OH\ +\ 3O_2\ →\ 2CO_2\ +\ 3H_2O}\)
この化学反応式にそれぞれの物質の状態を書き入れ,「→」を「=」に直し,発生する熱を書き込むと完成になります!
\(\rm{C_2H_5OH(l)\ +\ 3O_2(g)\ =\ 2CO_2(g)\ +\ 3H_2O(l)}\ +\ 1370\ kJ\)
○○熱
それでは,試験に出てくる具体的な○○熱について,\(1\)つずつみていきましょう!
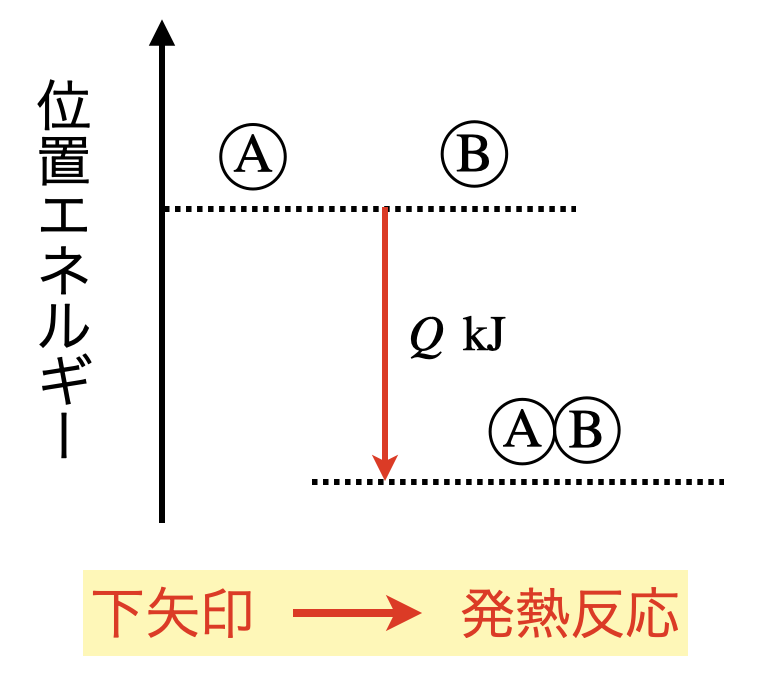
まずは一般的に,\(\rm{A\ +\ B\ =\ AB\ +\ }\)\(Q\ \rm{kJ}\)という熱化学方程式について考えていきましょう.
例外もあるのですが,基本的には,○○熱の場合は,発熱反応となります.
そのときのエネルギー図は下のようになり,矢印は下向きになります!
ここが非常に大切なところです.
上で例外があるといったのは,昇華熱・融解熱・蒸発熱といった状態変化を表す熱についてです.
これらの場合は吸熱反応になるのですが,これについてはまた後でお伝えしますね!
熱化学方程式では,どの物質を基準の1molと考えるかが非常に大切なので,その点を意識しながら読み進めていってください.
反応前の状態を「\(\rm{start}\)」,反応後の状態を「\(\rm{finish}\)」として表していきます.
①生成熱
\(\rm{start}\):単体,\(\rm{finish}\):化合物\(\ 1\ \rm{mol}\)
例:\(\rm{CO_2}\)の生成熱
\(\rm{C(s)\ +\ O_2(g)\ =\ CO_2(g)\ +\ 394\ kJ}\)
②燃焼熱
\(\rm{start}\):物質\(\ 1\ \rm{mol}\),\(\rm{finish}\):完全燃焼
例:\(\rm{C_2H_6(g)}\)の燃焼熱
\(\rm{C_2H_6(g)\ +\ O_2(g)\ =\ CO_2(g)\ +\ H_2O(l)\ +\ 1560\ kJ}\)
③中和熱
\(\rm{start}\):酸・塩基の溶液,\(\rm{finish}\):\(\rm{H_2O(l)\ 1\ mol}\)
例:\(\rm{HCl}\)と\(\rm{NaOH}\)の中和反応
\(\rm{HCl_{aq}\ +\ NaOH_{aq}\ =\ NaCl_{aq}\ +\ H_2O(l)\ +\ 56.5\ kJ}\)
ここで,ちょっとした豆知識ですが,一般的にどのような物質に対しても中和反応で生じる中和熱は,\(56\ \rm{kJ}\)ほどとなります!
④溶解熱
\(\rm{NaOH(s)}\)などの物質をそのまま水に溶かしたときに生じる熱が溶解熱です.
\(\rm{start}\):物質\(\ 1\ \rm{mol}\),\(\rm{finish}\):溶媒和状態
例:\(\rm{NaOH}\)の溶解
\(\rm{NaOH(s)\ +\ aq\ =\ NaOH_{aq}\ +\ 44.5\ kJ}\)
\(\rm{aq}\)は水を表しています.また溶解熱は正負いずれもありますので,注意してください.
⑤水和熱
\(\rm{Na^+}\)などのイオンが水に溶けて水和されたときに生じる熱が水和熱です.
\(\rm{start}\):イオン(\(g\)),\(\rm{finish}\):水和状態
例:\(\rm{Na^+}\)の水和
\(\rm{Na^+(g)\ +\ aq\ =\ Na^+_{\rm{aq}}\ +\ 404\ kJ}\)
物質の状態を表す熱に関しては,\(1\)つにまとめて覚えてしまいましょう!
物質の状態を表す熱については,「融解熱」「凝固熱」「蒸発熱」「凝縮熱」「昇華熱」の\(5\)つがあります.
これらは,固体・液体・気体が変化するときの熱ですが,以下のようになっています.
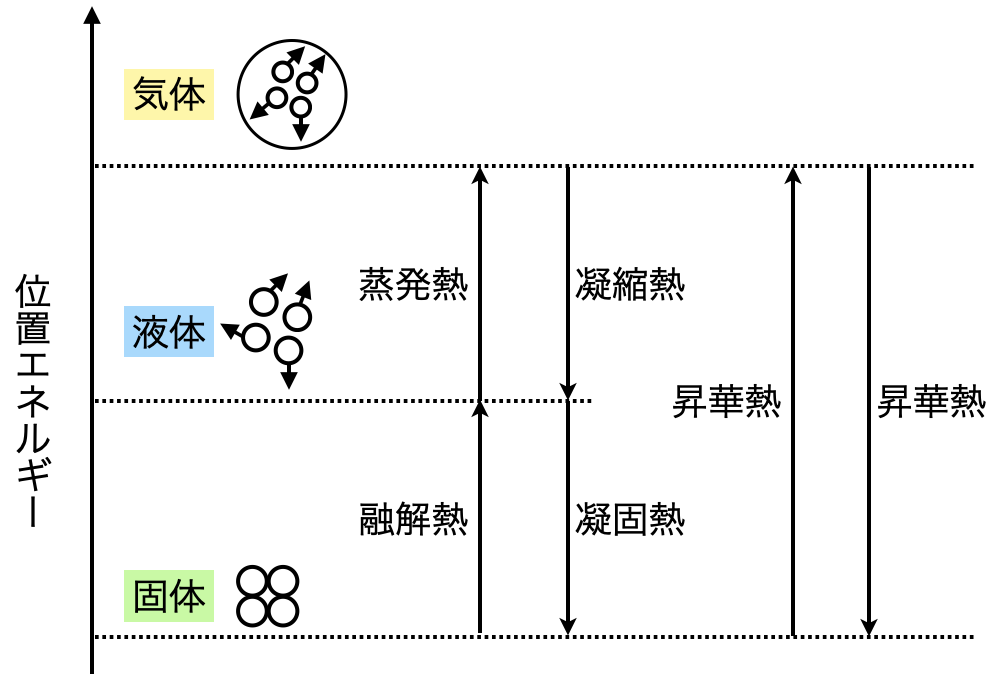
それぞれの熱が上向きか,下向きかをこの図を使うことでしっかりと覚えてくださいね!
○○エネルギー
それでは次は,○○エネルギーについて,説明していきましょう!
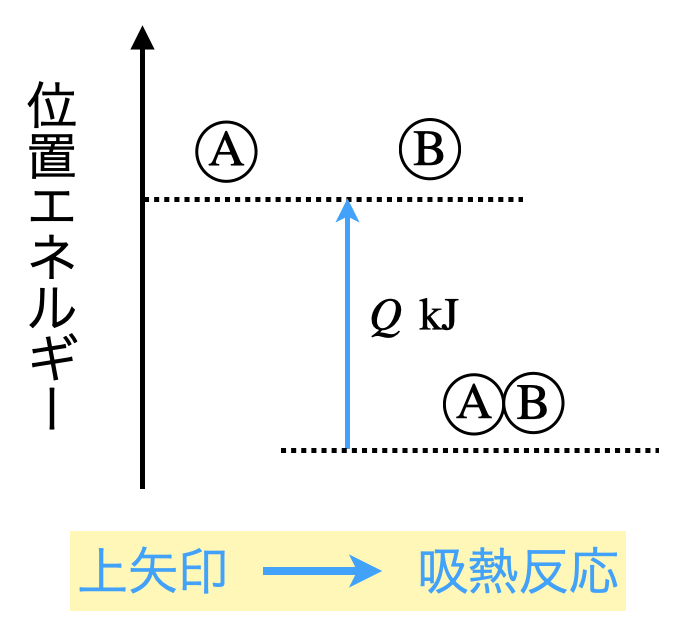
まずは一般的に,\(\rm{A\ +\ B\ =\ AB\ -\ }\)\(Q\ \rm{kJ}\)という熱化学方程式について考えていきましょう.
基本的には,○○エネルギーの場合は,吸熱反応となります.
そのときのエネルギー図は下のようになり,矢印は上向きになります!
ここが非常に大切なところです.
①結合エネルギー
\(\rm{start}\):共有結合\(\ 1\ \rm{mol}\),\(\rm{finish}\):原子(\(\rm{g}\))
例:\(\rm{H_2}\)の結合エネルギー
\(\rm{H_2(g)\ =\ 2H(g)\ -\ 436\ kJ}\)
②格子エネルギー
\(\rm{start}\):結晶\(\ 1\ \rm{mol}\),\(\rm{finish}\):粒子(\(\rm{g}\))
例:\(\rm{NaCl}\)の格子エネルギー
\(\rm{NaCl(s)\ =\ Na^+\ +\ Cl^-\ -\ 778\ kJ}\)
③イオン化エネルギー
\(\rm{start}\):原子(\(\rm{g}\))\(\ 1\ \rm{mol}\),\(\rm{finish}\):陽イオン(\(\rm{g}\)) \(\ +\ e^-\)
例:\(\rm{Na}\)のイオン化エネルギー
\(\rm{Na(g)\ =\ Na^+(g)\ +\ e^-\ -\ 494\ kJ}\)
○○熱・○○エネルギーのまとめ
このままでは覚えにくいと思いますので,最後にいつものようにまとめていきましょう!
具体的には,下のような図を覚えてください!!

次に,この図のポイントを解説していきます.
まずは,縦の指標を順番に覚えてください!
「陽イオン(\(\rm{g}\)) → 原子(\(\rm{g}\)) → 単体(\(\ 1.013\ ×\ 10^5\ \rm{Pa}\cdot 25^\circ \rm{C}\) → 化合物 → 完全燃焼 → 水和」
必ず頭に入れてくださいね!
次に,それぞれの熱がどこからどこへの線であるか,つまり,「\(\rm{start}\)」と「\(\rm{finish}\)」をしっかりとおさえてください!
これを覚えることで,どんな熱化学の問題も解けるようになるので,頑張って覚えていきましょう!



コメント