
鉛蓄電池
まず電池の種類について簡単に説明しておきましょう.電池には一次電池と二次電池があります.
一次電池は,放電し続けると電圧が下がり,使用できなくなります.そのため,放電時とは逆向きの電流を強制的に流しても起電力は回復しません.ボルタ電池やダニエル電池などの例があります.

一方で二次電池は,充電により起電力が回復し繰り返し使用できる電池のことです.今日は,この二次電池について解説していきます!
鉛蓄電池の仕組み
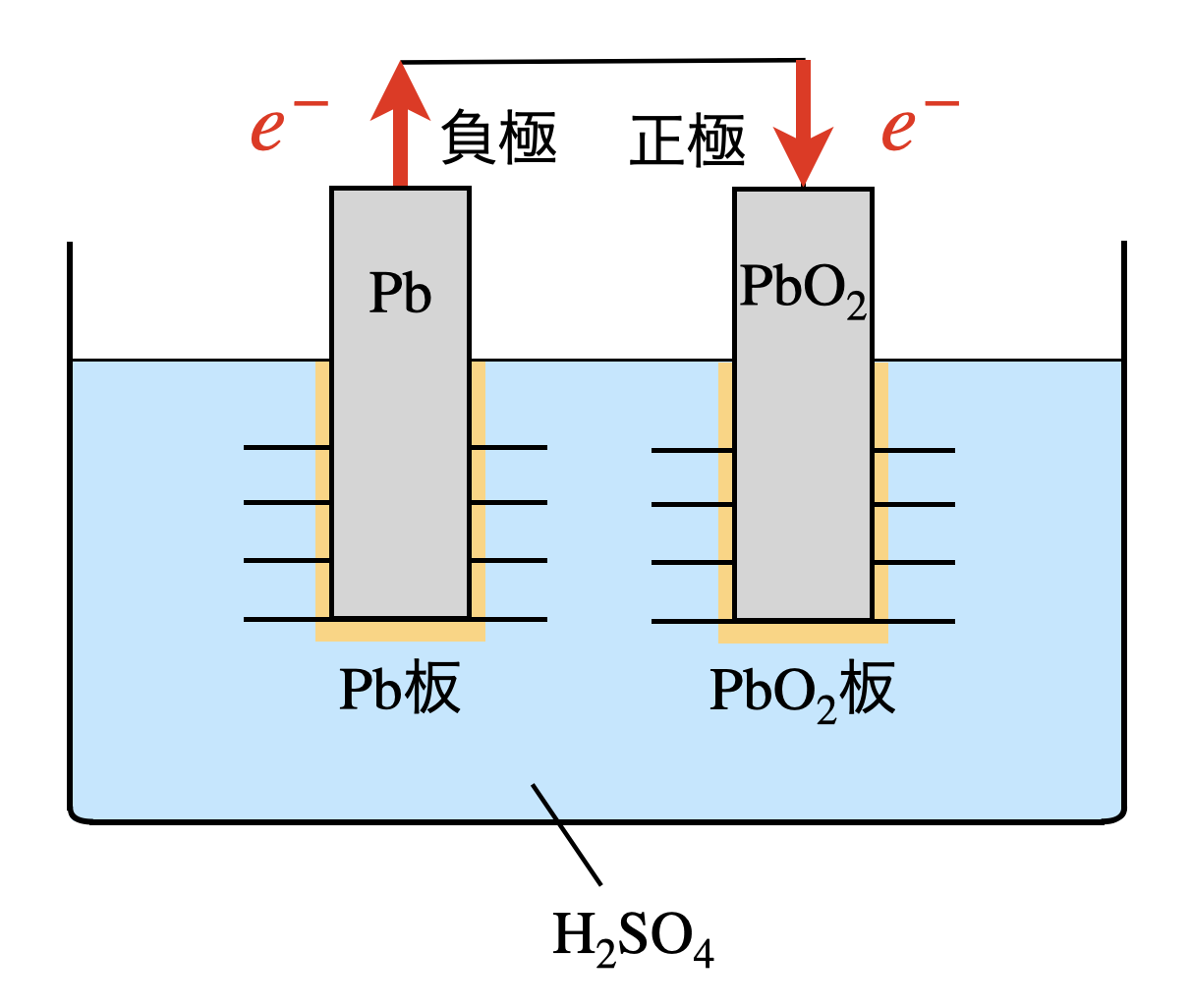
鉛蓄電池は,現在でも広く使われています.鉛蓄電池とは,\(\rm{Pb}\)(鉛)と\(\rm{PbO_2}\)(酸化鉛(\(\rm{I\hspace{-.08em}V\hspace{-.06em}}\)))を,電解質溶液として希硫酸中に離してつないだものです.\(\rm{Pb}\)の酸化数について考えてみましょう!
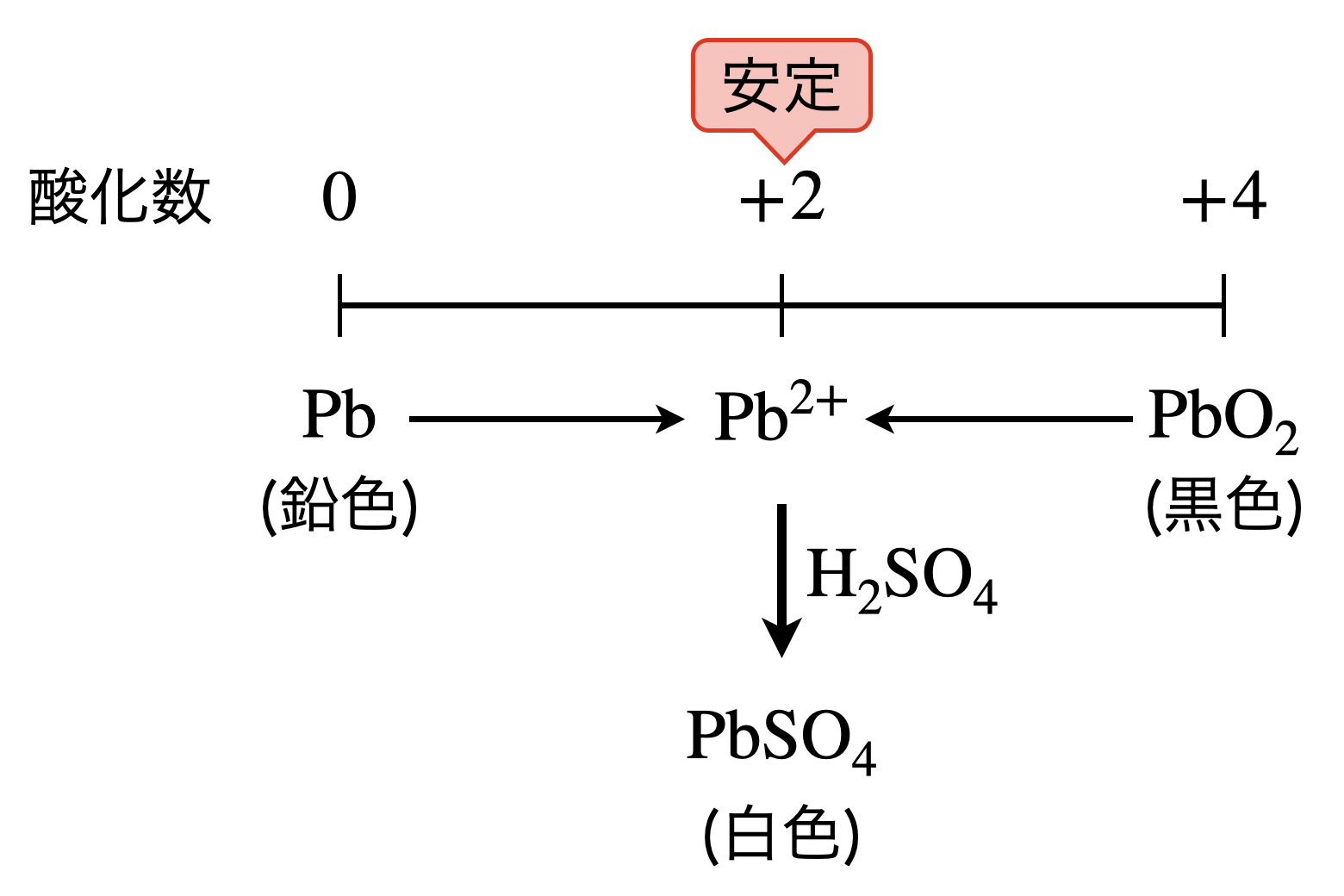
\(\rm{Pb}\)の安定的な酸化数は\(+2\)です.そのため\(e^-\)が\(\rm{Pb\ →\ PbO_2}\)に移動し,\(\rm{Pb}\)の酸化数が安定酸化数の\(+2\)へと変化します.よって,\(\rm{Pb\ →\ PbO_2}\)へ電子が移動するので,\(\rm{Pb}\)が負極,\(\rm{PbO_2}\)が正極になります.
それでは,それぞれの電極の反応をみていきましょう!
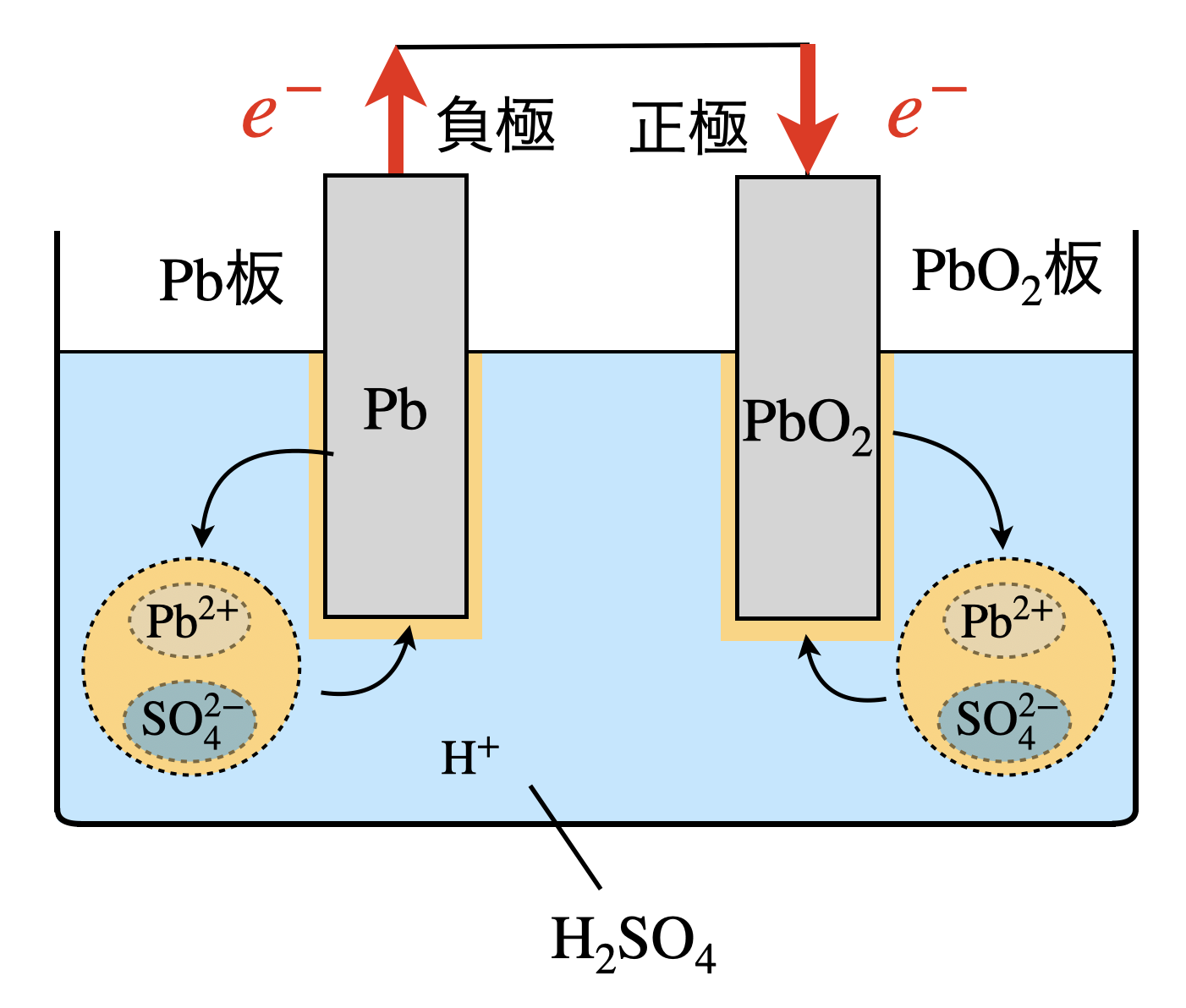
まずは負極での反応です.
\(\rm{Pb}\)が電子を放出し,\(\rm{Pb^{2+}}\)イオンとなります.しかしながら\(\rm{Pb^{2+}}\)は希硫酸中の\(\rm{SO_4^{2-}}\)と反応することで,\(\rm{PbSO_4}\)(硫酸鉛)となって沈澱します.下の図を見ると,\(\rm{Pb^{2+}}\)の濃度が低く保たれるため,ル・シャトリエの原理より平衡は右に傾きます.このため,鉛蓄電池は安定的に放電反応が続きます.
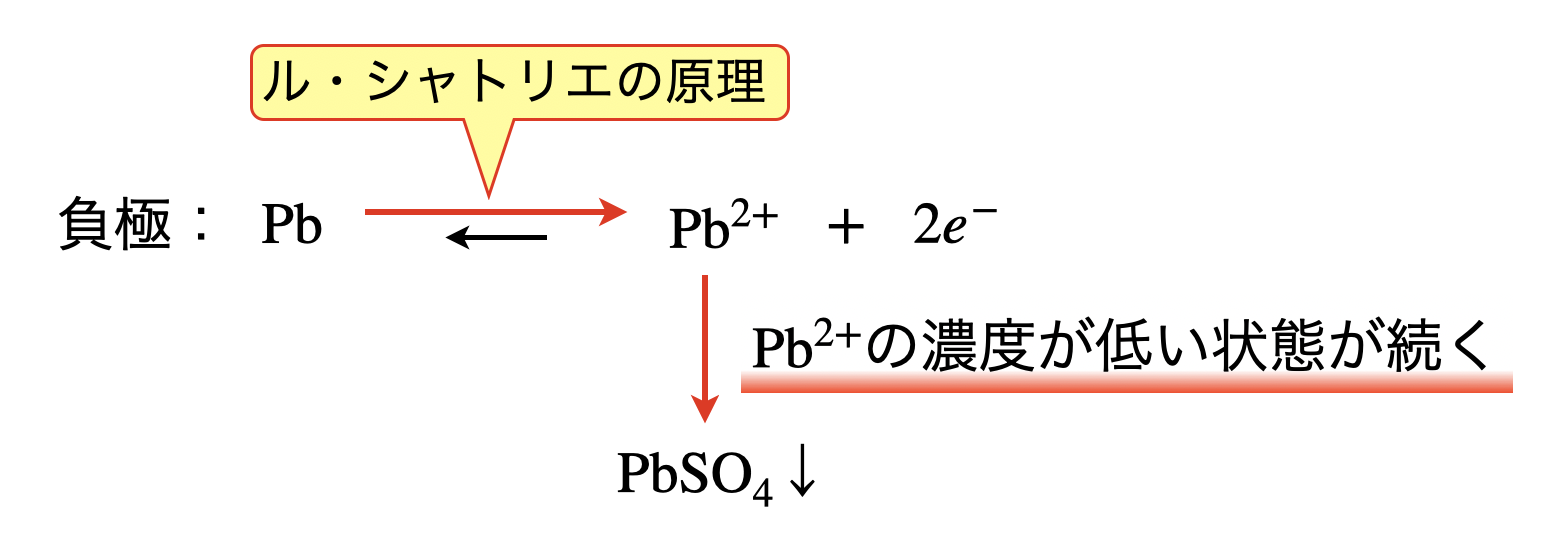
上の反応を一つにまとめると,下のようになります.
負極:\(\rm{Pb\ +\ SO_4^{2-}\ →\ PbSO_4\ +\ }\)\(2e^-\)
次は,正極での反応です.
\(\rm{PbO_2}\)が電子を得て,\(\rm{Pb^{2+}}\)となります.ここで発生した\(\rm{Pb^{2+}}\)は負極と同様に希硫酸中の\(\rm{SO_4^{2-}}\)と反応することで,\(\rm{PbSO_4}\)(硫酸鉛)となって沈澱します.また\(\rm{PbO_2}\)の\(\rm{O}\)原子は酸化還元により,\(\rm{H_2O}\)になりやすいです.まとめると,下のような反応になります.
正極:\(\rm{PbO_2\ +\ 4H^+\ +\ }\)\(2e^-\ \rm{+\ SO_4^{2-}\ →\ PbSO_4\ +\ 2H_2O}\)
鉛蓄電池の充電
鉛蓄電池の反応を振り返ってみましょう!
負極:\(\rm{Pb\ +\ SO_4^{2-}\ →\ PbSO_4\ +\ }\)\(2e^-\)
正極:\(\rm{PbO_2\ +\ 4H^+\ +\ }\)\(2e^-\ \rm{+\ SO_4^{2-}\ →\ PbSO_4\ +\ 2H_2O}\)
鉛蓄電池を放電すると,\(\rm{PbSO_4}\)が生成されると同時に,硫酸が消費され水が生成するので,電解液の\(\rm{Pb^{2+}}\)が減少していきます.
これを防ぐために,充電を行います.
そして充電して再利用するためには,放電後の生成物が電極に付着して,充電時に元の状態に戻れることが大切になります.つまり,二次電池では,生成物が電極に付着している電池のことをいいます.
(鉛蓄電池の場合は,\(\rm{PbSO_4}\)が生成されるため,電極にひだがつけられています.)
鉛蓄電池の放電,充電の反応式を確認しておきましょう!反応式を考えるには,上の負極と正極の半反応式から\(e^-\)を削除すればOKです!
\(\rm{Pb\ +\ PbO_2\ +\ 2H_2SO_4\ ⇄\ 2PbSO_4\ +\ 2H_2O}\)
(\(→\)放電,\(←\)充電)
試験でのポイント
先程の鉛蓄電池の反応式のまとめ方を見ておきましょう!
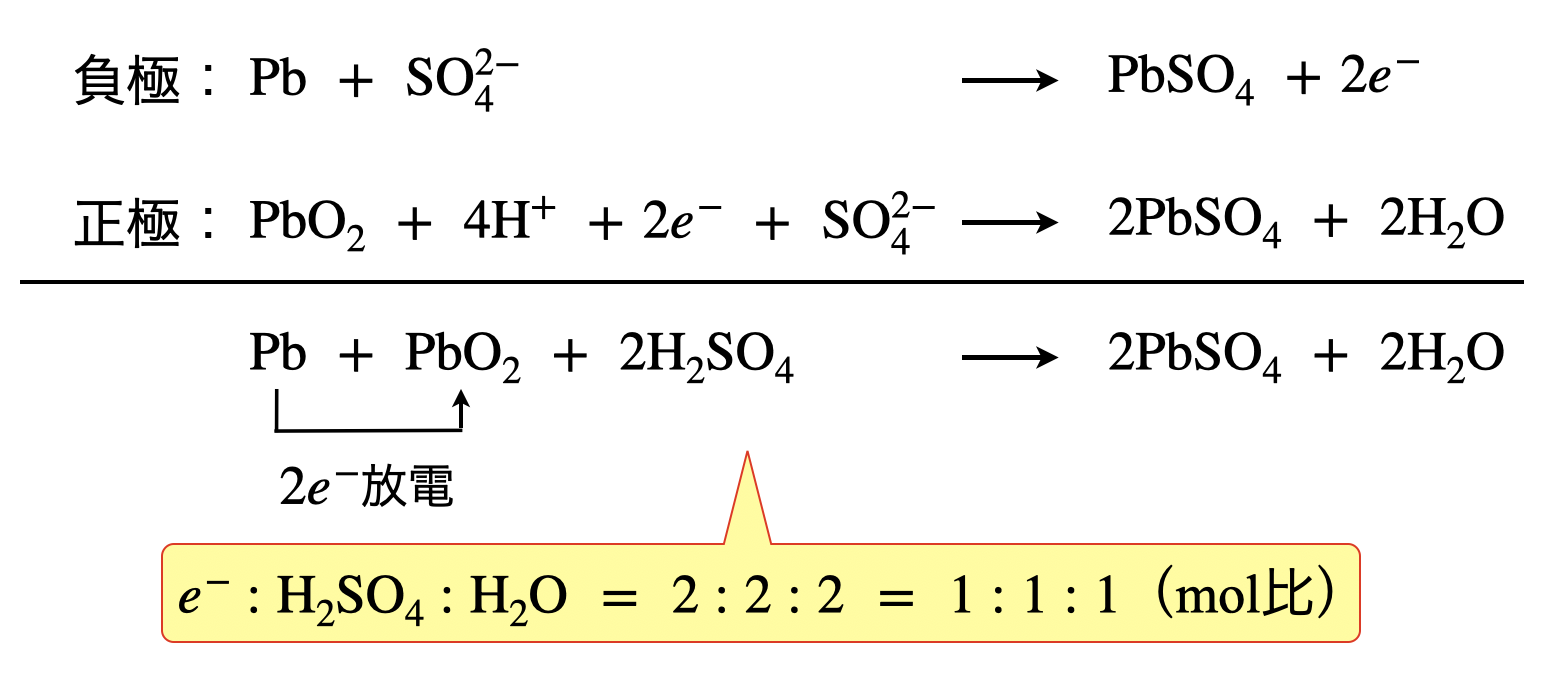
では,テストに出る計算問題のポイントを\(2\)点紹介します!
①各物質のモル比
鉛蓄電池を放電すると,\(\rm{H_2SO_4}\)が減少し,\(\rm{H_2O}\)が増加していきます.その結果,希\(\rm{H_2SO_4}\)の濃度が減少します.
このときの量的関係は必ず覚えるようにしましょう!
\(e^-:\)消滅する\(\rm{H_2SO_4}\):生成する\(\rm{H_2O\ =\ 1:1:1}\)(\(\rm{mol}\)比)
②各物質の質量変化
各物質の質量変化について見ていきましょう!
まずは負極です.負極の反応を再掲します.
負極:\(\rm{Pb\ +\ SO_4^{2-}\ →\ PbSO_4↓\ +\ }\)\(2e^-\)
負極は,\(\rm{Pb→PbSO_4}\)へ変化し,\(\rm{SO_4}\)分の質量が「増加」します.\(e^-\)が\(1\ \rm{mol}\)放電すると,\(\rm{SO_4}\)が\(\large \frac{1}{2}\ \small \rm{mol}\)(\(\rm{= 48\ g/mol}\))増加します.
次は正極の反応です.
正極:\(\rm{PbO_2\ +\ 4H^+\ +\ }\)\(2e^-\ \rm{+\ SO_4^{2-}\ →\ PbSO_4\ +\ 2H_2O}\)
正極は,\(\rm{PbO_2→PbSO_4}\)へ変化し,\(\rm{SO_2}\)分の質量が「増加」します.\(e^-\)が\(1\ \rm{mol}\)放電すると,\(\rm{SO_2}\)が\(\large \frac{1}{2}\ \small \rm{mol}\)(\(\rm{= 32\ g/mol}\))増加します.
それぞれの数字や両方の電極の質量が増加する点をしっかりと覚えておきましょう!
燃料電池
燃料電池とは,燃焼熱を電気エネルギーに変換する装置です.\(\rm{H_2}\)を用いた燃料電池としては,電解液の違いによってリン酸型と水酸化カリウム型があります.\(\rm{H_2O}\)が発生するのがどちらの電極であるのかというのを注意しながら学習を進めていきましょう!
リン酸型
リン酸型の燃料電池は,\(\rm{H_2O}\)が正極側で生成すると覚えましょう!
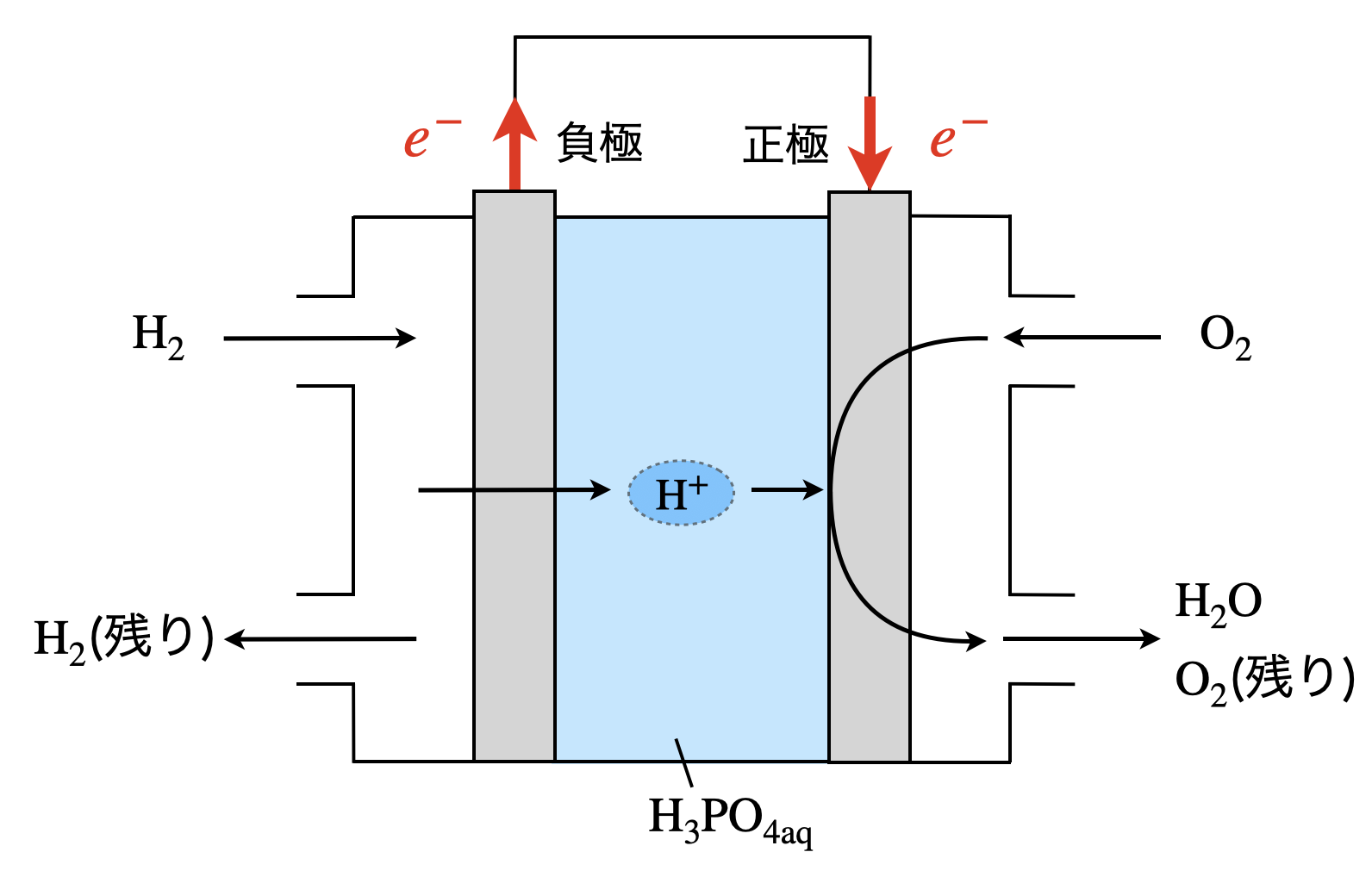
まず,負極で\(\rm{H_2\ →\ H^+}\)となる反応が起こります.
負極:\(\rm{H_2\ →\ 2H^+\ +\ }\)\(2e^-\)
そして正極では,供給される\(\rm{O_2}\)が\(\rm{O_2\ →\ O^{2-}}\)と反応し,さらに\(\rm{O^{2-}}\)が\(\rm{H^+}\)(酸性条件)と反応して\(\rm{H_2O}\)が発生します.
正極:\(\rm{O_2\ +\ 4H^+\ +\ }\)\(4e^-\ →\ \rm{2H_2O}\)
負極と正極の反応を足し合わせると,以下のようになります.
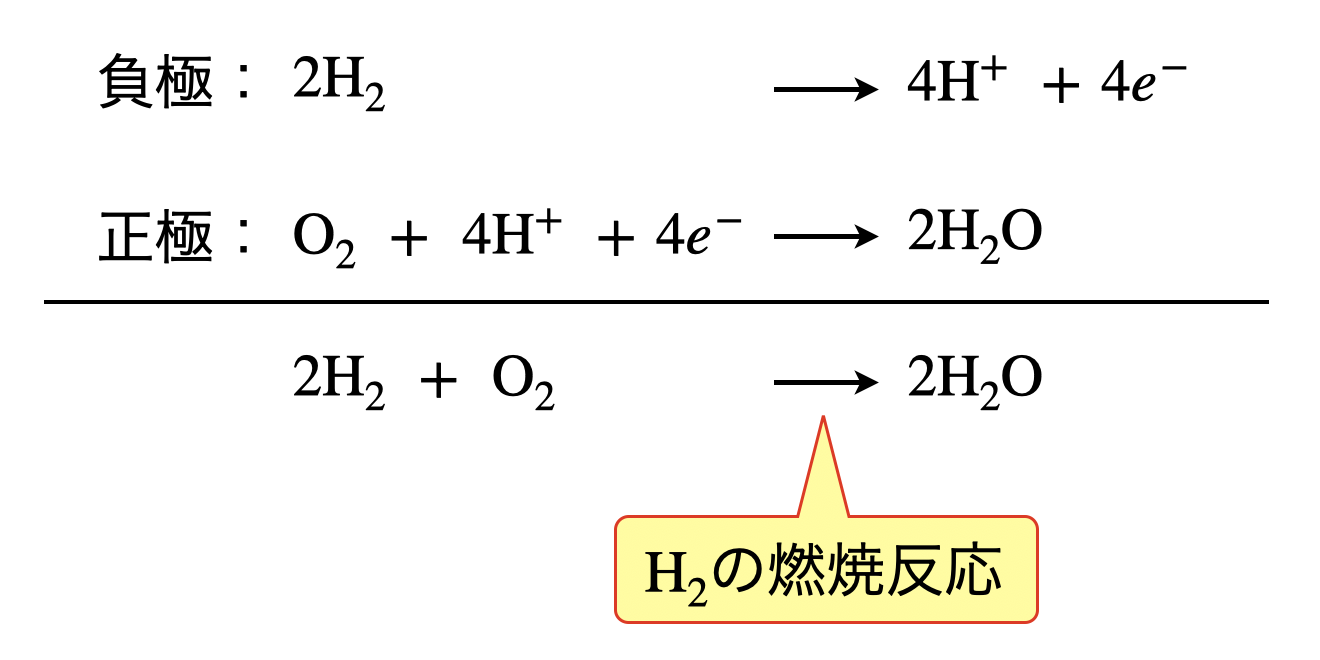
これは,\(\rm{H_2}\)の燃焼反応を表しています.つまり,\(\rm{H_2}\)の燃焼熱を電気エネルギーに変えているのが燃料電池であるということがわかります.
水酸化カリウム型
水酸化カリウム型の燃料電池は,\(\rm{H_2O}\)が負極側で生成すると覚えましょう!
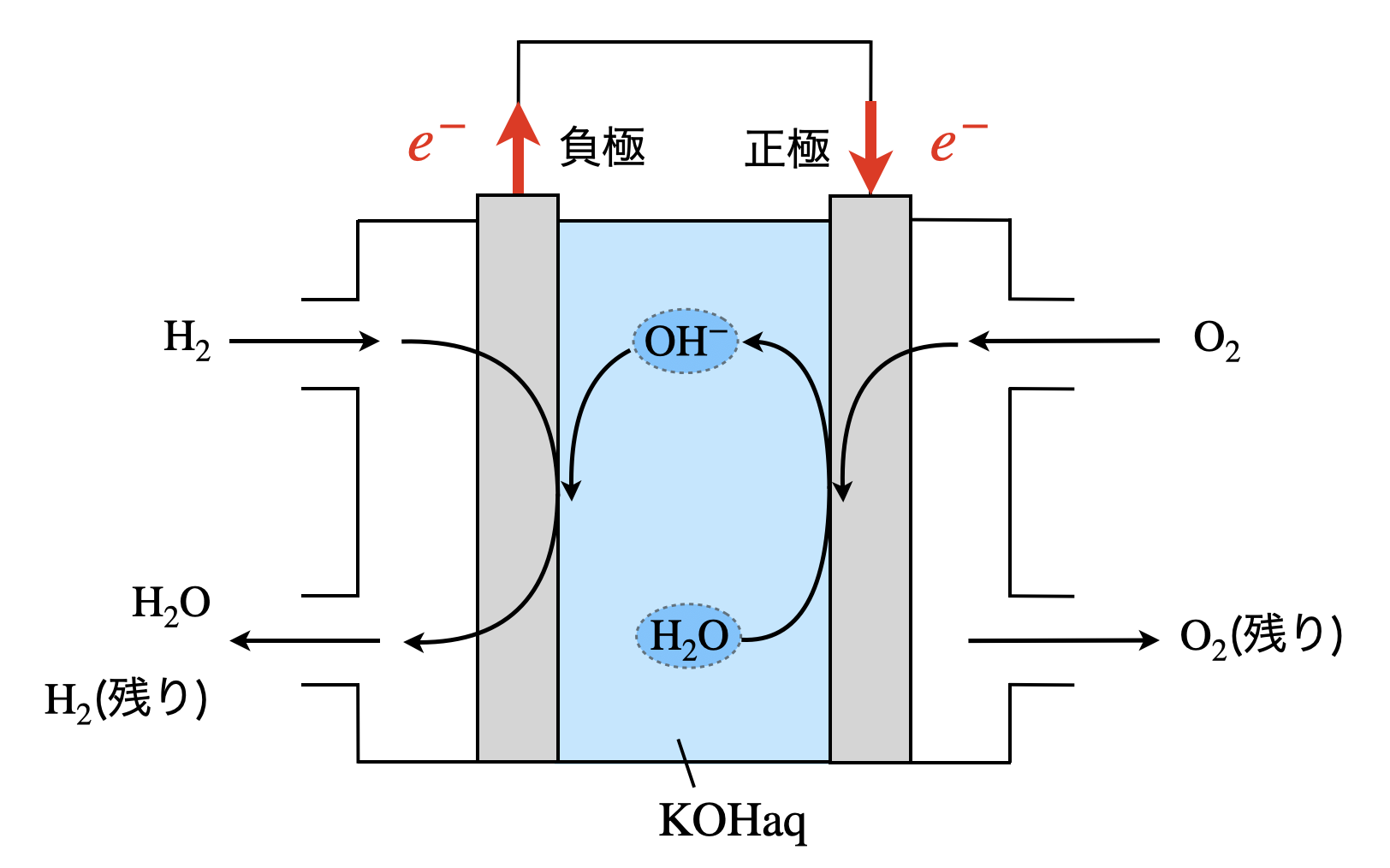
まず負極での反応です.
塩基性の条件では,\(\rm{H_2→H^+}\)の反応で生成した\(\rm{H^+}\)が溶液中の\(\rm{OH^-}\)と中和反応を起こして\(\rm{H_2O}\)となります.
そのため負極側で\(\rm{H_2O}\)が発生します.
負極:\(\rm{H_2\ +\ 2OH^-\ →\ 2H_2O\ +\ }\)\(2e^-\)
そして正極では,供給される\(\rm{O_2}\)が\(\rm{O_2\ →\ O^{2-}}\)という反応により,この\(\rm{O^{2-}}\)が\(\rm{H_2O}\)(中性・塩基性条件)と反応して\(\rm{OH^-}\)となります.
正極:\(\rm{O_2\ +\ }\)\(4e^-\ \rm{+\ 2H_2O\ →\ 4OH^-}\)
水酸化カリウム型についても負極と正極の反応を足し合わせると,以下のようになります.
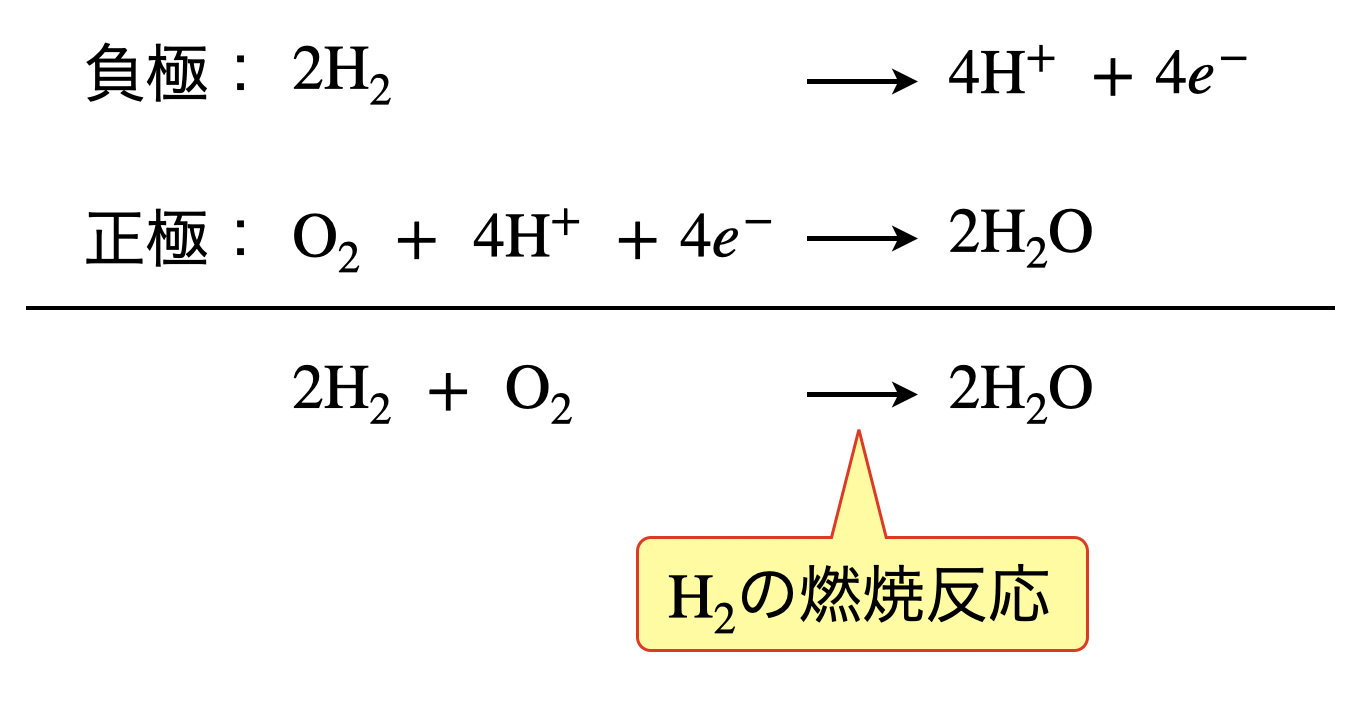
つまり,リン酸型でも水酸化カリウム型でも足し合わせると同じ反応式となります.
ニッケル−カドミウム電池
ニッケル−カドミウム電池については,それほど頻出ではありませんが,万が一テストに出たときのために一応学習しておきましょう!
ニッケル−カドミウム電池は,\(\rm{KOH}\)水溶液に\(\rm{Cd}\)(カドミウム)と\(\rm{NiO(OH)}\)(酸化水酸化ニッケル(\(\rm{I\hspace{-.15em}I\hspace{-.15em}I}\)))を浸したものです.
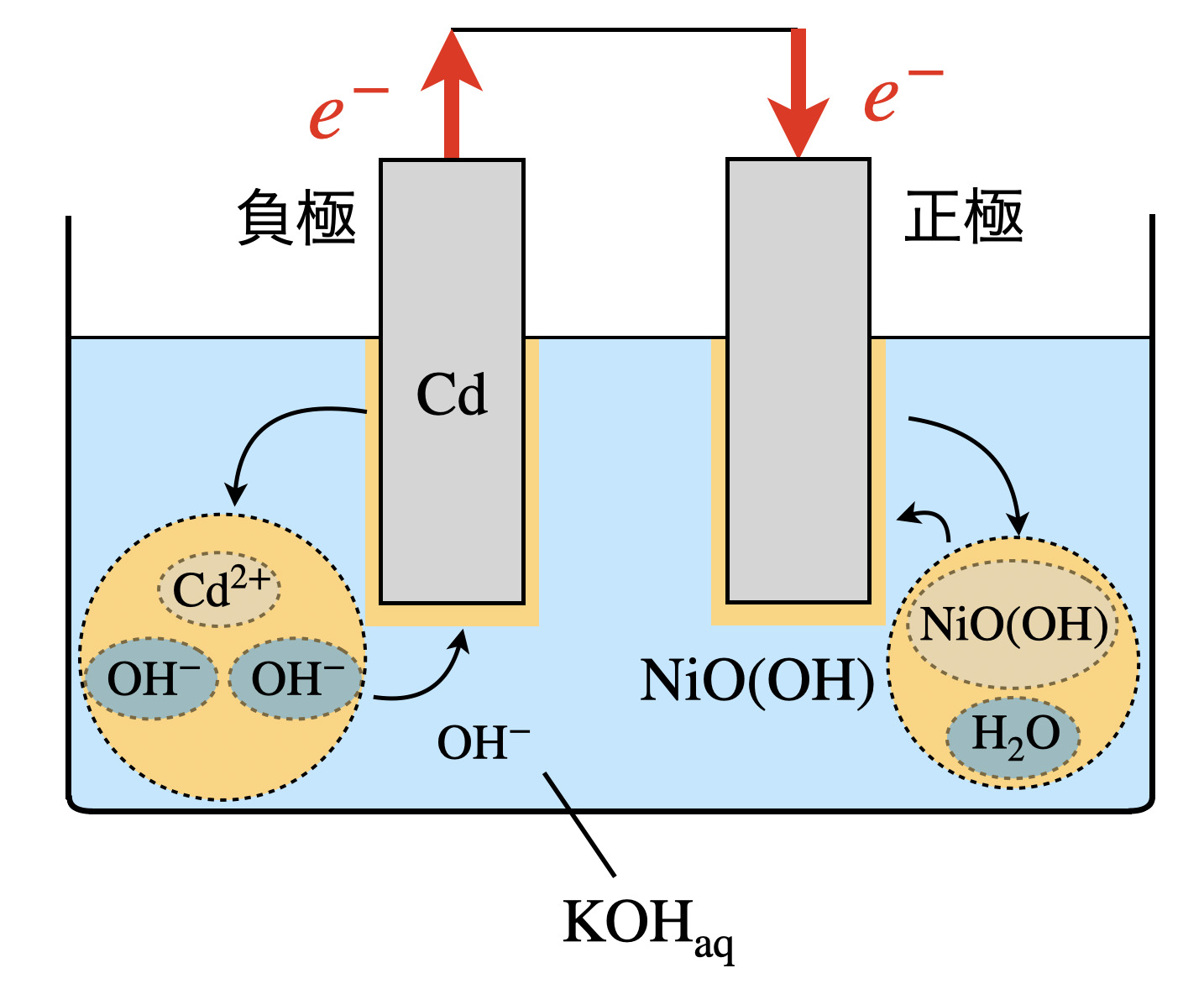
それぞれの極での反応を見ておきましょう!
負極では,\(\rm{Cd→Cd^{2+}}\)となることで,\(e^-\)を放出します.そして,\(\rm{Cd^{2+}}\)は水溶液中の\(\rm{OH^-}\)と反応して,\(\rm{Cd(OH)_2}\)となります.
負極:\(\rm{Cd\ +\ 2OH^-\ →\ Cd(OH)_2\ +\ }\)\(2e^-\)
一方で正極は,\(\rm{NiO(OH)}\)が\(e^-\)を得ることで,\(\rm{Ni(OH)_2}\)となります.
正極:\(\rm{NiO(OH)\ +\ H_2O\ +\ }\)\(e^-\ →\ \rm{Ni(OH)_2\ +\ OH^-}\)
負極・正極で生じた\(\rm{Cd(OH)_2}\)と\(\rm{Ni(OH)_2}\)はいずれも水に溶けず電極に付着するので,充電をすることで,再び使えるようになります.そのため,ニッケル−カドミウム電池も二次電池と言われます.この基本的な考え方は鉛蓄電池と同じですね!
ニッケル−カドミウム電池などの特殊な電池は各電極での反応を覚えているだけで得点できるので,余裕のある方は覚えておくといいと思います!



コメント