
- 弱酸生成反応とは?
- 酸の強さの見極め方は?
を特にポイントとしています.超初心者でもわかるように丁寧に解説していますので,頑張って自分のものにしていきましょう!
弱酸生成反応の解説を始める前に
参考書や模試の解説などを読んでいると,よく弱酸生成反応という言葉を見かけることがあると思います.私も受験生時代にはよく見たことがありましたが,参考書を読んでもさっぱりで無視しながら勉強を進めていました.
ただ,原理を理解してしまえば,未知の反応に対しても使えるすぐれものなので,今回でぜひ苦手を得意に変えてしまいましょう!
私もわからなかった部分の\(1\)つなので,特に丁寧に解説していきますよ!
弱酸生成反応ってなに?
弱酸生成反応とは,強酸から弱酸が生成する反応のことをいいます.言葉だけではまったくイメージがつかないと思うので,具体例を考えてみましょう!
\(\rm{HA_1}\)という酸があるとして,これのナトリウム塩(\(\rm{NaH_1}\))で存在しているとします.そこへ別の酸である\(\rm{HA_2}\)を加えたとします.
ここで酸の強さが\(\rm{HA_2 > HA_1}\)であったとします.酸の強さとは,\(\rm{H^+}\)イオンを投げつける力の強さと捉えてください!すると,\(\rm{HA_2\ →\ H^+\ +\ {A_2}^-}\)が優先的に起こり,この\(\rm{H^+}\)イオンをもう片方の\(\rm{A_1}\)が受け取ります.図にすると下のようになります.
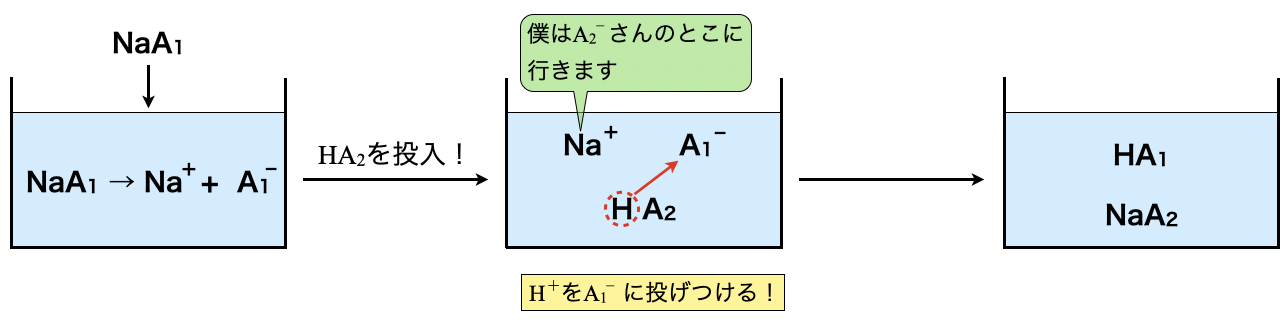
酸の強さで強い方(\(\rm{HA_2}\))が投げつけ専門,弱い方(\(\rm{HA_1}\))が受け取り専門というイメージで私は理解しています!逆はそれぞれにとってストレスとなるので,その反応は進まないと覚えてくださいね!
補足として,酸の強さは酸の電離定数\(K_{\rm{a}}\)によって決定することができます.
弱酸生成反応を見極めるためには,酸の強さを見極める必要があります.その方法を次の章でお伝えします!
酸の強さを見極めよう!
弱酸生成反応を見極めるために重要な酸の強さについて見抜けるようにしましょう!
以下の練習問題を解くことで,酸の強さの大小関係をしっかりと見極められるようになります.ここに出てくる物質が今後も重要になってくるので,しっかりと理解してくださいね!
次の各酸の強さの関係を示せ.
(\(1\))\(\rm{H_2SO_4}\),\(\rm{H_2SO_3}\)
(\(2\))\(\rm{H_3PO_4}\),\(\rm{H_2SO_4}\)
(\(3\))\(\rm{H_2CO_3}\),\(\rm{{HCO_3}^-}\)
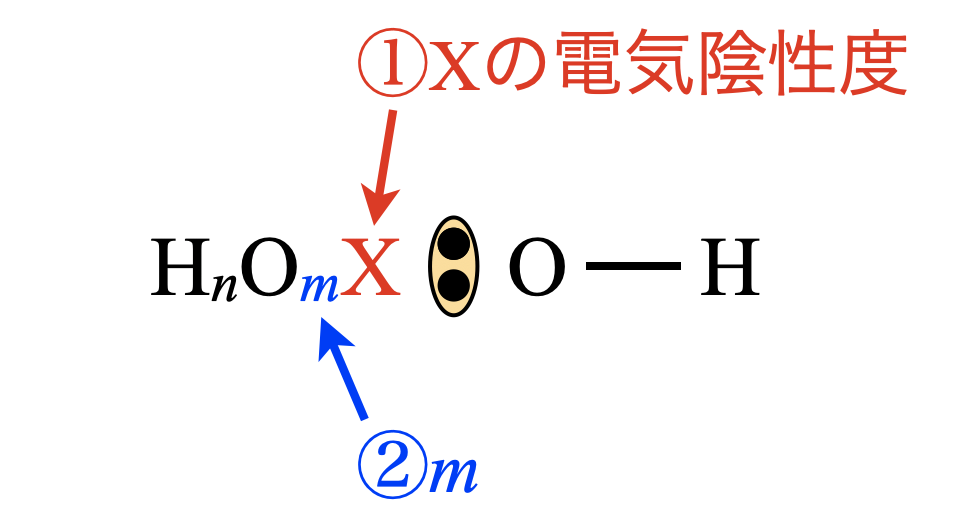
これらの物質は酸素酸つまり\(\rm{X-O-H}\)の形をした酸です.これらの酸の強さを見極めるためには,以下の形にして
①\(\rm{X}\)の電気陰性度の強さ
②\(\rm{O}\)原子の数\(m\)の多さ
を見極めていきます.①,②それぞれ大きいほど電子全体が左側へ引き付けられます.すると,\(\rm{OH}\)基の\(\rm{H}\)の\(\delta^+\)が大きくなり,\(\rm{H^+}\)イオンを放出しやすくなります(=酸の強さが強くなります).
(\(1\))
\(\rm{H_2SO_4}\),\(\rm{H_2SO_3}\)を表すと,下のようになります.
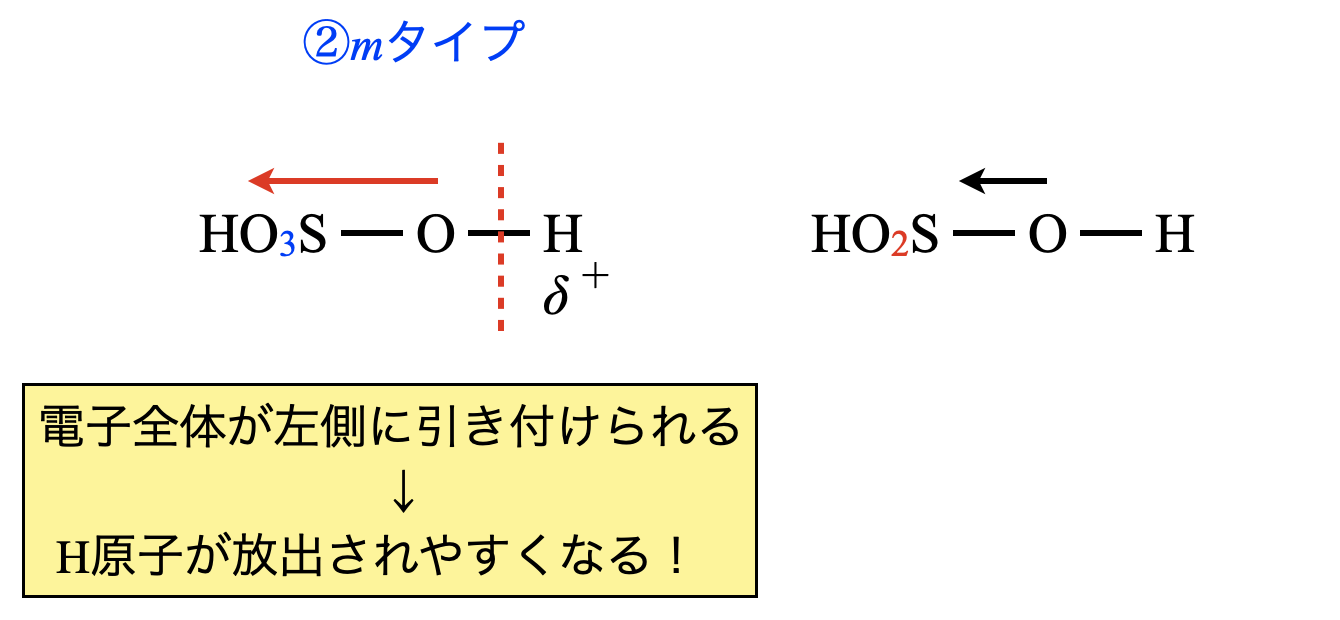
よって,\(\rm{H_2SO_4 > H_2SO_3}\)となります.
(\(2\))
\(\rm{H_3PO_4}\),\(\rm{H_2SO_4}\)を同じように表すと,下のようになります.
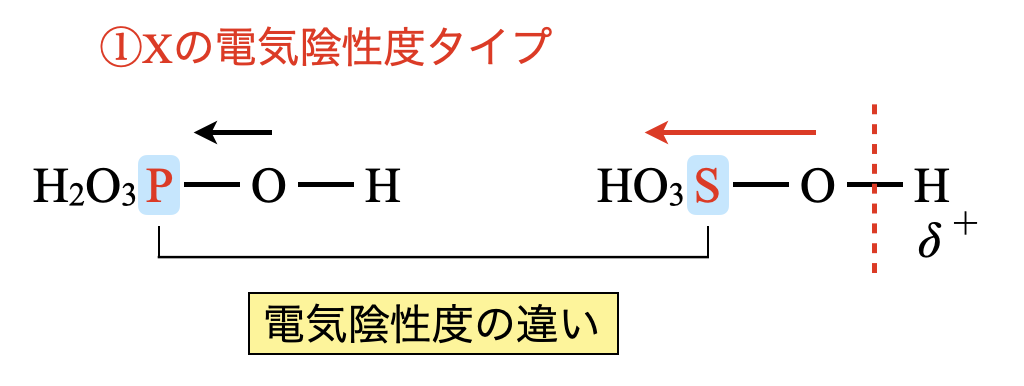
今回は\(\rm{O}\)原子の数は等しく,異なるのは中心原子のみです.中心原子の電気陰性度を比較することで,それぞれの分子の電子がどちらにより偏っているのかを見極めることができます.
電気陰性度は以下のような図で全体を捉えておきましょう.
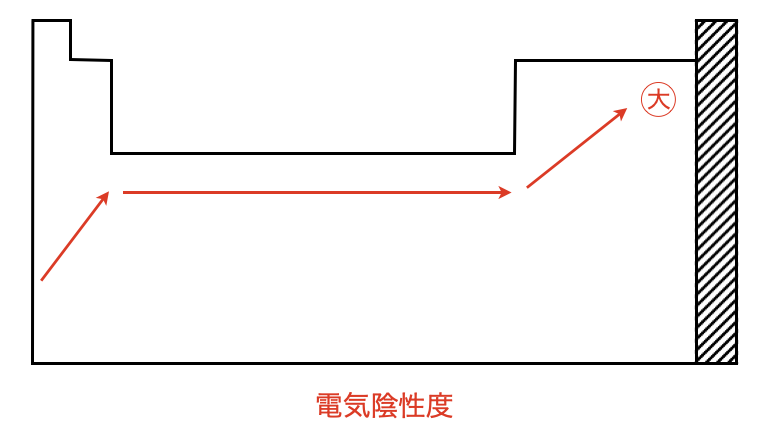
この図を見ると,同一周期では原子番号の大きい方が大きいことがわかります.よって,\(\rm{H_2SO_4 > H_3PO_4}\)となります.
(\(3\))
\(\rm{H_2CO_3}\),\(\rm{{HCO_3}^-}\)を同じように表します.
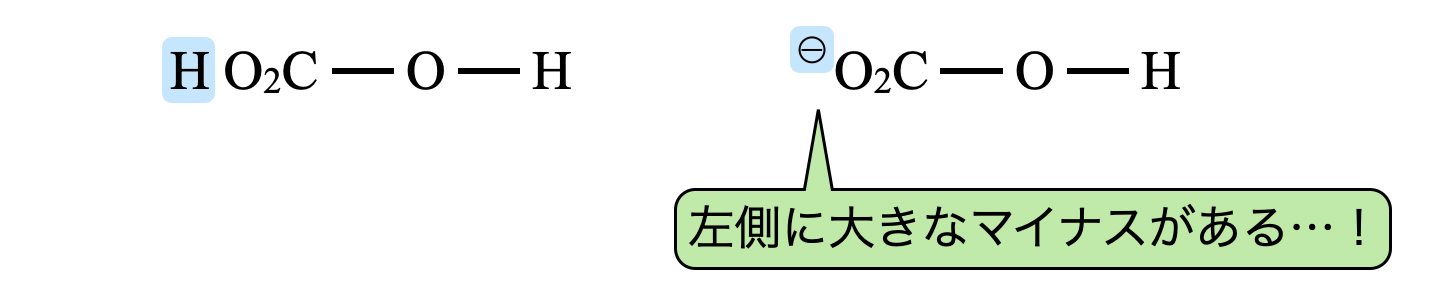
\(\rm{{HCO_3}^-}\)については,左側にマイナスがあるので,この方向へ電子を引き付ける力は弱いことがわかります.(マイナス同士で反発してしまいますね)そのため,酸の強さは\(\rm{H_2CO_3 > {HCO_3}^-}\)となります.
ここまでで酸の強さを見極める力を養うことができたと思います.次からは弱酸生成反応を攻略していきましょう!これからが本番ですよ!!
弱酸生成反応を攻略しよう!
具体的な問題を解いていきながら,どのような場合に弱酸生成反応が起こるのかを見抜いていきましょう!
以下の反応で実際に起こるのはどれか?
(\(1\))\(\rm{Na_2S\ +\ H_2SO_4\ →\ Na_2SO_4\ +\ H_2S}\)
(\(2\))\(\rm{Na_2SO_4\ +\ 2CH_3COOH\ →\ 2CH_3COONa\ +\ H_2SO_4}\)
(\(3\))\(\rm{NaCl\ +\ HF\ →\ NaF\ +\ HCl}\)
(\(4\))\(\rm{Ca_3(PO_4)_2\ +\ 3H_2SO_4\ →\ 3CaSO_4\ +\ 2H_3PO_4}\)
これらの反応はすべてある酸の塩と別の塩に関する反応です.
\(\rm{NaA_1\ +\ HA_2\ →\ …}\)
ということは,\(\rm{HA_2 > HA_1}\)であればこの反応が起こることがわかります.
(\(1\))
\(\rm{Na_2S}\)は\(\rm{H_2S}\)のナトリウム塩です.そして,\(\rm{H_2S}\)と\(\rm{H_2SO_4}\)を比較すると,酸の強さは\(\rm{H_2SO_4 > H_2S}\)となります.よって,この反応は起こります.
(\(2\))
\(\rm{Na_2SO_4}\)は\(\rm{H_2SO_4}\)のナトリウム塩です.そして,\(\rm{H_2SO_4}\)と\(\rm{CH_3COOH}\)を比較すると,酸の強さは\(\rm{H_2SO_4 > CH_3COOH}\)となります.よって,別の酸の方が酸の強さが弱いので,この反応は起こりません.
(\(3\))
\(\rm{NaCl}\)は\(\rm{HCl}\)のナトリウム塩です.そして,\(\rm{HCl}\)と\(\rm{HF}\)を比較すると,酸の強さは\(\rm{HCl > HF}\)となります.
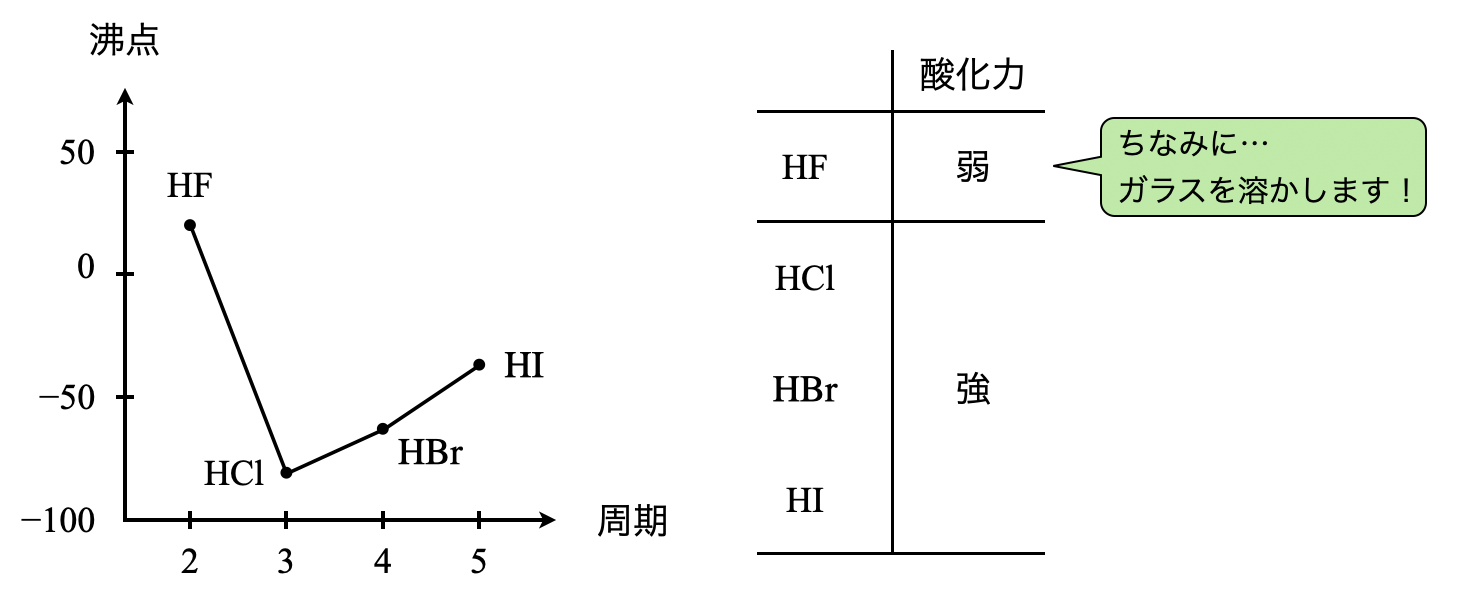
\(\rm{HF}\)はハロゲン化水素の中で例外的に弱酸なので,注意してくださいね!ハロゲン化水素については下の表でまとめて覚えてしまいましょう!
(\(4\))
\(\rm{Ca_3(PO_4)_2}\)は\(\rm{H_3PO_4}\)のカルシウム塩です.そして,\(\rm{H_3PO_4}\)と\(\rm{H_2SO_4}\)を比較すると,練習問題\(1\)(\(2\))から\(\rm{H_2SO_4 > H_3PO_4}\)であることがわかります.よって,この反応は起こります.
このようにどちらの酸がより強い酸であるかを見分けることで,その反応が起こるかどうかを見極められるようになります!次は,反応が起こったときにどのような物質が生成されるのかを考えていきましょう!
(\(1\))\(\rm{Na_2SO_3\ +\ H_2SO_4\ →}\)
(\(2\))\(\rm{Na_2CO_3\ +\ 2HCl\ →}\)
(\(3\))\(\rm{Na_2CO_3\ +\ H_2O\ +\ CO_2\ →}\)
(\(4\))\(\rm{NaHCO_3\ +\ CH_3COOH\ →}\)
これらの反応はすべてある酸の塩 + 別の酸というふうになっています.そのため酸の強さによって,反応が起こるかどうかを見極めた上で,解答していきましょう!
①\(\rm{HA_1}\)と\(\rm{HA_2}\)の酸の強さを比較する
②\(\rm{HA_2 > HA_1}\)の場合,塩と酸が入れ替わる
(\(1\))
先ほどの練習問題などから\(\rm{H_2SO_4 > H_2SO_3}\)であることがわかりますね!そのため下のように塩と酸の立場が入れ替わった生成物が得られます.
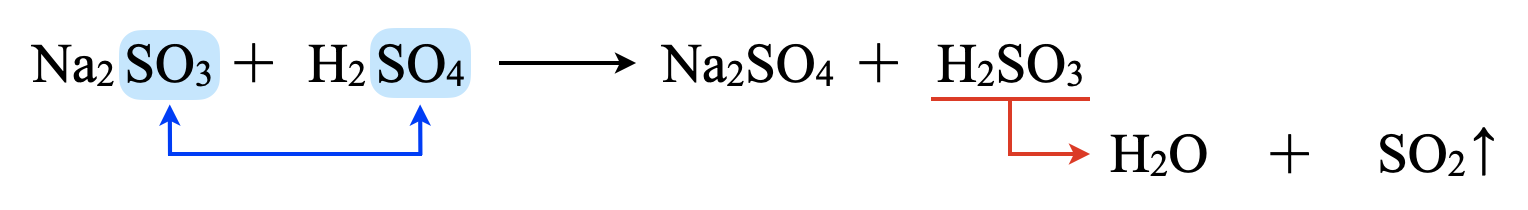
ここで,\(\rm{H_2SO_3}\)は以下のように平衡状態となり,気体(\(\rm{SO_2↑}\))が生成します.
\(\rm{H_2SO_3\ ⇄\ H_2O\ +\ SO_2↑}\)
よって,以下のようになります.
\(\rm{Na_2SO_3\ +\ H_2SO_4\ →\ Na_2SO_4\ +\ H_2O\ +\ SO_2↑}\)
(\(2\))
酸を比較すると,\(\rm{HCl > H_2CO_3}\)なので,以下のようになります.
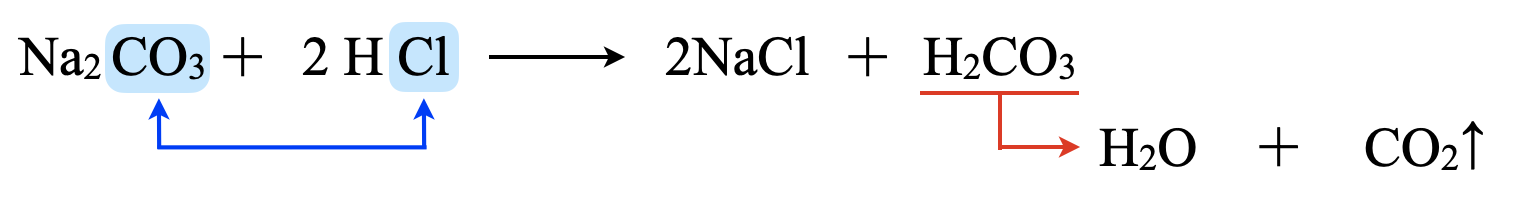
さらに\(\rm{H_2CO_3}\)は以下のように\(\rm{H_2O}\)と\(\rm{CO_2}\)になります.
\(\rm{H_2CO_3\ ⇄\ H_2O\ +\ CO_2↑}\)
よって,以下のようになります.
\(\rm{Na_2CO_3\ +\ 2HCl\ →\ 2NaCl\ +\ H_2O\ +\ CO_2↑}\)
(\(3\))
\(\rm{Na_2CO_3}\)が何由来の塩であるかは注意が必要です.\(\rm{{CO_3}^{2-}}\)は以下のような電離で生じます.
\(\rm{{HCO_3}^- ⇄ H^+ + {CO_3}^{2-}}\)
つまり,\(\rm{Na_2CO_3}\)の\(\rm{{CO_3}^{2-}}\)は\(\rm{{HCO_3}^-}\)から\(\rm{H^+}\)が電離して生じたナトリウム塩というわけです.(今までも\(\rm{H^+}\)が電離する前の物質で酸の強さを考えてきましたね!)ここは少しわかりにくいかもしれませんがとても大切なところなので,理解しておいてくださいね!
そして\(\rm{H_2O\ +\ CO_2}\)は\(\rm{H_2CO_3}\)なので,比較する酸は,\(\rm{{HCO_3}^-}\)と\(\rm{H_2CO_3}\)になります.練習問題\(1\)から\(\rm{H_2CO_3 > {HCO_3}^-}\)ですね.
よって,以下のようになります.
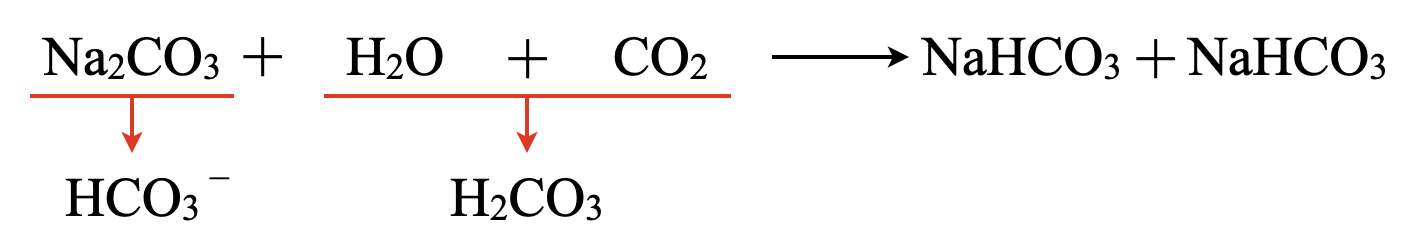
(\(4\))
この問題も\(\rm{NaHCO_3}\)が何由来のナトリウム塩であるかを考える必要があります.\(\rm{{HCO_3}^-}\)は,以下のような電離によって生じます.
\(\rm{H_2CO_3 ⇄ H^+ + {HCO_3}^-}\)
つまり\(\rm{NaHCO_3}\)は\(\rm{H_2CO_3}\)のナトリウム塩であることがわかります.酸の強さを比較すると,\(\rm{CH_3COOH > H_2CO_3}\)なので,以下のようになります.
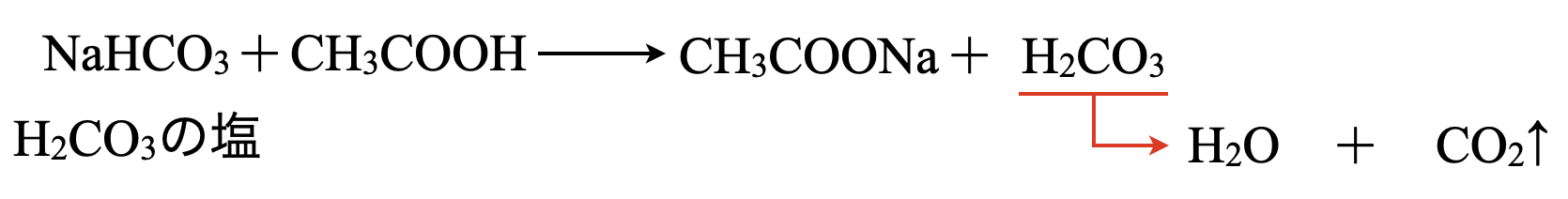
今回は以上となります.
弱酸生成反応は難しく考えがちですが,大切なのは\(2\)つの酸を比較してどちらの酸がより強い酸であるかを見極められるようになるかということです!この点を意識して練習問題などを解いてみてくださいね!わからない点などあれば,ぜひコメントください!



コメント