
それでは今日も頑張っていきましょう!
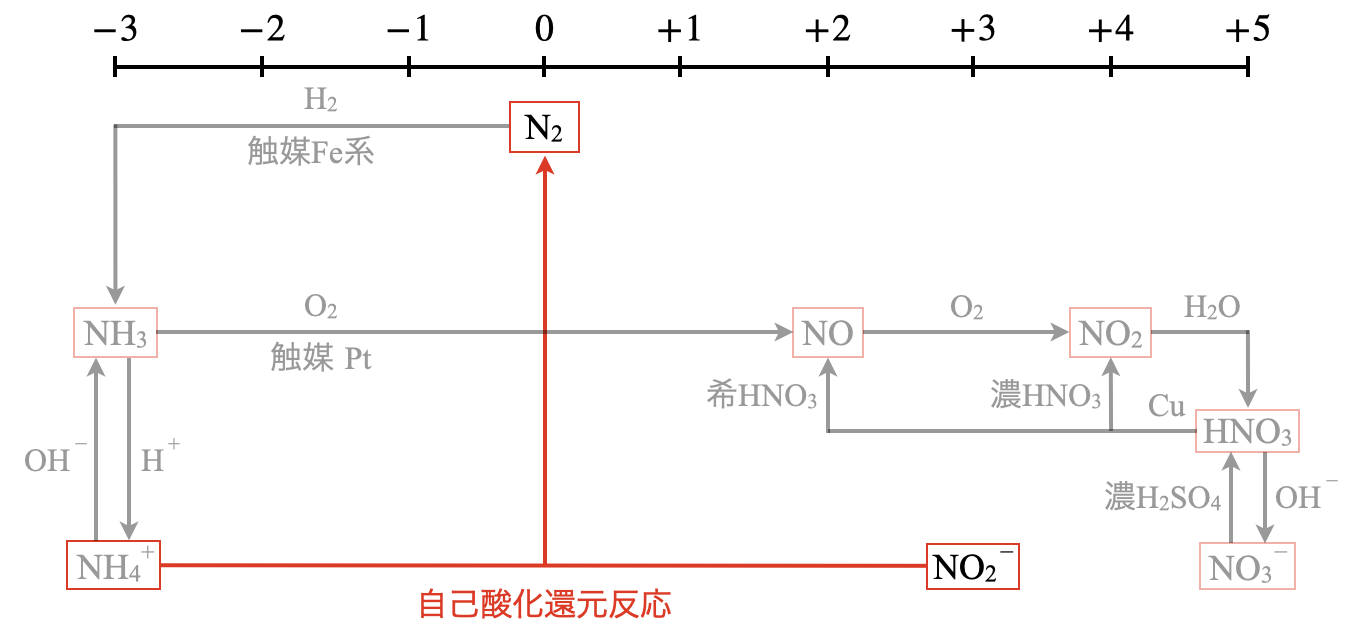
N系列の全体像

\(-3\)〜\(+5\)は\(\rm{N}\)原子のとりえる酸化数を表しています.
またこの図は上の\(2\)段が気体で,下の\(2\)段は液体やイオンになっています.実験室での気体の製法は,\(3 \cdot 4\)段目の液体やイオンを使って.上の\(1 \cdot 2\)段に上がる方法ということになります.
実験室での気体製法
実験室で気体を生成するときには,3・4段目の液体やイオンを使うのでしたね!
左側の物質から順に解説していきましょう!
まずは,\(\rm{NH_3}\)です.
同じ酸化数(\(-3\))に\(\rm{NH_4^+}\)が存在します.\(\rm{NH_3}\)は弱い塩基なので,強い塩基を加えることで,\(\rm{NH_3}\)にすることができます.つまり,\(\rm{OH^-}\)を加えれば\(\rm{OK}\)です!
\(\rm{NH_4^+\ +\ OH^-\ →\ NH_3↑\ +\ H_2O}\)
では次に,\(\rm{N_2}\)の生成について考えましょう.
\(\rm{N_2}\)の\(3 \cdot 4\)段目には残念ながら物質がありません.この場合は,\(4\)段目の\(-3\)の所にある\(\rm{NH_4^+}\)と\(+3\)のところにある\(\rm{NO_2^-}\)を反応させることで,\(\rm{N_2}\)を生成します!
最後に,\(\rm{NO}\)や\(\rm{NO_2}\)について考えましょう.
これらの物質の下の段にはなんの物質もありませんね.そのため,\(+5\)の酸化数で酸化力の強い酸である硝酸\(\rm{HNO_3}\)を使うことで,\(\rm{NO}\)や\(\rm{NO_2}\)を生成します.具体的な生成方法については,後から説明しますね!
このようにして考えると,上の図は各物質の流れが非常にわかりやすくなっていますね!
つまり,この図を覚えると,\(\rm{N}\)系の物質については完全に理解できる!というわけです!
工業的製法
工業的製法について考えていくときに大切になるのが,コストです!コストがかかりすぎれば,企業は赤字になり経営していくことができません.この中で,最もコストのかからない物質はなんでしょうか?
それは,皆さんの周りにある窒素\(\rm{N_2}\)です!!!
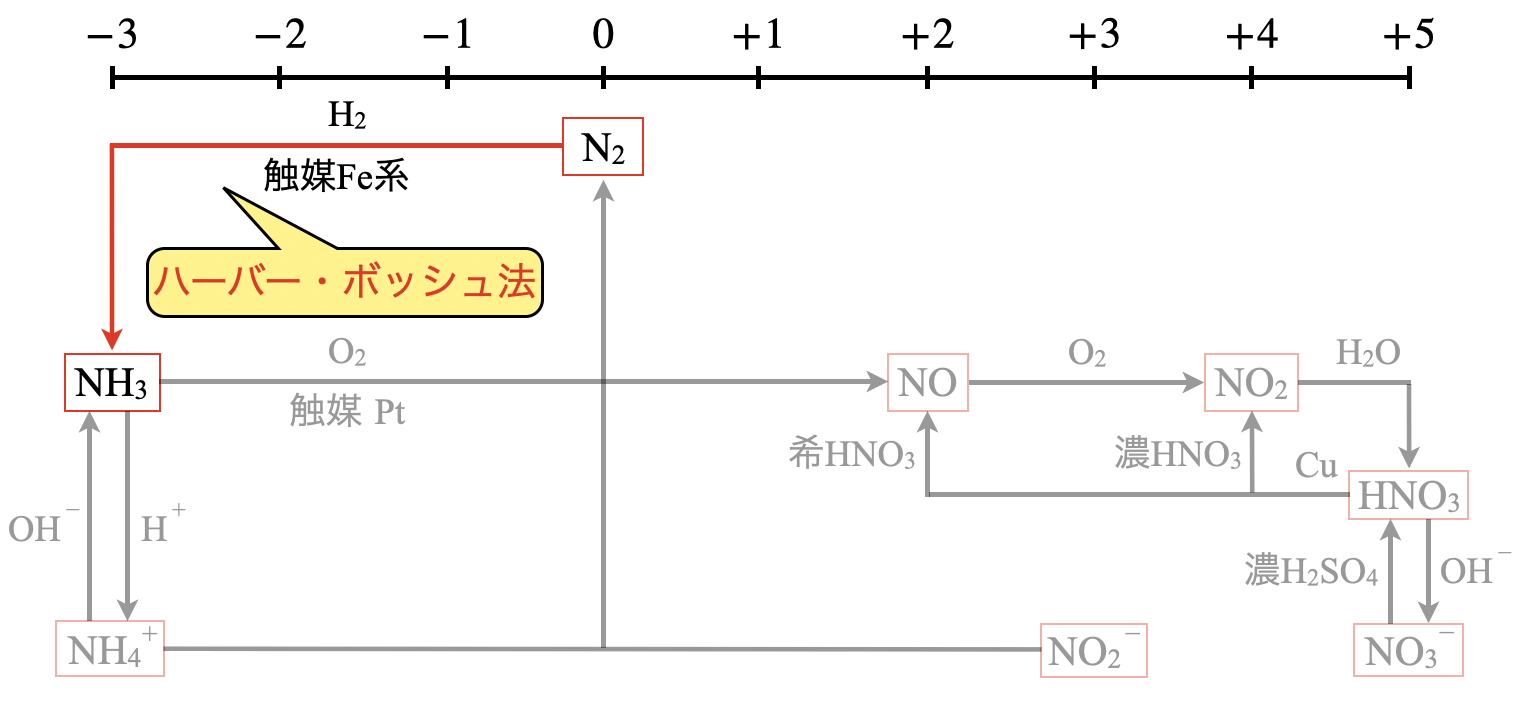
この\(\rm{N_2}\)からハーバー・ボッシュ法という方法で\(\rm{NH_3}\)にします.そしてこの\(\rm{NH_3}\)をオストワルト法によって.\(\rm{NO}\)や\(\rm{NO_2}\),さらには\(\rm{HNO_3}\)を生成します.
これは\(\rm{N_2}\)が\(\rm{O_2}\)と反応することで一酸化窒素\(\rm{NO}\)が生成するという反応です.\(\rm{N_2}\)は空気中に大量にあるので,それが簡単に\(\rm{O_2}\)と反応してしまうと,雨が降るたびに硝酸が降ってくるということになります……それは危なすぎますよね…笑
窒素単体の生成
亜硝酸アンモニウムの水溶液を加熱することで,窒素\(\rm{N_2}\)が生成されます.
\(\rm{NH_4NO_2\ →\ N_2↑\ +\ 2H_2O}\)
図を見るとすぐにわかるのですが,\(\rm{NH_4^+}\)の\(\rm{N}\)原子の酸化数は\(-3\),\(\rm{NO_2^-}\)の\(\rm{N}\)原子の酸化数は\(+3\)です.両イオンが衝突して,\(\rm{NH_4^+ → NO_2^-}\)へ\(e^-\)が\(3\)個移動します.
このように\(\rm{N}\)自身で\(e^-\)を投げ合う反応を自己酸化還元反応といいます.
アンモニア
工業的にアンモニアは,\(\rm{N_2}\)と\(\rm{H_2}\)の体積比\(1:3\)の混合気体を,\(\rm{Fe}\)系の触媒(\(\rm{Fe_3O_4}\)など)を用いて直接反応させることで得られます.この方法をハーバー・ボッシュ法といいます.
\(\rm{N_2\ + 3H_2\ ⇄\ 2NH_3\ +\ 92\ kJ}\)
この反応は可逆的なので,ルシャトリエの原理を使ってより\(\rm{NH_3}\)を生成できる条件を考えます.
まずルシャトリエの原子より,\(\rm{NH_3}\)の生成(右向き)に対して気体の分子数が減少するため,平衡に関しては高圧ほど有利であることがわかります.また,温度については発熱反応なので,低温ほど有利であることがわかります.
ただし,ここで矛盾が生じてしまうのです…
反応速度に関しては高温ほど望ましいのに,発熱反応なので,低温ほど有利であるということです.
これは大きな矛盾ですね.これを解決するポイントを\(3\)つにまとめました.
\(\rm{Point\ 2}\):温度を上げる
\(\rm{Point\ 3}\):高圧にする
\(\rm{Point\ 1}\):\(\rm{Fe_3O_4}\)などの\(\rm{Fe}\)系触媒を加える
この反応は極めて反応速度が遅いので,速度を上げる工夫が必要です.そこで,反応速度を上げる工夫として,\(\rm{Fe_3O_4}\)などの\(\rm{Fe}\)系触媒を加えます.
\(\rm{Point\ 2}\):温度を上げる
温度を上げると書きましたが,先程の説明の通り高すぎてはいけません.大体\(\rm{500^\circ C}\)程度の温度設定にします.
\(\rm{Point\ 3}\):高圧にする
これはルシャトリエの原理から高圧の方が有利であることがわかります.\(2×10^7\)〜\(\rm{10^8\ Pa}\)という高圧にして\(\rm{NH_3}\)の収率を高めます.
この\(3\)点に注意することでやっとこさ\(\rm{NH_3}\)を生成することができるようになりました.
アンモニアの検出反応
アンモニアは塩化水素と反応して塩化アンモニウムの白煙を生じる反応が起こります.
\(\rm{NH_3\ +\ HCl →NH_4Cl}\)
このアンモニア水溶液にネスラー試薬を加えると,黄褐〜赤褐色の沈殿が生じます.水中に含まれる\(\rm{NH_4^+}\)を検出するのに用いられるのが,ネスラー試薬です.
ネスラー試薬=アンモニアの検出反応であると覚えておいてください!
硝酸
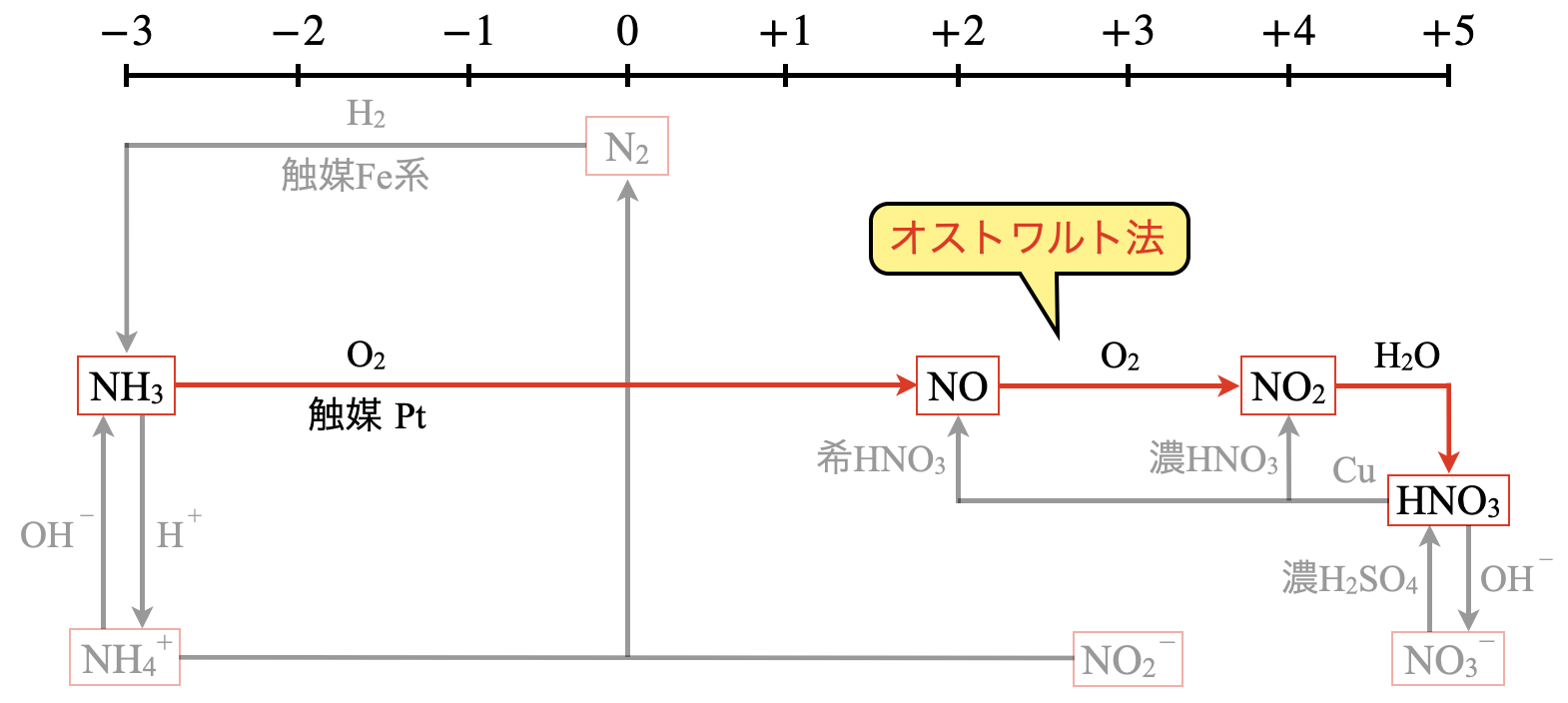
硝酸\(\rm{HNO_3}\)は\(\rm{NH_3}\)と\(\rm{O_2}\)の混合気体を触媒である\(\rm{Pt}\)網に次々と流し込んで\(\rm{NH_3}\)を燃焼させて\(\rm{NO}\)を生成させることから始めます.このとき使われる\(\rm{NH_3}\)は先ほどのハーバー・ボッシュ法で得られたものです!
\(\rm{Point\ 2:NO\ →\ NO_2}\)
\(\rm{Point\ 3:NO_2\ →\ HNO_3}\)
\(\rm{Point\ 1:NH_3\ →\ NO}\)
\(\rm{Pt}\)触媒下で\(\rm{NH_3}\)を約\(\rm{800^\circ C}\)で燃焼させます.燃焼とは,\(\rm{O_2}\)と反応させるということですよ!
\(\rm{4NH_3\ +\ 5O_2 → 4NO\ +\ 6H_2O}\)
これによってまず,\(\rm{NO}\)が生成します.
\(\rm{Point\ 2:NO→NO_2}\)
\(\rm{Point\ 1}\)で生成した\(\rm{NO}\)を冷却することで,\(\rm{NO_2}\)が生成します.この反応では,\(\rm{NO}\)は過剰の\(\rm{O_2}\)と自然に反応して\(\rm{NO_2}\)に変化します.
\(\rm{2NO\ +\ O_2→2NO_2}\)
\(\rm{Point\ 3:NO_2→HNO_3}\)
最後に\(\rm{NO_2}\)を\(\rm{H_2O}\)と高温で反応させることで,\(\rm{HNO_3}\)が生じます.このとき,副生成する\(\rm{NO}\)は再び\(\rm{Point\ 2}\)で\(\rm{O_2}\)と反応するので,結局すべての\(\rm{NO}\)は\(\rm{HNO_3}\)へ変化します.
\(\rm{3NO_2\ +\ H_2O → 2HNO_3\ +\ NO}\)
これらの一連の反応方法をオストワルト法といいます.
\(\rm{NO_2}\)を低温で水中に加えると,以下のような反応が起こります.
\(\rm{2NO_2\ +\ H_2O →HNO_3\ +\ HNO_2}\)
紛らわしいので,間違えないようにしっかりと覚えましょう!
オストワルト法の一連の反応式の導き方
先ほど示した\(3\)つの反応式を下にまとめてみましょう!
① \(\rm{4NH_3\ +\ 5O_2 → 4NO\ +\ 6H_2O}\)
② \(\rm{2NO\ +\ O_2→2NO_2}\)
③ \(\rm{3NO_2\ +\ H_2O → 2HNO_3\ +\ NO}\)
オストワルト法の一連の反応式を考えるときに大切なのが,反応の途中で生成される\(\rm{NO}\)や\(\rm{NO_2}\)に関しては回収して再利用されるため,中間生成物にすぎないということです.そのため,\(\rm{NO}\)と\(\rm{NO_2}\)を削除していきましょう!
- \(\rm{NO_2}\)の削除
- \(\rm{NO}\)の削除
\(\rm{NO_2}\)を削除するために,②\(\ ×\ 3\),③\(\ ×\ 2\)しましょう.
②\(\rm{’:6NO\ +\ 3O_2 → 6NO_2}\)
③\(\rm{’:6NO_2\ +\ 2H_2O → 4HNO_3\ +\ 2NO}\)
②\(’\ -\ \)③\(\rm{’:4NO\ +\ 3O_2\ +\ 2H_2O → 4HNO_3}\)
この式を④にしますね.
\(\rm{NO}\)を削除するために,①\(\ +\ \)④します.
\(\rm{4NH_3\ +\ 8O_2\ → 4HNO_3\ +\ 4H_2O}\)
両辺を\(4\)でわると,
\(\rm{NH_3\ +\ 2O_2\ → HNO_3\ +\ H_2O}\)
一酸化窒素・二酸化窒素
一酸化窒素\(\rm{NO}\)と二酸化窒素\(\rm{NO_2}\)は紛らわしい性質が多いので,比較しながら覚えていきましょう!
一酸化窒素
一酸化窒素\(\rm{NO}\)は無色の水に溶けにくい気体です.銅と希硝酸を反応させることで,\(\rm{NO}\)が発生します.\(\rm{NO}\)は水に溶けにくい気体なので,水上置換で捕集します.
\(\rm{3Cu\ +\ 8HNO_3 → 3Cu(NO_3)_2\ +\ 2NO↑\ +\ 4H_2O}\)
また,\(\rm{NO}\)は空気中で容易に酸化され,赤褐色の二酸化窒素\(\rm{NO_2}\)になります.
\(\rm{2NO\ +\ O_2 →2NO_2}\)
この反応は先ほどのオストワルト法の②の式ですね!
二酸化窒素
二酸化窒素\(\rm{NO_2}\)は赤褐色で刺激臭のある有毒な気体です.\(\rm{NO_2}\)は水によく溶け弱酸性を示します.
銅に濃硝酸を反応させることで,\(\rm{NO_2}\)が発生します.
\(\rm{Cu\ +\ 4HNO_3 → Cu(NO_3)_2\ +\ 2NO_2↑\ +\ 2H_2O}\)
以上になります!今日もお疲れさまでした!
\(\rm{N}\)系列の図に自分が覚えられない要素を書き込んでいくことで,自分だけのまとめノートを作ることができますよ!少しずつ丁寧に覚えていきましょう!
今回解説した図は私が以前紹介した参考書の中の「原点からの化学 無機化学」を参考にさせていただきました!




コメント