
今回のポイントは,
- \(\rm{Na}\)系列の全体像とその性質
- \(\rm{Na}\)の融解塩電解
- \(\rm{NaCl}\)の電気分解
です.これら以外の性質についても詳しく解説していくので,少しでも自分のものにしてくださいね!
\(\rm{Na}\)系列の全体像
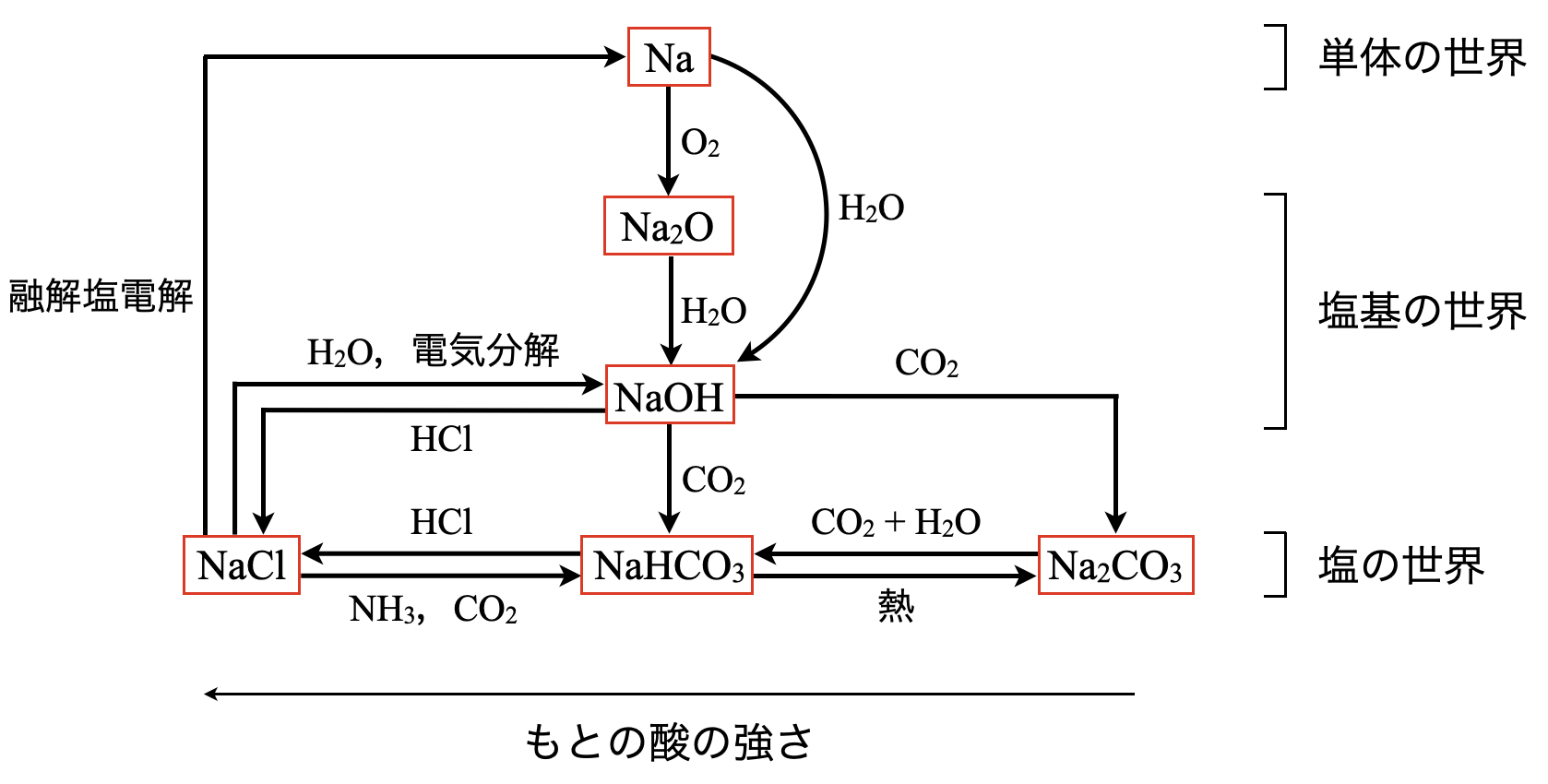
この図の\(1\)段目が単体の世界,\(2\)段目・\(3\)段目が塩基の世界,\(4\)段目が塩の世界となっています.これらの物質は,上より下,右より左の方がエネルギー的に安定しています.そのため,自発的に下や左側に反応が進んでいきます.
それでは,各物質について詳しく見ていきましょう.
\(\rm{Na}\):ナトリウム
ナトリウム\(\rm{Na}\)の重要な性質は\(2\)つです.
- 最も反応性の高い物質
- アルカリ金属は空気や水と激しく反応してしまうため,石油中に保存
ナトリウムに代表されるアルカリ金属の単体は柔らかいので,ナイフでカットすることができます.ただその切り口は空気中ですぐに酸化されて,光沢を失います.
\(\rm{4Na\ +\ O_2\ →\ 2Na_2O}\)
これに水を加えることで,水酸化ナトリウムが生成されます.
\(\rm{Na_2O\ +\ H_2O\ →\ 2NaOH}\)
これを先ほどの\(\rm{Na}\)系列の図を見ながら確認していきましょう.
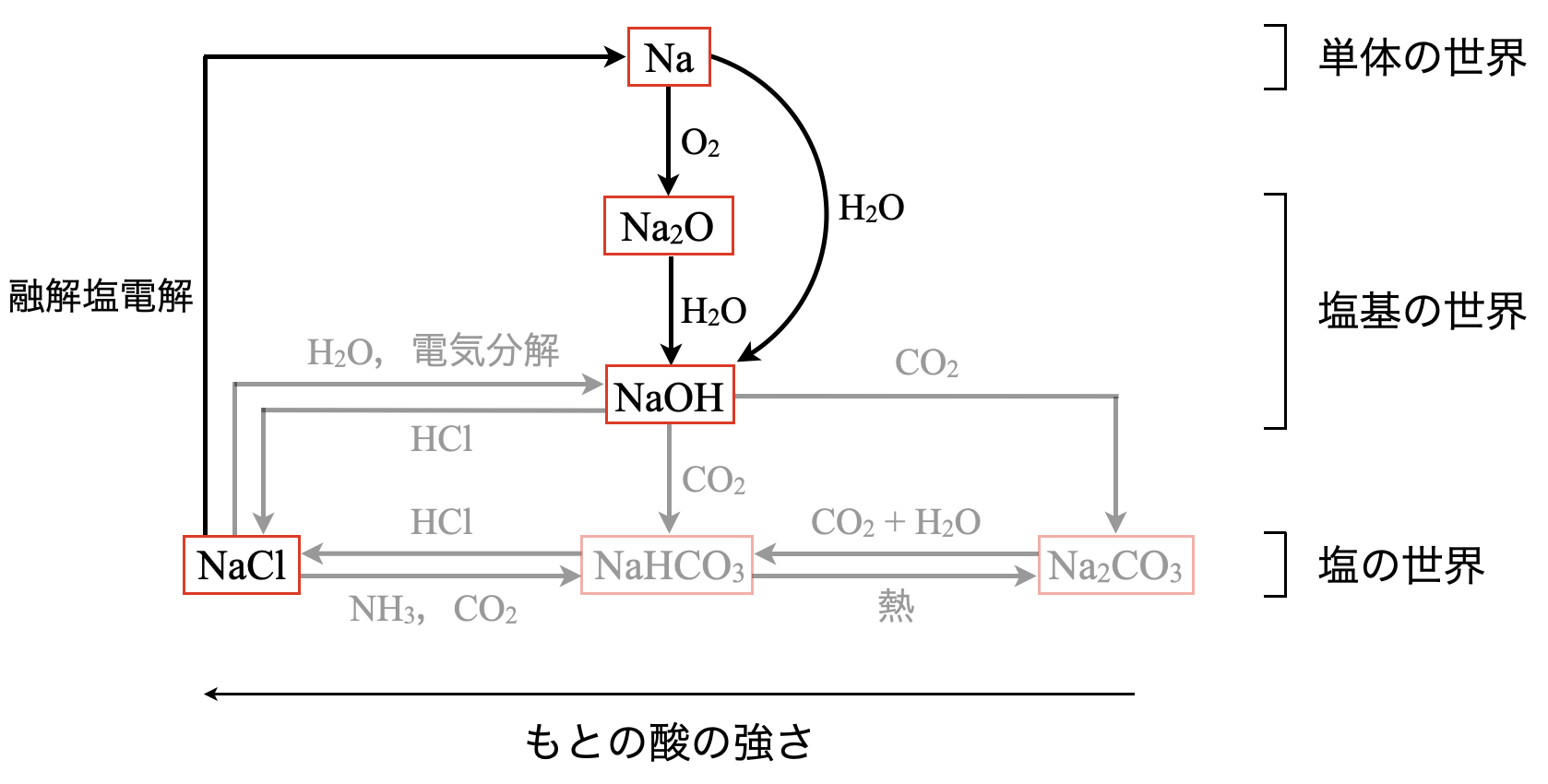
これは\(1\)段目→\(2\)段目→\(3\)段目という流れでした.一気に\(1\)段目→\(3\)段目に移動するには,\(\rm{Na}\)を常温の水と激しく反応させます.
\(\rm{2Na\ +\ 2H_2O\ →\ 2NaOH\ +\ H_2↑}\)
このようにアルカリ金属は空気や水と激しく反応してしまうため,石油中で保存するというわけです.
融解塩電解
先ほどは\(\rm{Na}\)の単体から\(\rm{NaOH}\)までの移動経路を考えてきました.
では,\(\rm{Na}\)の単体を作るにはどうすればよいでしょうか?
方法としては,自然界に存在する\(\rm{NaCl}\)(食塩)を原料とする方法があります.\(\rm{Na}\)は非常にイオン化傾向が大きいので,\(\rm{NaCl}\)を高温で融解して,電気分解することで得ることができます.
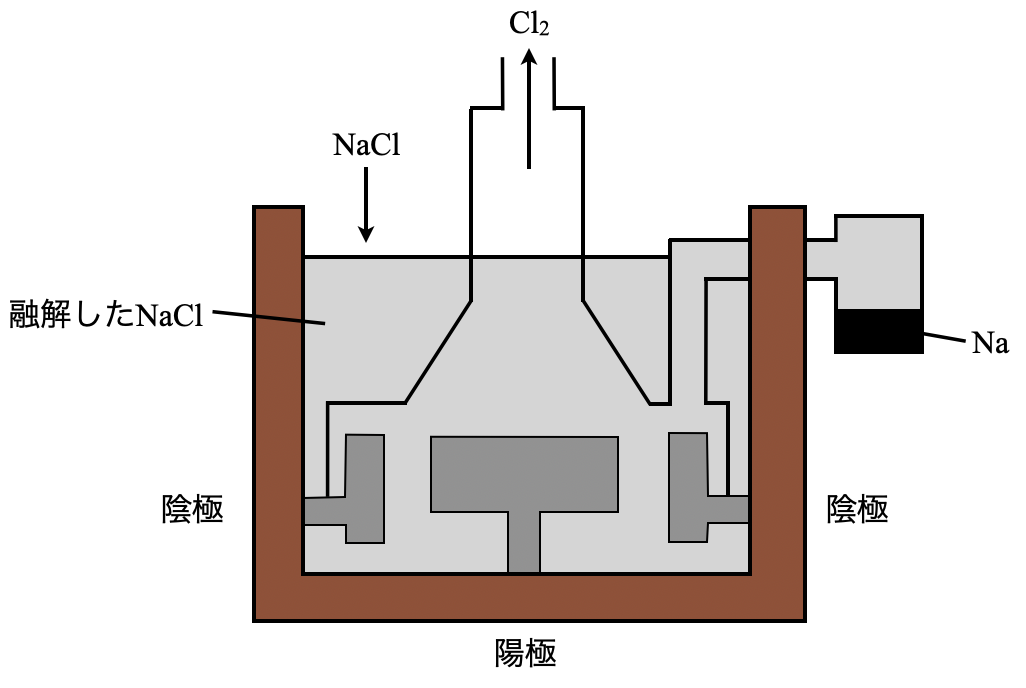
陰極:\(\rm{Na^+\ +\ }\)\(e^-\ \rm{→\ Na}\)
陽極:\(\rm{2Cl^-\ →\ Cl_2\ +\ }\)\(2e^-\)
ただ,この方法には決定的な欠点があります.それはコストがかかりすぎるということです.あまりにもコストが高いので,工業的にはこの方法は取られていません.
イオン化傾向の大きい金属(\(\rm{K}\),\(\rm{Ca}\),\(\rm{Na}\)など)は,そのイオンを含む水溶液をただ電気分解しても\(\rm{H_2}\)が発生するだけで,金属の単体を取り出すことはできません.これは,「イオン化傾向の大きい金属 = イオンとして存在したがる」ので,単体にはなりにくいということです.
このような物質に対して,水がない状態にして高温で融解させると,電気分解を行うことができ,金属の単体を取り出すことができます.つまり,イオン化傾向の大きい金属→融解塩電解で取り出す!と覚えておきましょう!
炎色反応
炎色反応は,どの参考書にも書いていると思いますが,「リアカーなきケイ村」で覚えましょう!

\(\rm{NaOH}\):水酸化ナトリウム
水酸化ナトリウムは,無色半透明の固体で,水によく溶け,水溶液は強塩基性を示します.
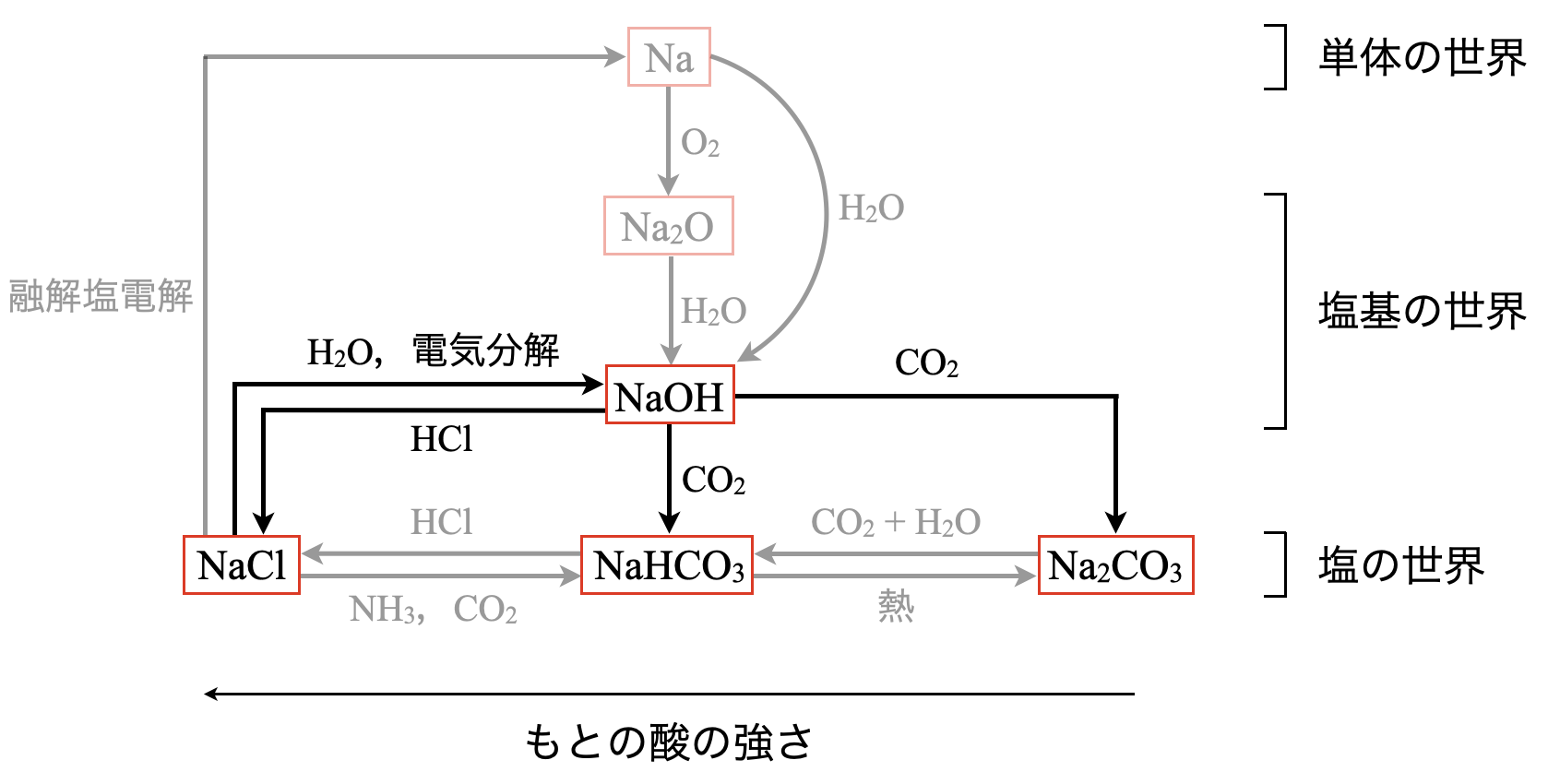
\(3\)段目の\(\rm{NaOH}\)から\(4\)段目の塩の世界で移動するには,中和反応を行います.\(\rm{NaOH}\)の結晶を空気中に放置すると,水分と\(\rm{CO_2}\)を吸収する\(2\)パターンがあります.
①水分を吸収して溶ける場合を潮解といいます.
②\(\rm{CO_2}\)を吸収して徐々に\(\rm{Na_2CO_3}\)に変化し,過剰の\(\rm{CO_2}\)と反応すると\(\rm{NaHCO_3}\)が生成されます.
\(\rm{2NaOH\ +\ CO_2\ →\ Na_2CO_3\ +\ H_2O}\)
\(\rm{NaOH\ +\ CO_2\ →\ NaHCO_3}\)
\(\rm{NaOH\ +\ HCl\ →\ NaCl\ +\ H_2O}\)
\(\rm{NaCl}\)の電気分解
工業的に\(\rm{NaOH}\)を大量に合成させるためには,\(\rm{NaCl}\)を電気分解します.
図のように,陽極槽に\(\rm{NaCl}\)飽和水溶液を供給し,陽極で\(\rm{Cl_2}\)を発生させます.一方で,陰極槽にはうすい\(\rm{NaOH}\)水溶液が仕込まれており,陰極で\(\rm{H_2}\)が発生します.
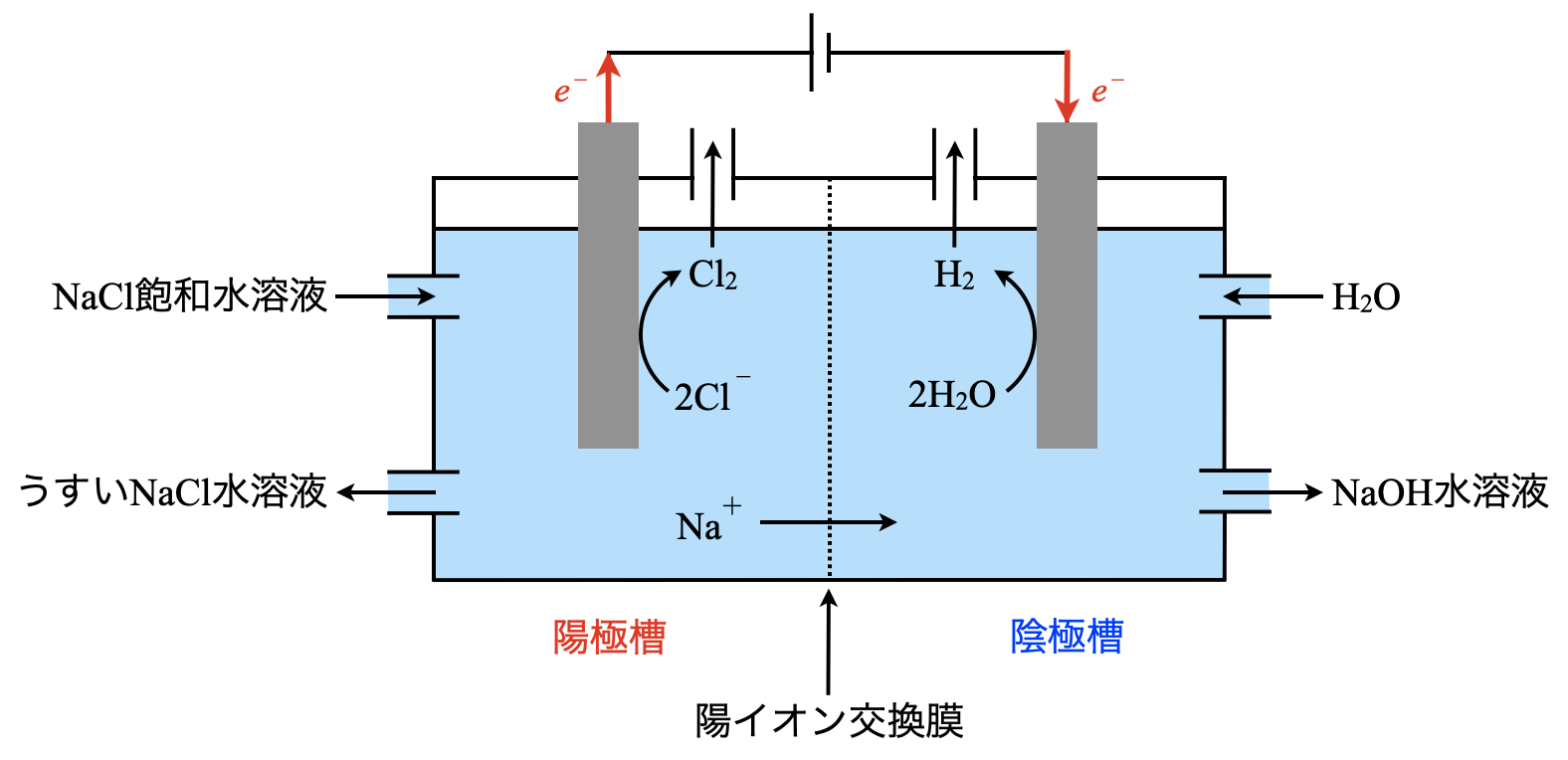
陽極:\(\rm{2Cl^-\ →\ Cl_2\ +\ }\)\(2e^-\)
陰極:\(\rm{2H_2O\ +\ }\)\(2e^-\ \rm{→\ H_2\ +\ OH^-}\)
このときに陰極では\(\rm{OH^-}\)が発生するので,電気的なつりあいが崩れてしまいます.そのため,陽イオン交換膜を通して\(\rm{Na^+}\)が陽極槽→陰極槽に移動し,電気的なつりあいを保ちます.これによってもともと仕込んであった\(\rm{NaOH}\)よりも濃い\(\rm{NaOH}\)水溶液を取り出すことができるというわけです.
\(\rm{NaHCO_3}\)・\(\rm{Na_2CO_3}\):炭酸水素ナトリウム・炭酸ナトリウム
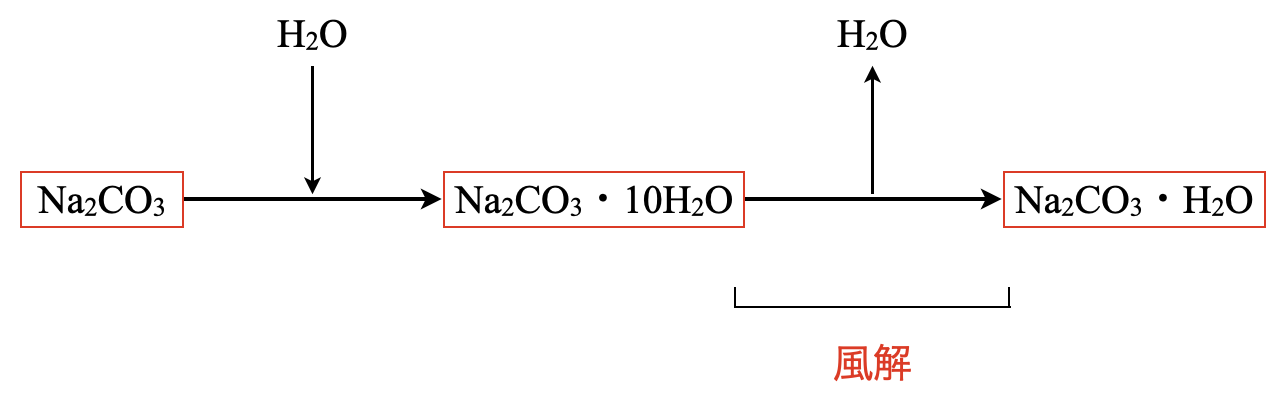
\(\rm{Na_2CO_3}\)を室温で放置すると,水分を多く含んで\(\rm{Na_2CO_3 \cdot 10H_2O}\)の結晶が析出します.
\(\rm{2NaOH\ +\ CO_2\ +\ 9H_2O\ →\ Na_2CO_3 \cdot 10H_2O}\)
この結晶を空気中に放置すると,水和水の一部が失われて,\(\rm{Na_2CO_3 \cdot H_2O}\)(白色)になります.この現象を風解といいます.
\(\rm{Na_2CO_3 \cdot 10H_2O\ →\ Na_2CO_3 \cdot H_2O\ +\ 9H_2O}\)
これらの反応をまとめると下のようになります.
最後に,\(4\)段目の世界について簡単に見ておきましょう.
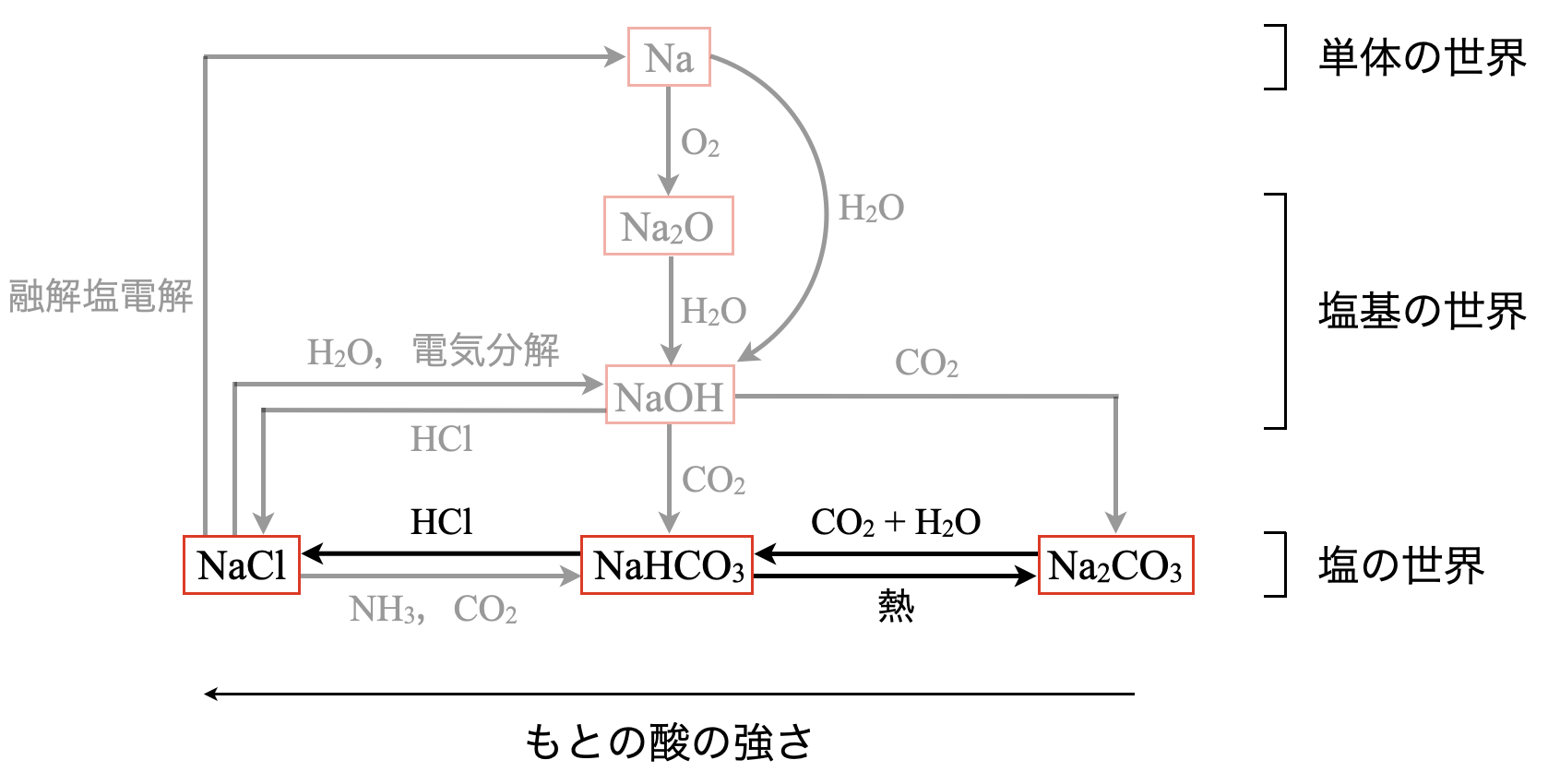
\(\rm{NaHCO_3}\)や\(\rm{Na_2CO_3}\)は弱酸生成反応によって,\(\rm{NaCl}\)が生成されます.
\(\rm{Na_2CO_3\ +\ CO_2\ +\ H_2O\ →\ 2NaHCO_3}\)
\(\rm{NaHCO_3\ +\ HCl\ →\ NaCl\ +\ H_2O\ +\ CO_2}\)
また\(\rm{NaHCO_3}\)から\(\rm{Na_2CO_3}\)へは加熱によって容易に熱分解します.
\(\rm{2NaHCO_3\ →\ Na_2CO_3\ +\ CO_2\ +\ H_2O}\)




コメント