
- \(\rm{S^{2-}}\)の沈殿を基準として考える
- 各操作に対する徹底解説
- 沈殿から各金属イオンを分離する方法
を特にポイントとしています.昨日の自分より少しでもレベルアップしていきましょう!
系統分析の全体像
試料溶液中に未知の金属イオンが含まれている場合には,\(1\)つ\(1\)つのイオンを個々に確認することはできません.そこで試料に適切な試薬を加えることで,金属イオンを沈殿させることで,金属イオンを分離していきます.この一連の操作を系統分析といいます.
この分野で苦手な受験生が多いのは,操作方法が複雑でそれを単純に暗記しようとしているからです.ただ,そのやり方ではまったく意味がありません.このサイトを見てくれた方は,ぜひ\(1\)つ\(1\)つの操作の意味を理解してください.一見時間がかると思うかもしれませんが,理解こそが化学を習得する近道です!
それでは前おきはこれくらいにして系統分析の解説をしていきましょう.
まずは,系統分析で重要な沈殿の知識が必要です.沈殿に不安がある方は,こちらの記事を見てから読んでもらうと,より理解が深まると思います.

金属イオンのイオン化傾向が小さいということは,イオンではなく単体として存在したいということです.イオン化傾向の小さい金属イオンから分離してあげないと,一気に多くの金属イオンが沈殿してしまうことになります.そのため系統分析ではイオン化傾向の小さい金属イオンから少しずつ分離していきます.さらにこの分離については\(\rm{S^{2-}}\)の沈殿に着目して考えていくと非常にわかりやすくなります!これについては,各分離セクションで詳しく解説していきます!

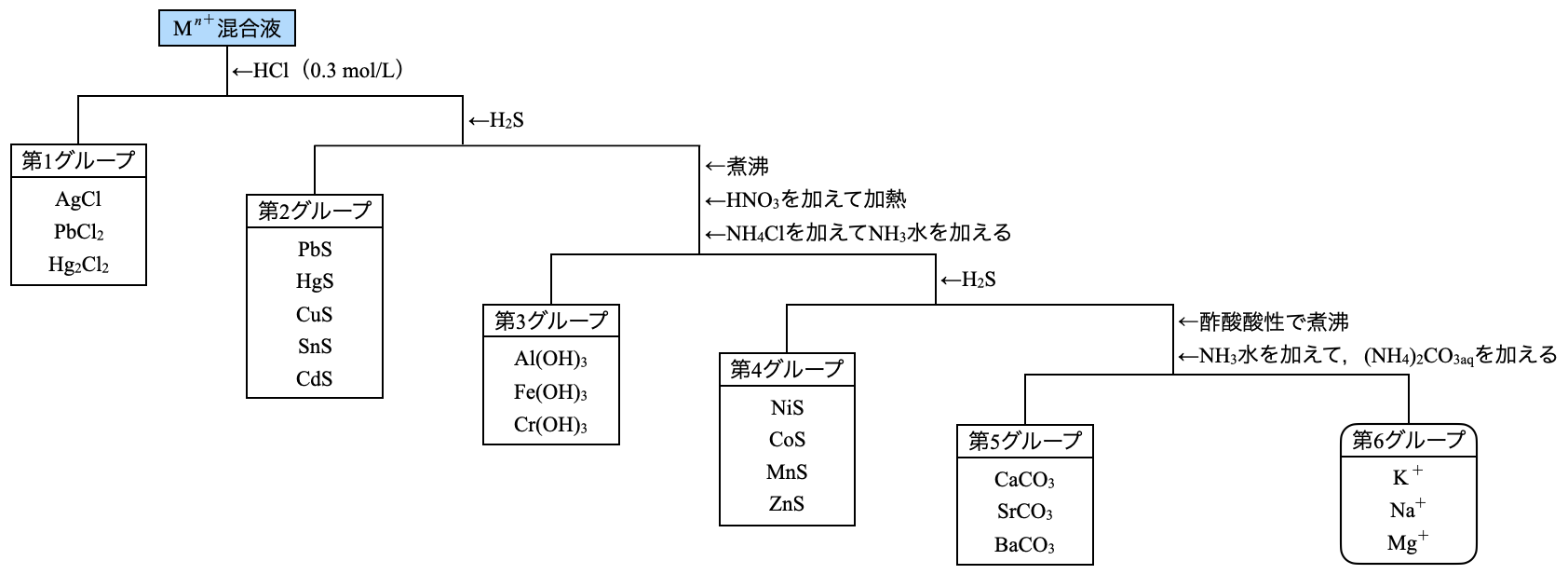
まずは全体像を下に示します.それぞれの操作やグループについては後ほど詳細に解説していきます.
酸性の\(\rm{S^{2-}}\)によって沈澱するグループ
先ほどの沈殿の表を見ると,\(\rm{Sn^{2+}}\)〜\(\rm{Ag^+}\)の範囲の金属イオンが酸性の\(\rm{S^{2-}}\)で沈殿を生じることがわかります.そのため第\(1\)グループは\(\rm{Sn^{2+}}\)〜\(\rm{Ag^+}\)の範囲の中で特別な金属イオンを沈殿させ,その残りを第\(2\)グループとして沈殿させます.
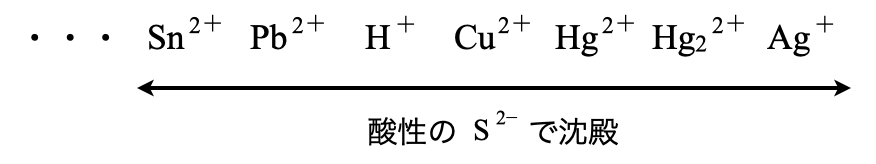
第\(1\)グループ\(\rm{:HCl}\)(\(\rm{0.3\ mol/L}\))を加える
まず第\(1\)グループとしてイオン化傾向の非常に小さい金属イオンを分離していきます.
\(\rm{Sn^{2+}}\)〜\(\rm{Ag^+}\)の範囲の金属イオンの中で特別な金属イオンとは,\(\rm{Pb^{2+}}\),\(\rm{{Hg_2}^{2+}}\),\(\rm{Ag^+}\)のことです.
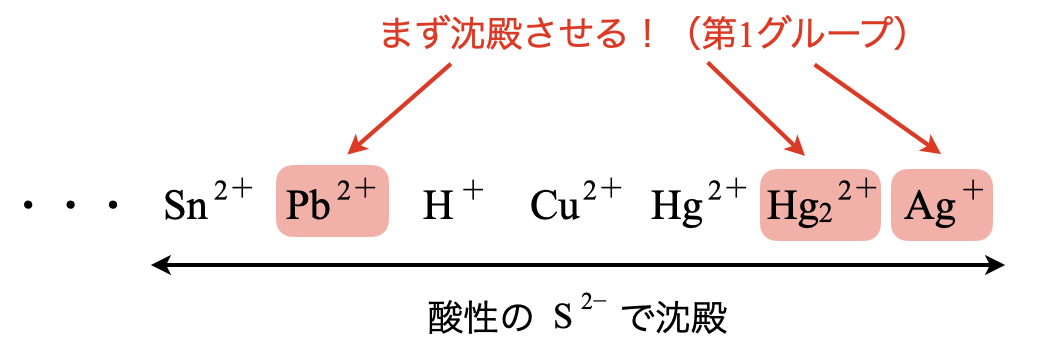
このために\(\rm{HCl}\)を加えます.第\(1\)グループを分離するには,\(\rm{0.3\ mol/L}\)である必要はありません.これは次の第\(2\)グループで必要となる操作です.
特別に沈殿させることができる金属イオンから分離していくのがコツであると説明しました.これはもし仮に\(\rm{S^{2-}}\)などで最初に沈殿させると,\(\rm{Sn^{2+}}\)〜\(\rm{Ag^+}\)までのすべての金属イオンを沈殿させてしまい,そこからさらに分離するのが大変という意味です.このように考えていくと,少しずつ系統分析の考え方が自分のものになっていくと思います!
第\(2\)グループ\(\rm{:H_2S}\)を通じる
第\(1\)グループの操作の後,溶液は\(\rm{[H^+] ≒ 0.3\ mol/L}\)の強酸となっています.ここに\(\rm{H_2S}\)を通じると,\(\rm{S^{2-}}\)の強酸となり沈殿が生じます.
残っている金属イオンで\(\rm{SnS}\),\(\rm{CuS}\),\(\rm{HgS}\),\(\rm{CdS}\)が沈殿します.この中で\(\rm{CdS}\)はカドミイエローといって,絵の具の顔良にも使われます.これは色で判断することができます.

補足として,第\(1\)グループにて分離した\(\rm{Pb^{2+}}\)ですが,完全に沈殿しきれなかったときは,\(\rm{PbS}\)として沈殿することがあります.頭に入れておきましょう!
中・塩基性の\(\rm{S^{2-}}\)によって沈殿するグループ
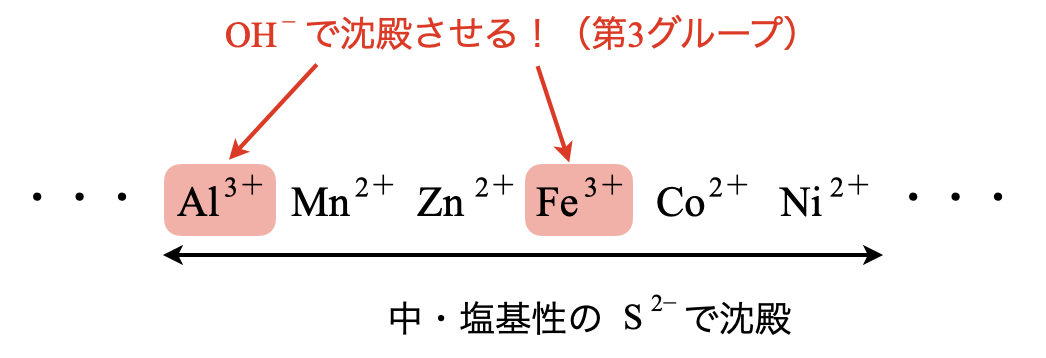
次は,中・塩基性の\(\rm{S^{2-}}\)による沈殿について考えます.これは沈殿の表を見ると,\(\rm{Al^{3+}}\)〜\(\rm{Ni^{2+}}\)の金属イオンが該当します.
第\(3\)グループは\(\rm{Al^{3+}}\)〜\(\rm{Ni^{2+}}\)の範囲の中で特別な金属イオンを沈殿させ,その残りを第\(4\)グループとして沈殿させます.

第\(3\)グループ\(\rm{:NH_3}\)を通じる
第\(3\)グループは\(\rm{OH^-}\)による沈殿を生成していきます.ここの操作がややこしいので,苦手な受験生が大量発生してしまうエリアになります.丁寧に解説していくので,ついてきてくださいね!
ここの処理として,煮沸する→\(\rm{HNO_3}\)を加えて加熱する→\(\rm{NH_4Cl}\)を加えるという\(3\)段階の処理があります.\(1\)つずつ見ていきましょう.
①煮沸する
先ほど第\(2\)グループで\(\rm{H_2S}\)を加えました.これを除去するために,煮沸します.もし煮沸をして\(\rm{H_2S}\)を除去しなければ,この後の第\(4\)グループの硫化物(\(\rm{ZnS}\)など)が一緒に沈殿してしまう恐れがあるためです.
テストで頻出の操作なので,その理由も含めて理解しておきましょう!
- なぜこのような操作をするのか?
- この操作が不十分な場合,どのような影響があるのか?
→\(\rm{H_2S}\)を除去するため.
→\(\rm{H_2S}\)が残存していると,次に\(\rm{NH_3}\)水を加えたときに,水酸化物の中に少量の\(\rm{ZnS}\)などが一緒に沈殿してしまう.
系統分析は\(\rm{S^{2-}}\)の沈殿によって区切っていくと解説しました.このように考えていくと,第\(2\)グループと第\(4\)グループで\(\rm{S^{2-}}\)の沈殿を作るので,第\(3\)グループでは\(\rm{S^{2-}}\)の沈殿が生成しないようにしなければいけないというわけです!そのための操作として,この「煮沸」があるのです.
②\(\rm{HNO_3}\)を加えて加熱する
第\(2\)グループで加えた\(\rm{H_2S}\)が還元剤として\(\rm{Fe^{3+}}\)が\(\rm{Fe^{2+}}\)になっています.そのため,酸化して\(\rm{Fe^{3+}}\)に戻す必要があります.
\(\rm{3Fe^{2+}\ +\ {NO_3}^-\ +\ 4H^+\ →\ 3Fe^{3+}\ +\ NO\ +\ 2H_2O}\)
この反応を進めるために,\(\rm{HNO_3}\)を加えます.
\(\rm{Fe^{2+}}\)のままではなく,\(\rm{Fe^{3+}}\)を用いるのにも理由があります.水への溶解度としては,\(\rm{Fe(OH)_2}\)よりも\(\rm{Fe(OH)_3}\)の方がずっと小さいので,鉄イオンを確実に沈殿させるには,\(\rm{Fe^{3+}}\)の方が適切であるというわけです.
③\(\rm{NH_4Cl}\)を加えて,\(\rm{NH_3}\)水を加える
\(\rm{NH_4Cl}\)に\(\rm{NH_3}\)を加えると,緩衝溶液になります.緩衝溶液の詳細についてはこちらの記事をご覧ください!

\(\rm{NH_3}\)水に\(\rm{{NH_4}^+}\)があると以下のような電離平衡が成り立ちます.
\(\rm{NH_3\ +\ H_2O\ ⇄\ {NH_4}^+\ +\ OH^-}\)
\(\rm{{NH_4}^+}\)によって,\(\rm{NH_3}\)を加えても平衡が左に移動して,溶液中の\(\rm{OH^-}\)は小さくなるように移動します.\(\rm{OH^-}\)が大きくなると(\(\rm{pH}\)が大きくなると),第\(4\)グループや第\(6\)グループの金属イオンも水酸化物として沈殿してしまいます.それを防ぐために,この操作を行います.
これらの一連の操作を行うことで,\(\rm{Al(OH)_3}\),\(\rm{Fe(OH)_3}\),\(\rm{Cr(OH)_3}\)を\(\rm{pH7}\)〜\(8\)程度の中性で沈殿させます.
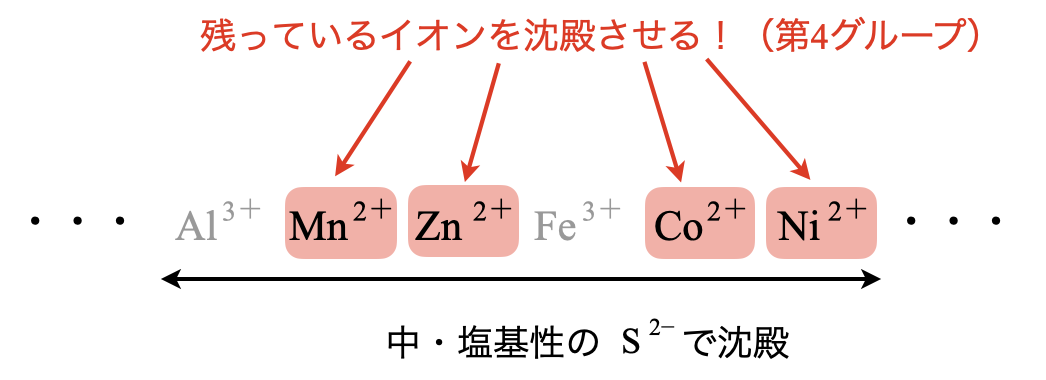
第\(4\)グループ\(\rm{:H_2S}\)を通じる
第\(3\)グループの最後で溶液の\(\rm{pH}\)は\(8\)程度になっています.ここに\(\rm{H_2S}\)を加えると\(\rm{Al^{3+}}\)〜\(\rm{Ni^{2+}}\)の範囲の残りの金属イオンを沈殿させることができます.その沈殿とは,\(\rm{MnS}\),\(\rm{ZnS}\),\(\rm{CoS}\),\(\rm{NiS}\)です.
\(\rm{S^{2-}}\)によって沈殿しないグループ
最後は,溶液の液性よらず\(\rm{S^{2-}}\)では沈殿しないグループです.これには\(\rm{K^+}\)〜\(\rm{Mg^{2+}}\)の金属イオンが該当します.
第\(5\)グループは\(\rm{K^+}\)〜\(\rm{Mg^{2+}}\)の範囲の中で特別な金属イオンを沈殿させ,その残りを第\(6\)グループとして沈殿させます.
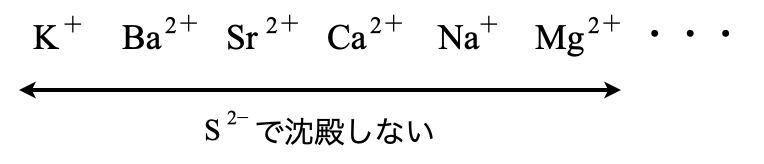
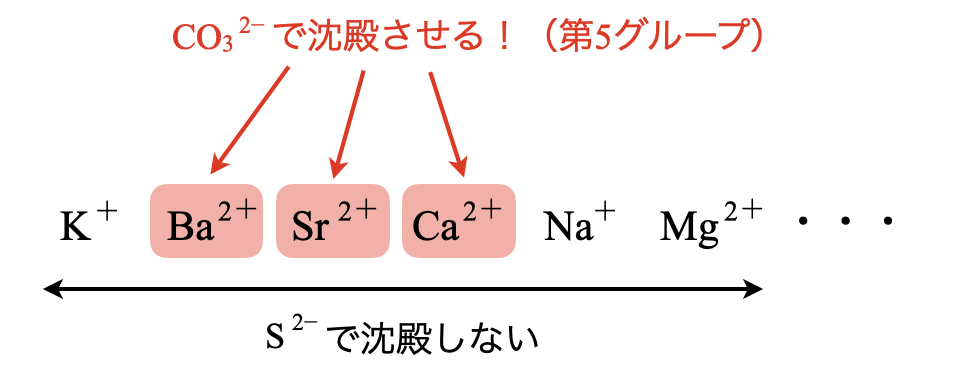
第\(5\)グループ\(\rm{:(NH_4)_2CO_{3aq}}\)を加える
溶液中には,\(\rm{K^+}\)〜\(\rm{Mg^{2+}}\)が残っています.これらから特別な金属イオンを分離するために,\(\rm{{CO_3}^{2-}}\)を使います.
この操作では,酢酸酸性で煮沸する→\(\rm{NH_3}\)水を加えて,\(\rm{(NH_4)_2CO_{3aq}}\)を加えるという\(2\)段階の処理があります.\(1\)つずつ見ていきましょう.
①酢酸酸性で煮沸する
酢酸を加えて加熱することで,\(\rm{H_2S}\)を追い出します.この操作は\(2\)回目になりますね!
②\(\rm{NH_3}\)水を加えて,\(\rm{(NH_4)_2CO_{3aq}}\)を加える
\(\rm{NH_3}\)水を加えて塩基性にした後,\(\rm{(NH_4)_2CO_3}\)水溶液を加えることで,特別な金属イオンのみを沈殿させることができます.その沈殿とは,\(\rm{CaCO_3}\),\(\rm{SrCO_3}\),\(\rm{BaCO_3}\)です.
\(\rm{{NH_4}^+}\)を溶液に加える理由は,\(\rm{MgCO_3}\)の沈殿を抑制するためです.詳しく解説していきましょう.
\(\rm{MgCO_3}\)の溶解度積を考えると,他の炭酸塩と比較して\(10^5\)倍程度大きいです.つまり, \(\rm{{CO_3}^{2-}}\)の濃度を小さく保っておくと,\(\rm{MgCO_3}\)の沈殿を生じずに済むということです.ここで,\(\rm{{NH_4}^+}\)を加えたときの溶液の平衡状態を考えてみましょう.
\(\rm{{NH_4}^+\ +\ {CO_3}^{2-}\ ⇄\ NH_3\ +\ {HCO_3}^-}\)
\(\rm{{NH_4}^+}\)を溶液中に共存させておくと,平衡を右へ移動させて\(\rm{{CO_3}^{2-}}\)の濃度を低く保つことができ,結果として\(\rm{MgCO_3}\)の沈殿を抑えることができるというわけです!
以上の操作で\(\rm{CaCO_3}\),\(\rm{SrCO_3}\),\(\rm{BaCO_3}\)の沈殿が生成します.
\(\rm{Ba^{2+}}\),\(\rm{Sr^{2+}}\),\(\rm{Ca^{2+}}\)を沈殿させる方法としては,\(\rm{{SO_4}^{2-}}\)という方法も考えられます.ただし,これらの硫酸塩では再溶解させる方法がなく,一緒に沈殿してしまえばそれらを分離することができます.そのため,分離できる方法として\(\rm{{CO_3}^{2-}}\)を使って沈殿にしています.
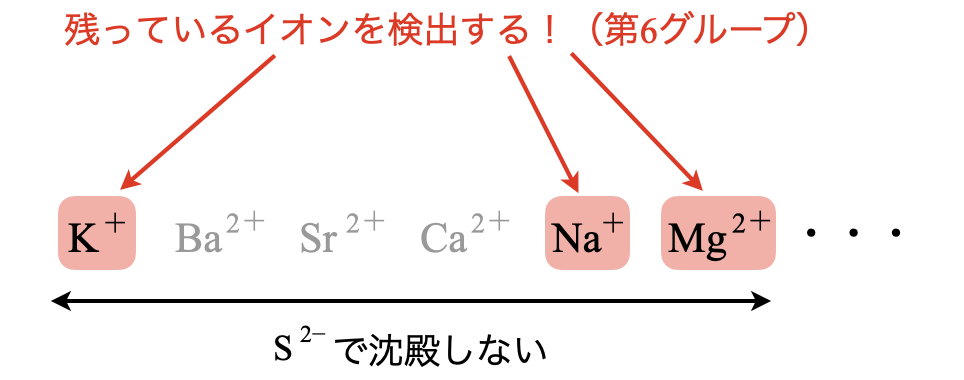
第\(6\)グループ\(:\)炎色反応
今までの操作によって,溶液中には\(\rm{K^+}\),\(\rm{Na^+}\),\(\rm{Mg^{2+}}\)のみが含まれています.
\(\rm{Mg^{2+}}\)は\(\rm{pH}\)を上げる(中・塩基性にする)ことで,\(\rm{MgCO_3}\)や\(\rm{Mg(OH)_2}\)としてかなり沈殿させることができます.また,\(\rm{K^+}\)と\(\rm{Na^+}\)は炎色反応で確認することができます.
ここまでかなり長い反応スケールでしたが,理解できたでしょうか?系統分析は全体が繋がっているので,理解もれがないようにしっかりと理解しておきましょう!
各グループ内の分離
さて,ここからはそれぞれのグループ内の金属イオンを分離する方法を解説していきます.
ここまで理解すれば受験で問われるほぼすべての金属イオンを分離することができるようになりますよ!
第\(1\)グループ
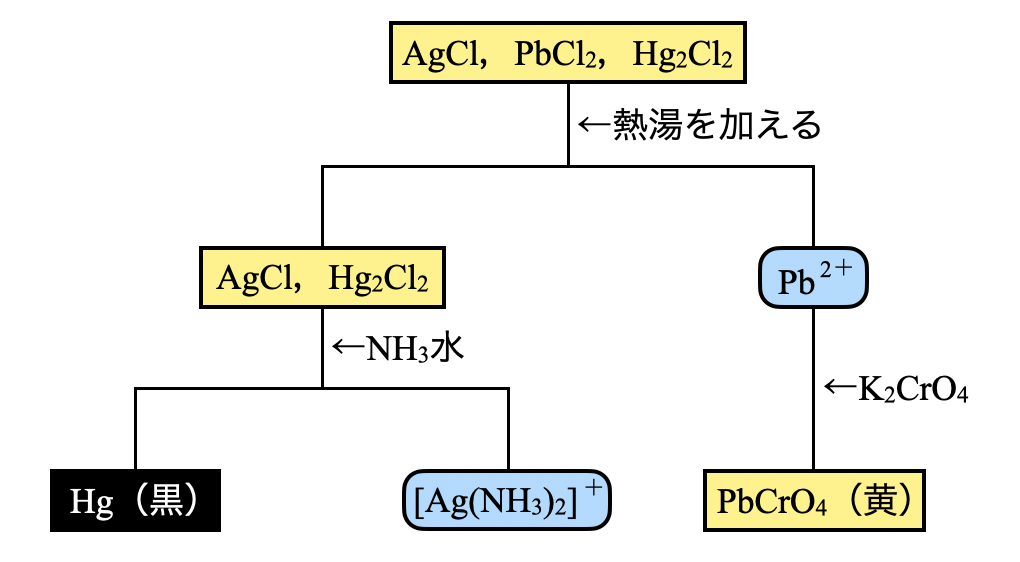
第\(1\)グループでは,\(\rm{AgCl}\),\(\rm{PbCl_2}\),\(\rm{Hg_2Cl_2}\)が沈殿しています.
まずは熱湯を加えることで,\(\rm{PbCl_2}\)を溶解していきます.これに\(\rm{{CrO_4}^{2-}}\)を加えることで黄色の沈殿が生じます.
\(\rm{Pb^{2+}\ +\ {CrO_4}^{2-}\ →\ PbCrO_4↓}\)
もう一方の溶液には\(\rm{AgCl}\),\(\rm{Hg_2Cl_2}\)が沈殿しています.これに\(\rm{NH_3}\)水を加えることで,\(\rm{Hg}\)は黒色沈殿します.一方で\(\rm{AgCl}\)は溶解して,\(\rm{[Ag(NH_3)_2]^+}\)となります.
第\(2\)グループ
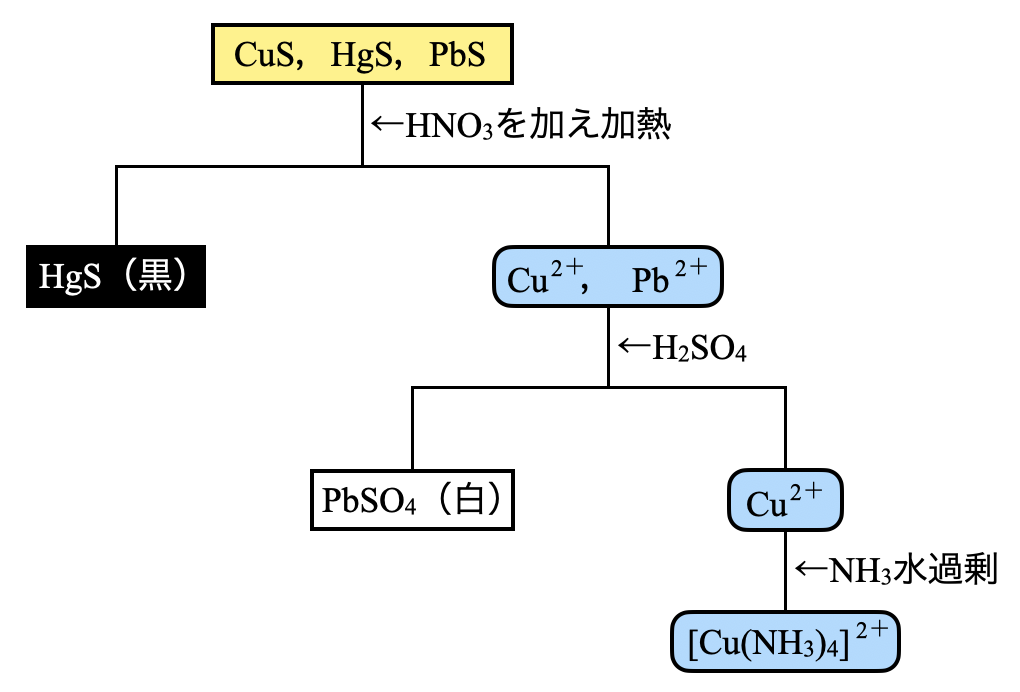
第\(2\)グループでは,\(\rm{CuS}\),\(\rm{HgS}\),\(\rm{PbS}\)が沈殿しています.
\(\rm{HgS}\)は溶解度積が極めて小さいので,王水にしか溶解しません.そのため,この溶液に\(\rm{HNO_3}\)を加えて熱しても\(\rm{HgS}\)のみ溶解しません.
一方で,\(\rm{CuS}\),\(\rm{PbS}\)は溶解します.\(\rm{Cu^{2+}}\),\(\rm{Pb^{2+}}\)に\(\rm{H_2SO_4}\)を加えると,\(\rm{Pb^{2+}}\)が\(\rm{PbSO_4}\)として沈殿します.\(\rm{Cu^{2+}}\)は沈殿せず,\(\rm{NH_3}\)水を過剰に加えることで,\(\rm{[Cu(NH_3)_4]^{2+}}\)が生じ,深青となって\(\rm{Cu^{2+}}\)の存在を確認することができます.
第\(3\)グループ
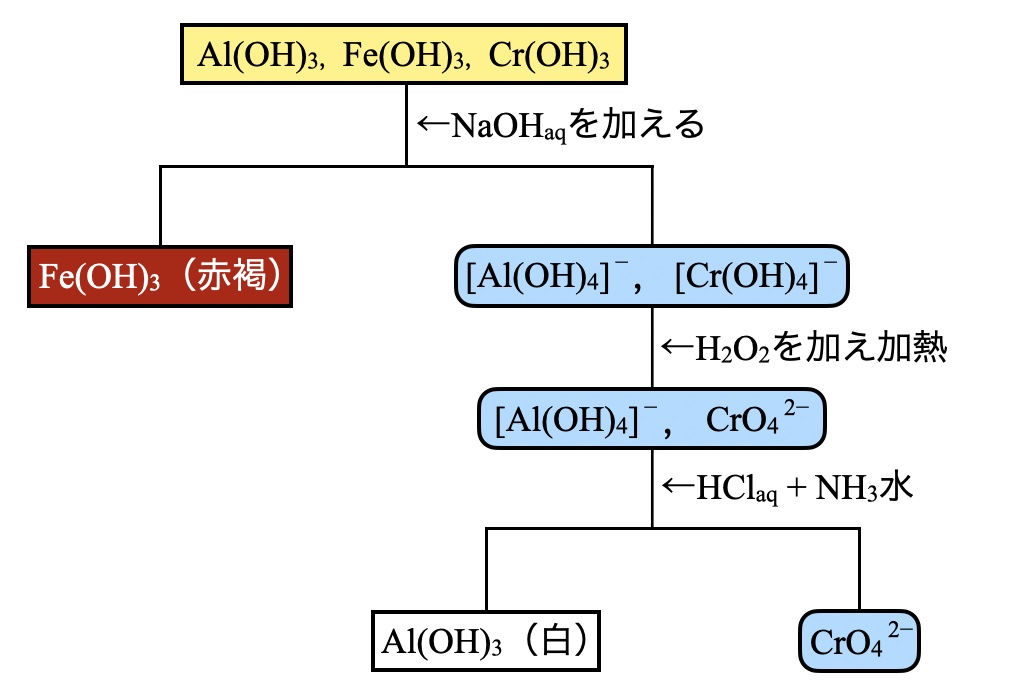
第\(3\)グループでは,\(\rm{Al(OH)_3}\),\(\rm{Fe(OH)_3}\),\(\rm{Cr(OH)_3}\)が沈殿しています.沈殿が白色であれば\(\rm{Al(OH)_3}\)と判断することができます.
この溶液に\(\rm{NaOH_{aq}}\)を加えると過剰の\(\rm{OH^-}\)によって,両性水酸化物の\(\rm{Al(OH)_3}\)と\(\rm{Cr(OH)_3}\)は溶解するが,\(\rm{Fe(OH)_3}\)は溶解せず,赤褐の沈殿が生じます.
過剰な\(\rm{OH^-}\)によって水酸化物となった\(\rm{[Cr(OH)_4]^-}\)に\(\rm{H_2O_2}\)(酸化剤)を加えることで,\(\rm{{CrO_4}^{2-}}\)まで酸化されます.
\(\rm{2[Cr(OH)_4]^-\ +\ 3H_2O_2\ +\ 2OH^-\ ⇄\ 2{CrO_4}^{2-}\ +\ 8H_2O}\)
この溶液に\(\rm{HCl_{aq}}\)を加えて\(\rm{AlCl_3}\)にした後,\(\rm{NH_3}\)水を加えると,\(\rm{Al(OH)_3}\)として白色沈殿が生じると,\(\rm{Al^{3+}}\)の存在を確認することができます.また,\(\rm{Pb^{2+}}\)を加えて黄色沈殿が生じると,\(\rm{{CrO_4}^{2-}}\)または\(\rm{{Cr_2O_7}^{2-}}\)の存在を確認することができます.
第\(4\)グループ
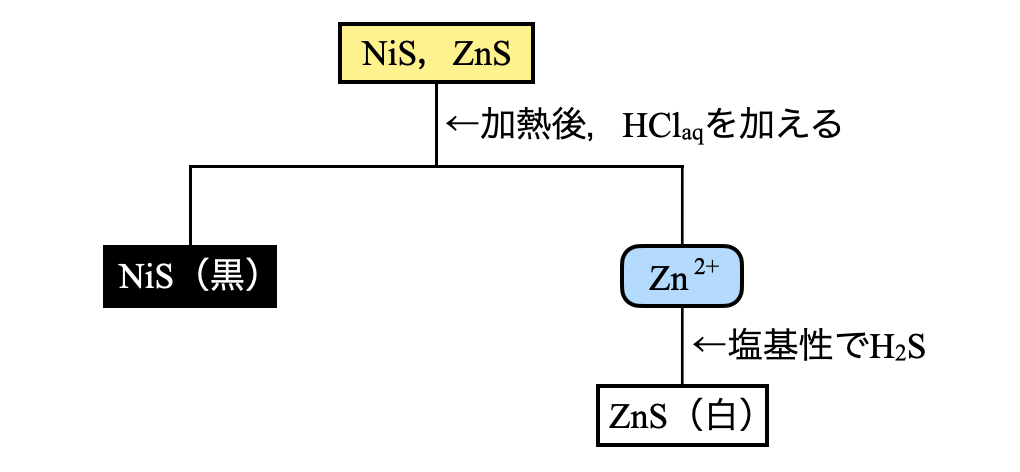
第\(4\)グループでは,\(\rm{NiS}\),\(\rm{ZnS}\)が沈殿しています.加熱して\(\rm{HCl_{aq}}\)を加えても\(\rm{NiS}\)は不溶です.溶解した\(\rm{Zn^{2+}}\)に塩基性で\(\rm{H_2S}\)を加えると,\(\rm{ZnS}\)の白色沈殿が生じます.
第\(5\)グループ
第\(5\)グループでは,\(\rm{CaCO_3}\),\(\rm{SrCO_3}\),\(\rm{BaCO_3}\)が沈殿しています.酸性にして\(\rm{K_2CrO_{4aq}}\)を加えると,\(\rm{BaCrO_4}\)の黄色沈殿が生じます.
残った金属イオンに関しては,炎色反応によって,\(\rm{Ca^{2+}}\)なら橙赤,\(\rm{Sr^{2+}}\)なら赤となります.
第\(6\)グループ
\(\rm{K^+}\)と\(\rm{Na^+}\)についても炎色反応によって確認することができます.\(\rm{Na}\)なら黄,\(\rm{K}\)なら赤紫となります.
今回はここまでとなります.系統分析はわかりにくいという方が多いと思うので,なるべくわかりやすく順序立てて解説しました!この記事を読んで,疑問が出てきた方はぜひコメントしてください!それによってさらに理解を深めていきましょう!
また系統分析を理解するには,無機化学の全ての知識が含まれています.以下に無機化学の記事をまとめていますので,ぜひそちらの方もどうぞ!




コメント