
- 沈殿反応を\(1\)つの図にまとめて解説
- 沈殿の色も攻略
を特にポイントとしています.昨日の自分より少しでもレベルアップしていきましょう!
沈殿反応のまとめ
沈殿反応は,水に難溶な陽イオン,陰イオンペアが生じたときに起こります.そのため,沈殿が生じるかどうかは,そのペアを覚えさえすればよいことがわかります.ただ,すべてのペアを覚えるのは現実的ではありませんよね…笑
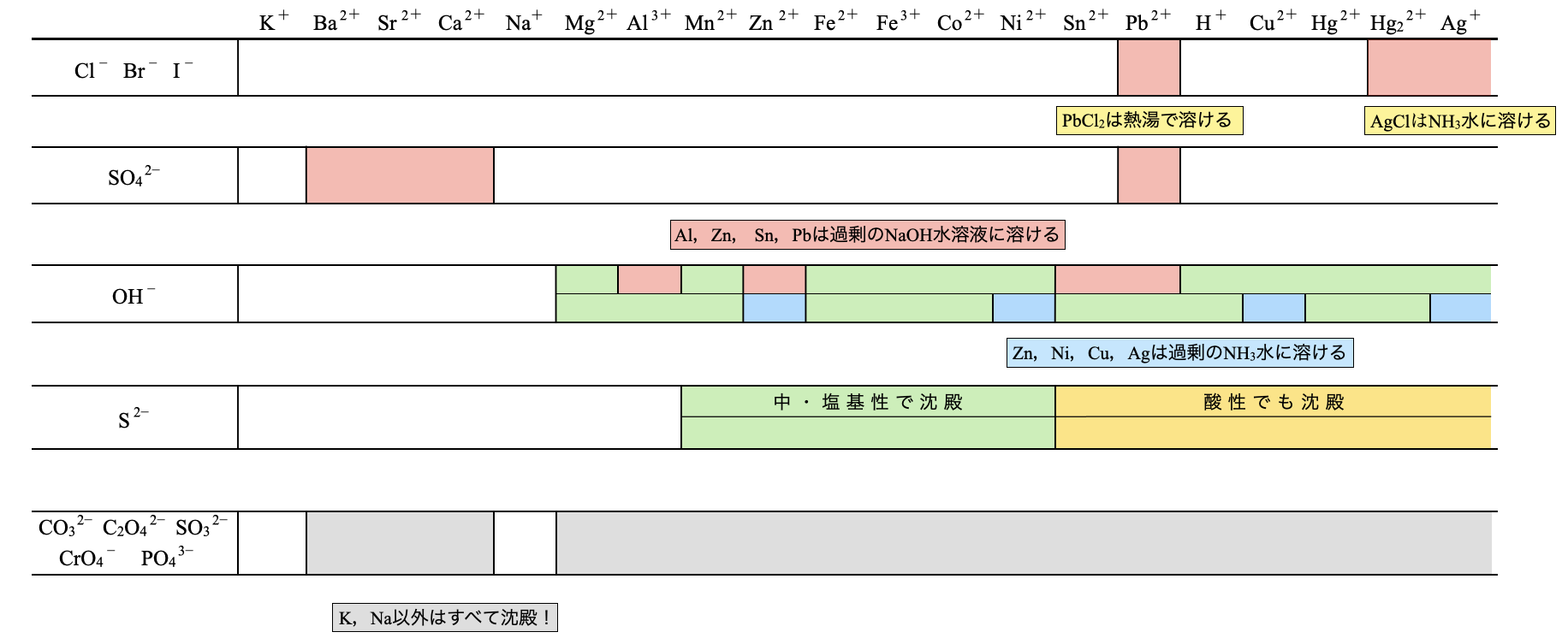
そこで下のように沈殿反応をまとめました.イオン化傾向の表を活用していくことで,効率よく暗記することがでます!この表を覚えてもらうだけでテストで満点を取ることができるので,これを見ながら1つずつ解説していきます!
\(\rm{Cl^-}\),\(\rm{Br^-}\),\(\rm{I^-}\)
\(\rm{Cl^-}\),\(\rm{Br^-}\),\(\rm{I^-}\)は基本的には溶解しますが,例外として以下の\(3\)つのイオンを覚えてください!
\(\rm{Ag^+}\)・\(\rm{{Hg_2}^{2+}}\)・\(\rm{Pb^{2+}}\)は\(\rm{Cl^-}\),\(\rm{Br^-}\),\(\rm{I^-}\)で沈殿する.
\(\rm{F^-}\)だけは別行動なので気をつけてくださいね!
ここで,追加の情報として覚えてほしいのが,\(\rm{PbCl_2}\)と\(\rm{AgCl}\)です.
- \(\rm{PbCl_2:}\)熱湯で溶ける
- \(\rm{AgCl:NH_3}\)水に溶ける
\(\rm{{SO_4}^{2-}}\)
\(\rm{{SO_4}^{2-}}\)も基本的には溶解しますが,例外として以下の\(4\)つのイオンを覚えてください!
\(\rm{Ba^{2+}}\)・\(\rm{Sr^{2+}}\)・\(\rm{Ca^{2+}}\)・\(\rm{Pb^{2+}}\)は\(\rm{{SO_4}^{2-}}\)で沈殿する.
これらの沈殿の色はすべて白です!
\(\rm{OH^-}\)
ここからは若干複雑になるので,しっかりとついてきてくださいね!
基本的に\(\rm{OH^-}\)は水に溶けにくいものが多いです.その始まりは\(\rm{Mg^{2+}}\)からと覚えましょう!そしてイオン化傾向が小さくなると沈殿が生じます.
\(\rm{Mg^{2+}}\)以下では沈殿する.
例外として水酸化物の溶解性を覚えておきましょう!
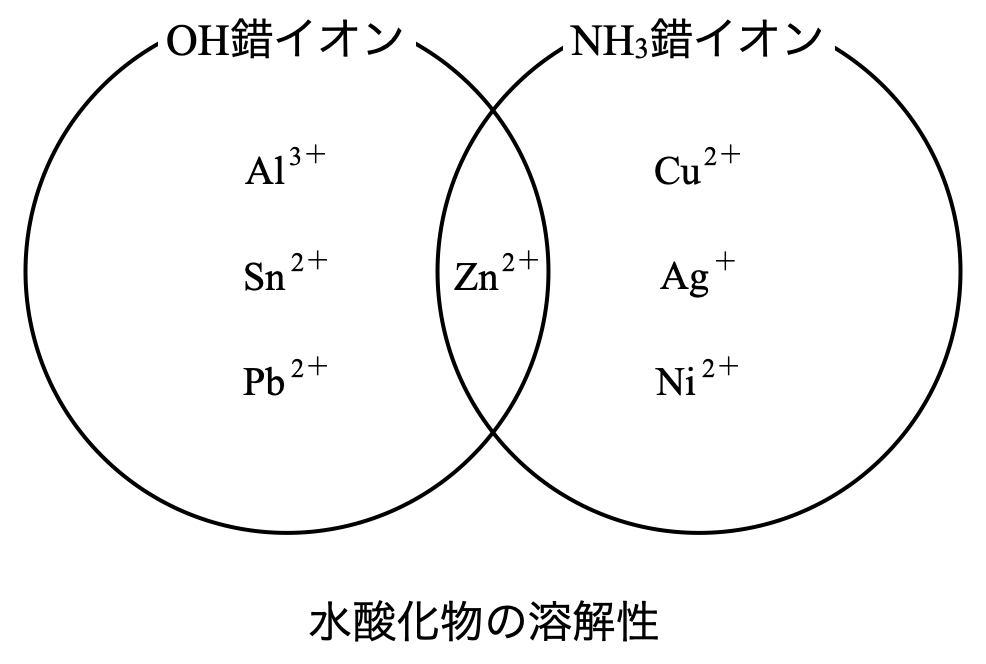
過剰の\(\rm{NaOH_{aq}}\)を加えると両性元素(\(\rm{Al}\),\(\rm{Zn}\),\(\rm{Sn}\),\(\rm{Pb}\))の水酸化物は溶解します.また水酸化物に\(\rm{NH_3}\)水を加えると,\(\rm{Zn}\),\(\rm{Ni}\),\(\rm{Cu}\),\(\rm{Ag}\)の水酸化物は溶解します.ベン図を使うと下のようになります.
\(\rm{S^{2-}}\)
\(\rm{S^{2-}}\)も基本的には水に溶けにくいものが多いです.
ただ溶液の液性によって変化します.\(\rm{Mn^{2+}}\) 〜 \(\rm{Ni^{2+}}\)までは中・塩基性で沈殿します.一方で,\(\rm{Sn^{2+}}\) 〜 \(\rm{Ag^+}\)では酸性でも沈殿が生じます.
- \(\rm{Mn^{2+}}\) 〜 \(\rm{Ni^{2+}}\)→中・塩基性で沈殿
- \(\rm{Sn^{2+}}\) 〜 \(\rm{Ag^+}\)→酸性でも沈殿
例外もおさえておきましょう!
\(\rm{Al^{3+}}\)に\(\rm{S^{2-}}\)を加えると,\(\rm{Al_2S_3}\)が生成すると思ってしまいますが,\(\rm{Al_2S_3}\)は生成しません.これは\(\rm{Al_2S_3}\)が加水分解して\(\rm{Al(OH)_3}\)の白色沈殿が生じるためです.
\(\rm{Al_2S_3\ +\ 6H_2O\ ⇄\ 2Al(OH)_3↓\ +\ 3H_2S}\)
\(\rm{Al(OH)_3}\)に過剰の\(\rm{S^{2-}}\)を加えると,溶液の塩基性が強くなるため,\(\rm{Al(OH)_3→[Al(OH)_4]^-}\)として溶解します.このことに注意しましょう!
硫化物の沈殿の色は,基本的に黒です.例外については下で紹介しますので,しっかりと覚えておきましょう.
酸素酸由来の陰イオン
酸素酸と書きましたが,簡単にいうと次のような物質です.
\(\rm{{CO_3}^{2-}}\)・\(\rm{{C_2O_4}^{2-}}\)・\(\rm{{SO_3}^{2-}}\)・\(\rm{{CrO_4}^{2-}}\)・\(\rm{{PO_4}^{3-}}\)
これらの物質は基本的に沈殿が生じます.
\(\rm{Na^+}\)と\(\rm{K^+}\)のみ沈殿しないので,その点を覚えておきましょう!
沈殿の色
沈殿や錯イオンなどの問題を解くときには,それらの色の情報が与えられていることが多いです.それぞれの物質に関して,色の系統というのが決まっています.基本をおさえた上で,例外を覚えていくと早く定着させることができますよ!
まずは周期表を書いて,どこにある物質が有色・無色であるかを覚えましょう.ここでは大枠を捉えるようなイメージです!

\(1\)族・\(2\)族に関しては例外なく無色です.
そして,\(3\)族〜\(10\)族は有色となります.\(\rm{Cu^{2+}}\)が青系統,\(\rm{Fe^{2+}}\)が淡緑系統,\(\rm{Fe^{3+}}\)が黄〜褐系統となります.
最後に\(11\)族〜\(14\)族では錯イオンは例外なく無色ですが,沈殿では例外的に有色のものもあります.これについてはまとめて覚えてしまいましょう!
例外的な有色まとめ
まず\(11\)族〜\(14\)族の例外的な有色沈殿について覚えていきましょう.
\(11\)族:\(\rm{Cu_2O}\):赤,\(\rm{AgBr}\):淡黄,\(\rm{AgI}\):黄,\(\rm{Ag_2O}\):黒
\(12\)族:\(\rm{CdS}\):黄,\(\rm{HgS}\):黒,\(\rm{HgO}\):黄
\(14\)族:\(\rm{SnS}\):褐,\(\rm{PbS}\):黒
次に,水酸化物の沈殿の色をまとめていきます.水酸化物はカラフルなので,覚えにくいと思いますが,頑張っていきましょう.
\(6\)族:\(\rm{Cr(OH)_3}\):緑
\(8\)族:\(\rm{Fe(OH)_2}\):緑白,\(\rm{Fe(OH)_3}\):赤褐
\(10\)族:\(\rm{Ni(OH)_2}\):緑
\(11\)族:\(\rm{Cu(OH)_2}\):青白
練習問題
実際に練習問題を解いていきながら,理解を深めていきましょう!
各物質同士で沈殿が生じるかを判定していきましょう.
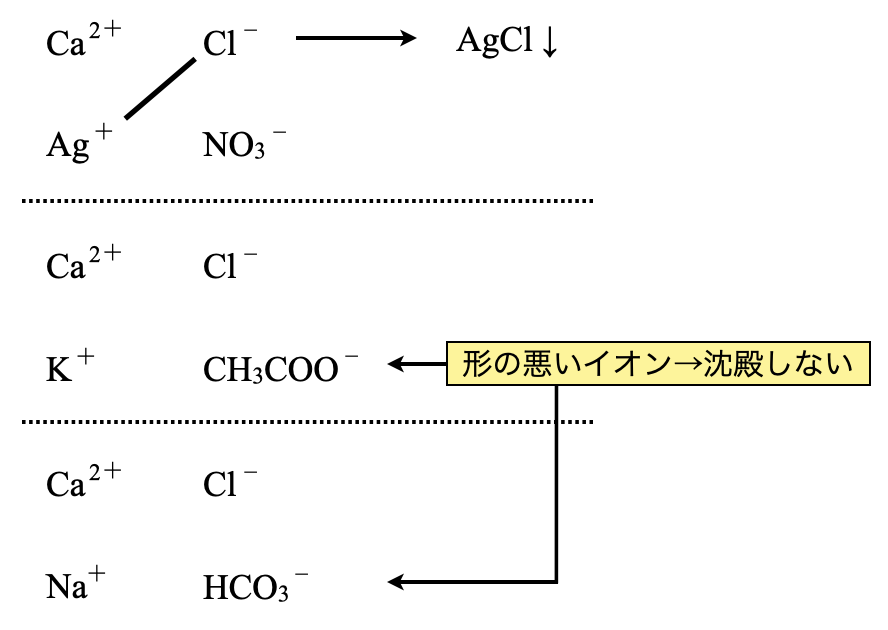
(\(1\))\(\rm{CaCl_2:AgNO_3}\),\(\rm{CH_3COOK}\),\(\rm{NaHCO_3}\)
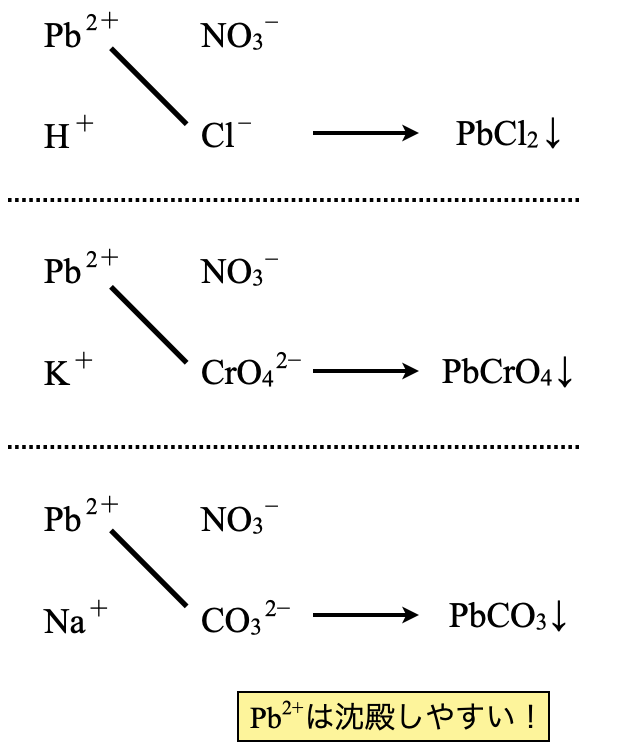
(\(2\))\(\rm{Pb(NO_3)_2:HCl}\),\(\rm{K_2CrO_4}\),\(\rm{Na_2CO_3}\)
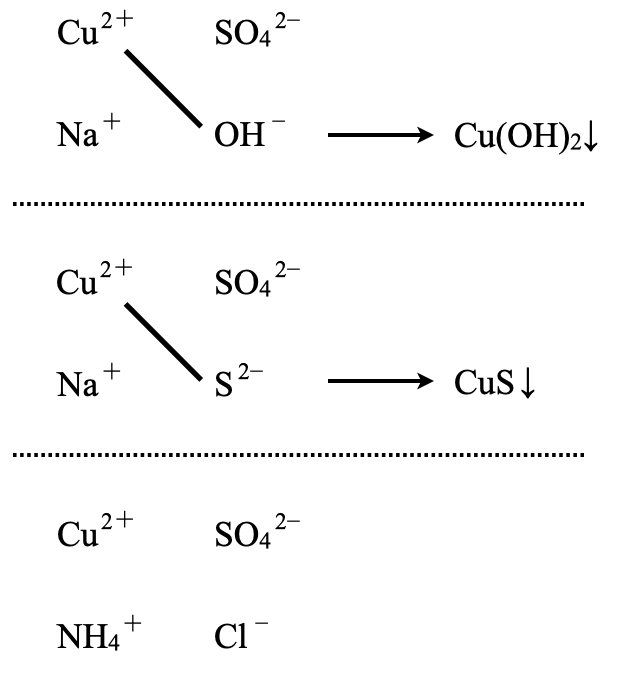
(\(3\))\(\rm{CuSO_4:NaOH}\),\(\rm{Na_2S}\),\(\rm{NH_4Cl}\)
沈殿を考えるときには,各物質を陽イオン,陰イオンに分解して沈殿が生成する組み合わせを見つけていきます.
(\(1\))
\(\rm{Ag^+}\)と\(\rm{Cl^-}\)で沈殿が生じます.\(\rm{CH_3COO^-}\)や\(\rm{{HCO_3}^-}\)は形が悪いイオンなので,沈殿は生じません.形が悪いイオンは,結晶の安定性が悪いため,水によく溶けます.
(\(2\))
\(\rm{Pb^{2+}}\)はかなり沈殿が生じやすい陽イオンです.\(\rm{Pb^{2+}}\)とこれらの陰イオンではすべて沈殿が生じます.最初の図で確認しておきましょう!
(\(3\))
\(\rm{OH^-}\)はイオン化傾向で\(\rm{Mg^{2+}}\)以降について沈殿が生じます.\(\rm{S^{2-}}\)はイオン化傾向で\(\rm{Mn^{2+}}\)以降については沈殿が生じます.
次は沈殿の色についての問題です.この問題も繰り返し見直すことで,満点を取れるようにしていきましょう.
それぞれの沈殿の色は?
(\(1\))\(\rm{Ag_2O}\),\(\rm{AgBr}\),\(\rm{AgI}\)
(\(2\))\(\rm{Zn(OH)_2}\),\(\rm{Al(OH)_3}\)
(\(3\))\(\rm{Cu(OH)_2}\),\(\rm{CuO}\),\(\rm{Cu_2O}\)
(\(4\))\(\rm{Fe(OH)_2}\),\(\rm{FeO}\),\(\rm{Fe(OH)_3}\),\(\rm{Fe_2O_3}\)
(\(5\))\(\rm{Cr(OH)_3}\),\(\rm{MnO_2}\)
(\(6\))\(\rm{MnS}\),\(\rm{ZnS}\),\(\rm{SnS}\),\(\rm{CdS}\)
(\(1\))
\(\rm{Ag}\)の沈殿は例外的に有色でした.
\(\rm{Ag_2O}:\)黒,\(\rm{AgBr:}\)淡黄,\(\rm{AgI:}\)黄です.
しっかりと覚えておきましょう.
(\(2\))
\(\rm{OH^-}\)の沈殿で例外でないものは白色になります.よって,\(\rm{Zn(OH)_2}\),\(\rm{Al(OH)_3}\)はともに白色です.
(\(3\))
\(\rm{Cu}\)については,まず\(1\)価と\(2\)価でしっかりと区別して考えましょう.
\(1\)価については基本的に無色です.ただこれはイオンについてで,沈殿には例外があります.\(\rm{Cu_2O:}\)赤です.
\(2\)価については青系統です.そのため,青系統の沈殿である\(\rm{Cu(OH)_2}\)は青白です.例外として,\(\rm{CuO}\),\(\rm{CuS}\)は黒なので注意しましょう.
(\(4\))
\(\rm{Fe}\)についても,\(2\)価と\(3\)価を区別して考えます.
\(2\)価(\(\rm{Fe^{2+}}\))については,淡緑系統です.
\(\rm{Fe(OH)_2:}\)緑白,\(\rm{FeO:}\)黒
\(3\)価(\(\rm{Fe^{3+}}\))については,黄〜褐系統です.
\(\rm{Fe(OH)_3}\),\(\rm{Fe_2O_3}\)はともに褐です.
(\(5\))
\(\rm{Cr}\)の\(3\)価は緑系統です.法則通り,\(\rm{Cr(OH)_3:}\)緑です.
\(\rm{Mn}\)は赤系統ですが,\(\rm{MnO_2}\)は例外で黒です.しっかりと覚えておいてくださいね!
(\(6\))
硫化物の沈殿の基本は黒です.以下の物質は例外ですので,覚えておきましょう.
\(\rm{MnS:}\)淡紅,\(\rm{ZnS:}\)白,\(\rm{SnS:}\)褐,\(\rm{CdS:}\)黄
今回はここまでとなります.沈殿については,たまにテストで問われるのでこの際しっかりと覚えてしまいましょう!



コメント