今回のメニューです!
✅同素体(SCOP)
この記事を読むことで、混同しがちな同素体と同位体の違いを完全に理解できます!
また同素体のそれぞれについてもしっかりと解説していくので、ぜひ最後までご覧ください。
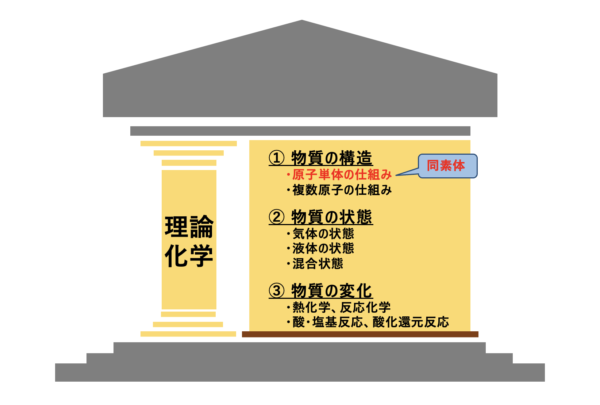
理論化学の中での同素体のポジションを確認しておきましょう。
同素体は、「物質の構造」の中の「原子の構造」に関する項目です。
原子の並び方が異なるもの同士を同素体といいます。
同素体とは?
同素体とは、同じ元素で構成された単体の中で、その並び方が異なるもの同士のことです。
並び方が異なるので、それぞれの化学的性質が異なります。
同じ元素で構成された単体なので、同素体と呼ばれるわけです。
同素体と同位体の違い
同素体を学習するとき、似たような用語に同位体があります。
混乱するので、違いを下の表にまとめました。
| 同素体 | ・同じ元素からなる単体同士のこと。 ・化学的性質が異なる物質同士のこと。 |
| 同位体 | ・原子核中の中性子数が異なる元素同士のこと。 ・化学的性質にはあまり違いはない。 |
同位体については別の記事で詳細に解説するので、今回の記事では同素体をしっかりと理解していきましょう。
同素体はSCOPで覚える
同素体とは、同じ元素で構成された単体の中で、その並び方が異なるもの同士のことでした。
それでは、それぞれの種類を覚えていきましょう。
「同素体って種類が多くて覚えるのが大変そう、、、」と思うかもしれませんが、そんなことありません。
入試で覚えておくべき同素体は、
「スコップ(SCOP)」で覚えることができます。
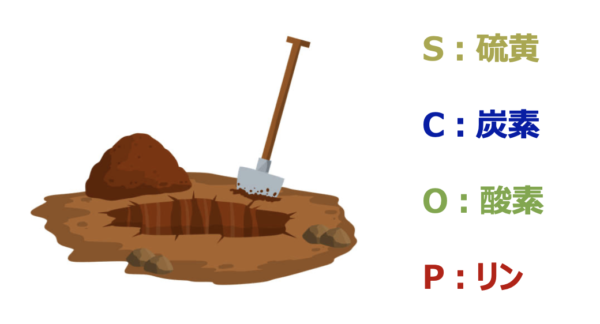
それでは順に解説していきます。
S(硫黄)
\(\rm{S}\)(硫黄)の同素体には、斜方硫黄・単斜硫黄・ゴム状硫黄の\(3\)種類があります。
| 単体名 | 化学式 | 色 | 性質 |
|---|---|---|---|
| 斜方硫黄 | \(\rm{S_8}\)(環状分子) | 黄色 | 常温で最も安定 |
| 単斜硫黄 | \(\rm{S_8}\)(環状分子) | 黄色 | 放置で斜方硫黄になる |
| ゴム状硫黄 | \(\rm{S_8}\)(鎖状分子) | 黄色 | 放置で斜方硫黄になる |
これらの関係を図にすると、下のようになります。
覚えるときには、図で覚える方が記憶にも残りやすいので、ぜひこの図をそのまま覚えてくださいね!
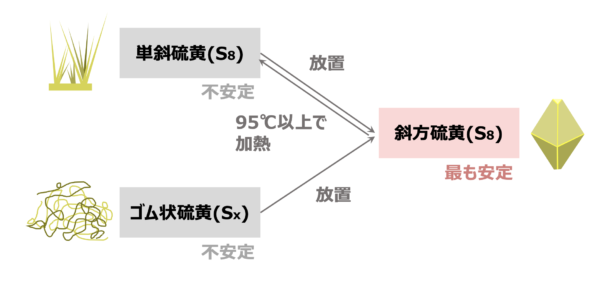
常温・常圧下では斜方硫黄が最も安定しています。
そのため不安定な単斜硫黄やゴム状硫黄は、放置すると安定した斜方硫黄へと変化します。
より安定方向へ移動するというわけです。
ただ安定な斜方硫黄ですが、\(\rm{95^\circ C}\)以上に加熱すると不安定な単斜硫黄に変化します。
またゴム状硫黄には結晶構造がなく、\(\rm{S}\)(硫黄)が連続的につながった高分子です。
斜方硫黄と単斜硫黄について結晶構造を聞かれることがあるので、しっかりと覚えておきましょう。
・単斜硫黄:針状結晶
C(炭素)
\(\rm{C}\)(炭素)の同素体には、黒鉛・ダイヤモンド・フラーレンなどがあります。
| 単体名 | 化学式 | 構造 | 性質 |
|---|---|---|---|
| 黒鉛 | \(\rm{C}\) | 二次元構造が分子間力で結合 | ・電気伝導性あり ・金属光沢あり |
| ダイヤモンド | \(\rm{C}\) | 正四面体構造でできた三次元構造 | ・熱伝導性が非常に高い ・光の屈折率が非常に大きい ・融点約3500℃で単体中最高 |
| フラーレン | \(\rm{C_{60}}\) | 炭素原子がサッカーボール型に結合 | 現在、研究中 |
それぞれについて簡単に解説します。
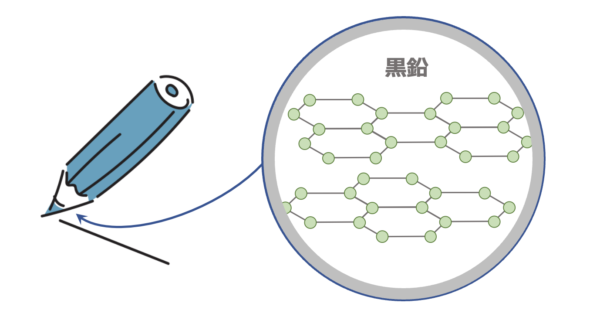
黒鉛
黒鉛は鉛筆の芯です。
炭素原子には価電子が\(4\)つありますが、下の構造を見るとわかるように価電子\(3\)つで結合しています。
つまり、電子が\(1\)つ残っていて、まわりを自由に移動しています。
これを自由電子と呼びます。
黒鉛は層状の構造のため、一方向にはがれやすい構造となっています。
また自由電子があるので、電気伝導性や金属光沢があります。
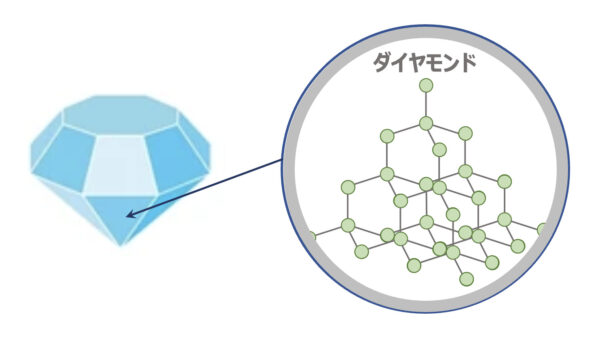
ダイヤモンド
ダイヤモンドは下のような正四面体状の構造をしています。
この構造を見ると、\(1\)つの炭素原子が\(4\)つの炭素原子と結合しているので、非常に硬いという性質があります。
またダイヤモンドには自由電子がないので(\(4\)つの価電子がそれぞれ炭素と結合しているので)、電気は通しません。
O(酸素)
\(\rm{O}\)(酸素)の同素体には、酸素\(\rm{O_2}\)、オゾン\(\rm{O_3}\)があります。
| 単体名 | 化学式 | 色 | 臭い | 性質 |
|---|---|---|---|---|
| 酸素 | \(\rm{O_2}\) | 無色 | 無臭 | 助燃性あり |
| オゾン | \(\rm{O_3}\) | 淡青色 | 特異臭 | 紫外線吸収効果あり |
酸素
酸素は説明不要だと思いますが、ひと言だけ。
酸素には、助燃性があります。
助燃性とは、燃焼を促進する性質を意味します。
今後の化学反応で様々な化学反応が出てくるので、一つずつ理解していきましょう。
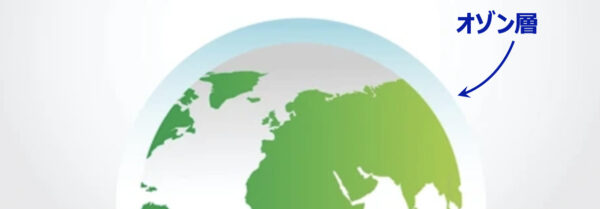
オゾン
オゾンはオゾン層で有名です。
オゾン層は紫外線を吸収する性質があるので、これで覚えてしまいましょう!
P(リン)
\(\rm{P}\)の同素体には、黄リン・赤リンがあります。
ここはテスト頻出の物質なので、細かい性質までしっかりと理解しておきましょう。
| 単体名 | 化学式 | 色 | 構造 | 毒性 | 性質 |
|---|---|---|---|---|---|
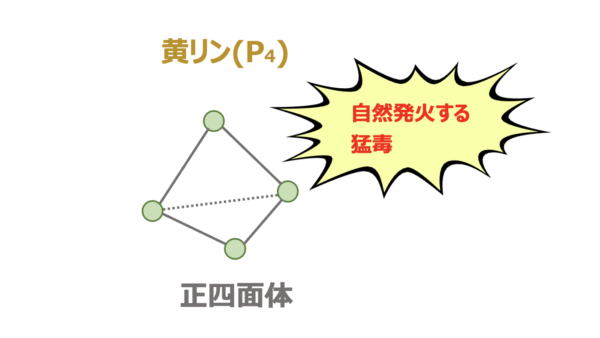
| 黄リン | \(\rm{P_4}\) | 黄色 | 正四面体 | あり | ・自然発火する ・水中に保存する |
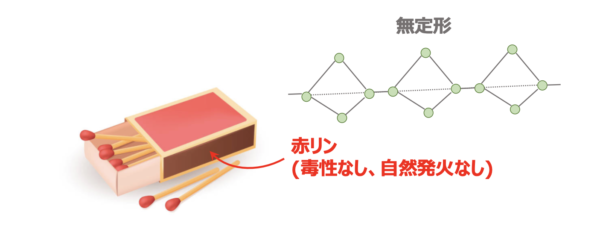
| 赤リン | \(\rm{P}\) | 赤色 | 無定形 | なし | ・マッチ箱の側面 |
黄リン
黄リンは\(\rm{P}\)が正四面体状につながった分子で、構造が不安定なので\(\rm{60^\circ C}\)程度で自然発火します。
加えて猛毒です。
そのため、水中で保存します。
(水中に保存することで、空気中の酸素と触れず、自然発火しません!)
赤リン
赤リンは黄リンが次々とつながったような分子で、分子量が大きく、不定形です。
また日常生活でもよく目にしていて、マッチ箱の横についているのが、赤リンです。
これは普通に戸棚に入れていても危なくないですよね。
なので、赤リンは毒性もなく、自然発火もしません。
今回の記事で覚えること
今回の記事では、まず同素体と同位体の違いをしっかりと理解してください。
そして同素体の問題では、まず「\(\rm{S}\)(硫黄)・\(\rm{C}\)(炭素)・\(\rm{O}\)(酸素)・\(\rm{P}\)(リン)」と言えるようになりましょう!
あとは、それぞれの元素の性質を1つずつ覚えておきましょう。
紛らわしい問題が出ることがよくあるので、記事の中のヒントをもとに少しずつ覚えていきましょう!



コメント