
大問\(1\)の総評
こんにちは,KUTです.
本記事では,\(2019\)年京大化学の大問\(1\)について解説していきます.
また解説に加えて,それぞれの問題で覚えておいてほしいポイントについて詳しく説明していきます.
京大の化学は難しいという印象が強い方が多いと思いますが,京大化学には難しい問題と標準問題の\(2\)つがあります.ここで,受験生が対策すべきことが\(2\)つあります.
\(1\)つ目は,標準問題を最後まで解き切る力を身につけることです.これにより,まずは平均点を取ることを目指します.
\(2\)つ目は,難しい問題と標準問題を見分けられる目を養うことです.試験本番は時間制限内に自分の解ける問題を解き切る必要があります.そのため,難しい問題は解かずに,標準問題をしっかりと選択していきながら,最後まで解いていくことが必要になります.
この記事では,問題を選択していく目を養うために,どのようにして判断していくのかということも自分なりに説明していきます.
それでは,\(2019\)年京大化学の大問\(1\)の解説に進んでいきましょう!
\(\rm{(a)}\)は,\(\rm{CrO_4^{2-}}\)を指示薬として使った沈殿滴定です.溶解度積をしっかりと理解でき実践練習を積んでいるかが重要です.
\(\rm{(b)}\)は,濃淡電池と溶解度積を絡めた問題です.濃淡電池についても今回の問題を通して理解を深めておきましょう!
それでは今日も頑張っていきましょう!
大問\(1\)
(\(\rm{a}\))
まずはこの問題の設定について解説していきます.ここを理解した上で各設問に進んでいきましょう!
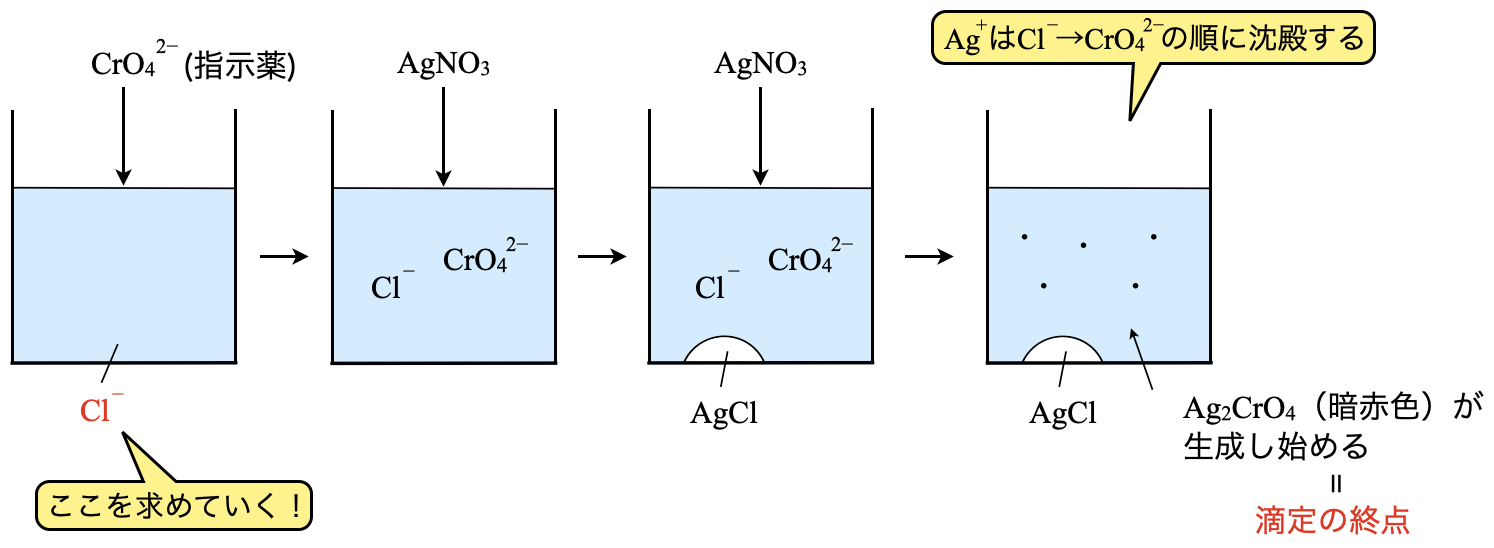
この実験の目的は,問題にもある通り「\(\rm{Cl^-}\)濃度を測定する」ことです.
\(\rm{Cl^-}\)を含んだ水溶液に指示薬として\(\rm{CrO_4^{2-}}\)を加えます.この溶液に\(\rm{Ag^+}\)イオンを添加すると,\(\rm{AgCl→Ag_2CrO_4}\)の順に沈殿します.このとき\(\rm{AgCl}\)の沈殿が終わるまでは,\(\rm{Ag_2CrO_4}\)の沈殿は生じないと考えて\(\rm{OK}\)ですよ!
そのため\(\rm{Ag_2CrO_4}\)の沈殿が生じ始めたとき(\(\rm{Cl}\)がすべて\(\rm{AgCl}\)として沈殿したとき)が滴定の終点になるというわけです.
問\(1\)
この問題は無機の\(\rm{Cr}\)に関するものです.私は\(\rm{Cr}\)の各物質を次のような図\(1\)つですべて覚えています!
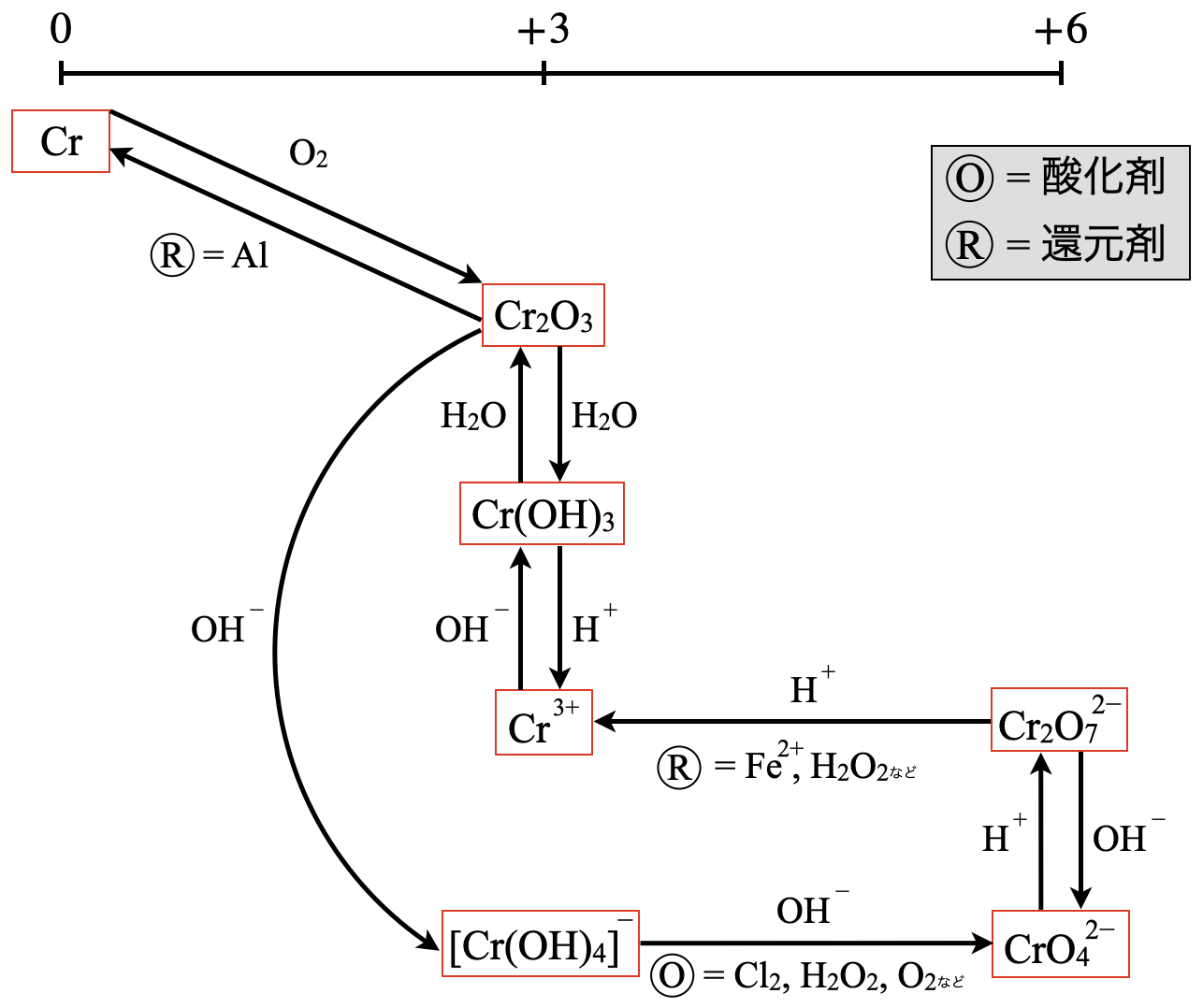
\(\rm{Cr}\)金属は説明をするとそれだけで\(1\)記事になるので,今回は本問に関係あるところだけを紹介しますね.詳細については,別記事で紹介します!
今回の反応に関連する部分を抜き出すと次のようになります.
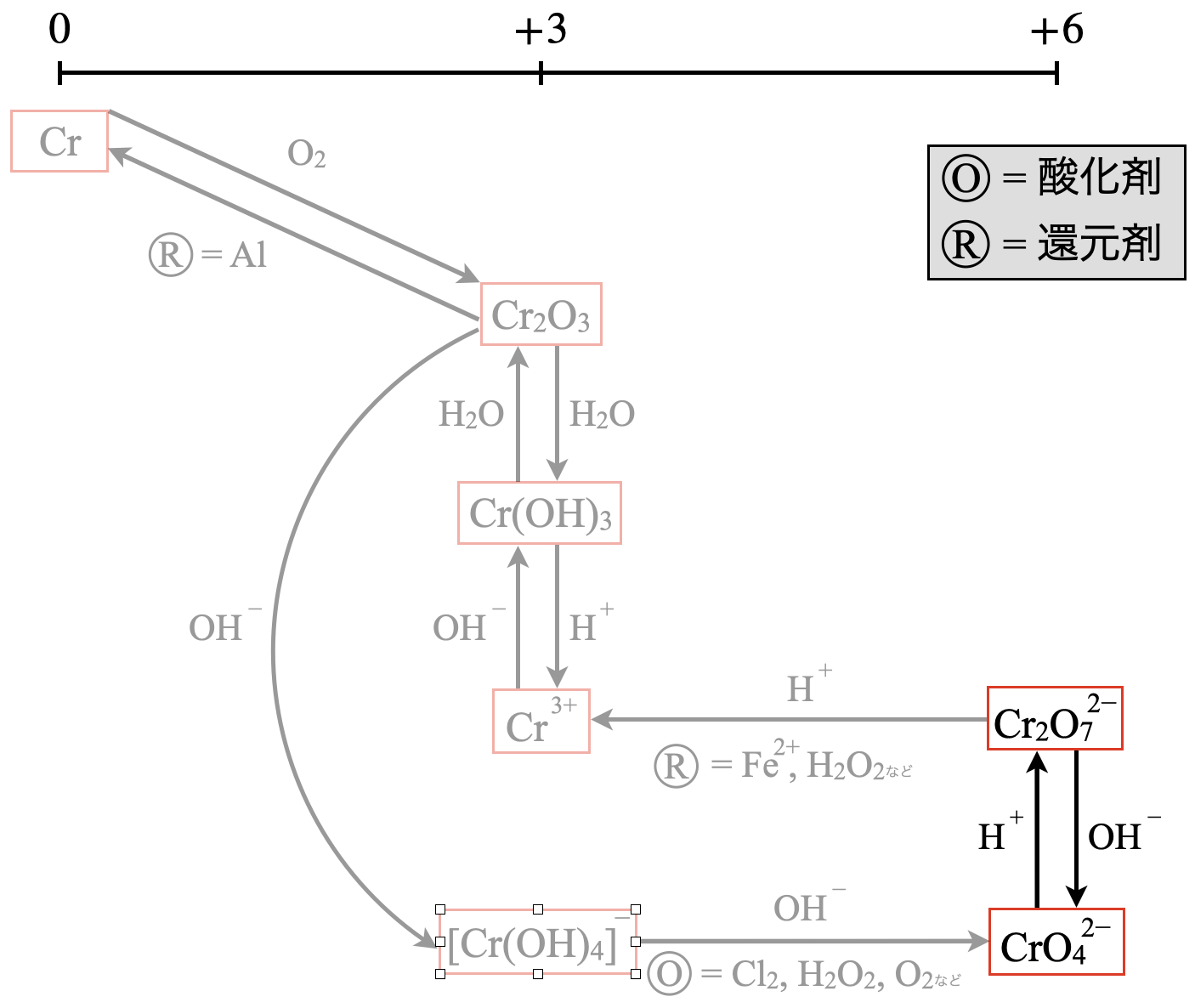
\(\rm{CrO_4^{2-}}\)は黄色ですが,この液を酸性にすると(\(\rm{H^+}\)を加えると)橙色に変化します.これは以下のような縮合反応が起こり,橙色の\(\rm{Cr_2O_7^{2-}}\)が生じるからです.
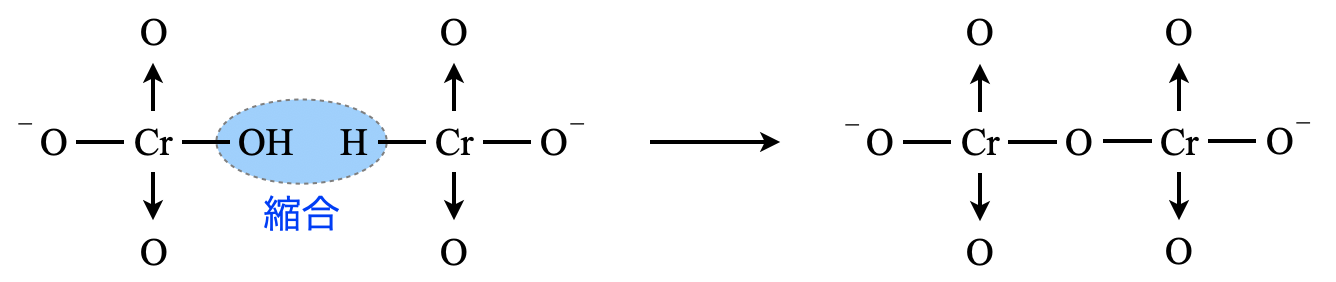
反応式にすると次のようになります.
\(\rm{2CrO_4^{2-}\ +\ 2H^+\ →\ Cr_2O_7^{2-}\ +\ H_2O}\)
問\(2\)
溶解度積の問題については基本的な解答パターンを覚えておきましょう!
縦軸に陽イオン(今回の場合は\(\rm{[Ag^+]}\)),横軸に陰イオン(\(\rm{[Cl^-]}\)と\(\rm{[CrO_4^{2-}]}\))を書きます.このように考えると,曲線によって溶液の状態が分かれています.曲線より上側にある場合に沈殿が生じており,曲線より下側にある場合には沈殿は生じておらず溶解していることが一目でわかります.

ポイントとしては,溶液内に沈殿が生じているときは平衡が成り立っているので,溶解度積を用いて各濃度を求めることができます.つまり,溶解度積の曲線上にあるということです.
こちらの記事でも詳しく説明しているのでぜひ参考にしてください!


\(\rm{\hspace{.18em}I\hspace{.18em}}\)
本問のポイントは,ちょうど\(\rm{Ag_2CrO_4}\)が生成し始めたときの\(\rm{[Ag^+]}\)を求めるということです.沈殿が生成し始めるのは,各濃度が溶解度積の曲線上にあるときであることをおさえてくださいね!
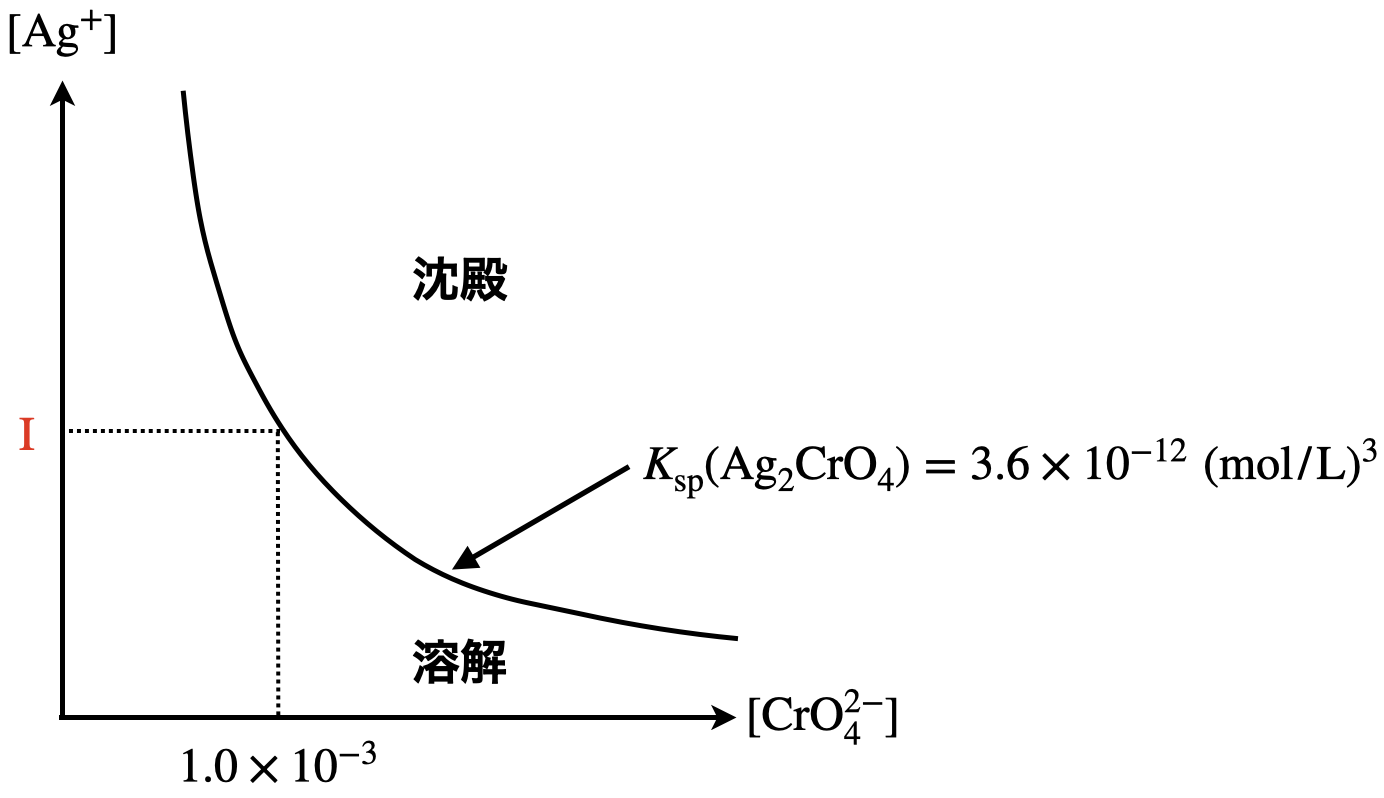
与えられた図\(1\)より,最初から\(\rm{[CrO_4^{2-}] = 1.0 × 10^{-3}\ mol/L}\)であったことがわかります.
そして\(K_{\rm{sp}}\rm{(Ag_2CrO_4) = 3.6 × 10^{-12}\ (mol/L)^3}\)であるため,ここからこのときの\(\rm{[Ag^+]}\)を求めます.
\(K_\rm{sp}\)\(\rm{(Ag_2CrO_4) = [Ag^+]^2 [CrO_4^{2-}] = 3.6 × 10^{-12}\ (mol/L)^3}\)
\(\rm{[Ag^+] =}\)\( \sqrt{\large \frac{K_{\rm{sp}} \rm{(Ag_2CrO_4)}}{\rm{[CrO_4^{2-}]}}} \small = \sqrt{\large \frac{3.6\ ×\ 10^{-12}}{1.0\ ×\ 10^{-3}}} \small = \sqrt{3.6 × 10^{-9}}\ \rm{mol/L} = 6.0 × 10^{-5}\ \rm{mol/L}\)
\(\rm{I\hspace{-.01em}I}\)
次はこのときに溶液に残存する\(\rm{[Cl^-]}\)を求めます.この問題を解くには,今回の現象がグラフ上でどのようになっているのかを捉えることが重要です!
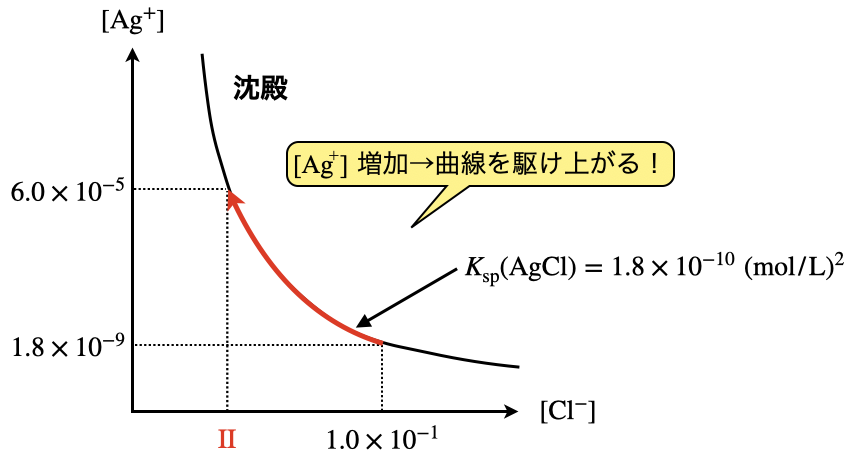
じっくり考えてみましょう!
溶液の最初の\(\rm{Cl^-}\)の濃度は,\(\rm{[Cl^-] = 1.0 × 10^{-1}\ mol/L}\)でした.そして\(\rm{AgNO_3}\)を滴下していくと,最初に生じた\(\rm{AgCl}\)は溶解していますが,\(\rm{[Ag^+] = 1.8 × 10^{-9}\ mol/L}\)になったときに\(\rm{AgCl}\)の沈殿が生成し始めます.ここの交点が溶解度積\(K_{\rm{sp}}\)の曲線との交点になります.ここまでは大丈夫ですか?
そしてさらに\(\rm{AgNO_3}\)を滴下すると,\(\rm{[Cl^-]}\)が徐々に減少し,\(\rm{[Ag^+]}\)は増加していくため,図のように曲線を駆け上がっていくようなイメージになります.
駆け上がった後の\(\rm{[Ag^+]}\)が\(\rm{\hspace{.18em}I\hspace{.18em}}\)で求めた\(\rm{[Ag^+] = 6.0 × 10^{-5}\ mol/L}\)であるため,この値を代入して\(\rm{[Cl^-]}\)を求めます.
\(\rm{[Cl^-] = \large \frac{1.8\ ×\ 10^{-10}}{6.0\ ×\ 10^{-5}} \small = 3.0 × 10^{-6}\ mol/L}\)
グラフを最大限活用できるようになりましょう!
問\(3\)
\(\rm{[Ag^+] = [Cl^-]}\)の関係から\(\rm{[Ag^+]}\)を決定し,\(\rm{[CrO_4^{2-}]}\)を求めていきます.
このように\(2\)つの溶解度積を組み合わせて考えることができるのは,\(2\)つのイオンが同じ溶液に同時に溶解していることに加え,それぞれの沈殿が生じるタイミングが異なっているからです.
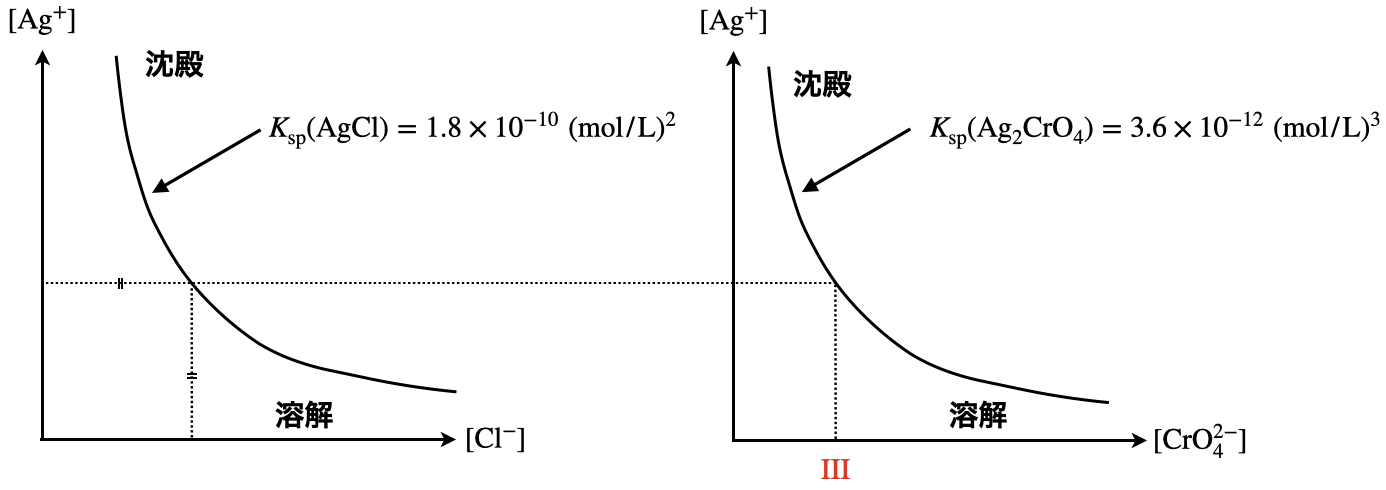
\(\rm{[Ag^+] = [Cl^-]}\)より,\(\rm{[Ag^+]^2 = 1.8 × 10^{-10}\ mol/L}\)です.
ここで,\(\rm{[Ag^+]}\)の値を求めずに,\(\rm{[Ag^+]^2}\)の形にして放置しておくのがポイントです!
そして次に,\(K_{\rm{sp}}\rm{(Ag_2CrO_4) = [Ag^+]^2 [CrO_4^{2-}] = 3.6 × 10^{-12}\ (mol/L)^3}\)より,
\(\rm{[CrO_4^{2-}] = }\)\(\large \frac{K_{\rm{sp}} \rm{(Ag_2CrO_4)}}{\rm{[Ag^+]^2}}\small = \large \frac{3.6\ ×\ 10^{-12}}{1.8\ ×\ 10^{-10}} \small = 2.0 × 10^{-2}\ \rm{mol/L}\)
(\(\rm{b}\))
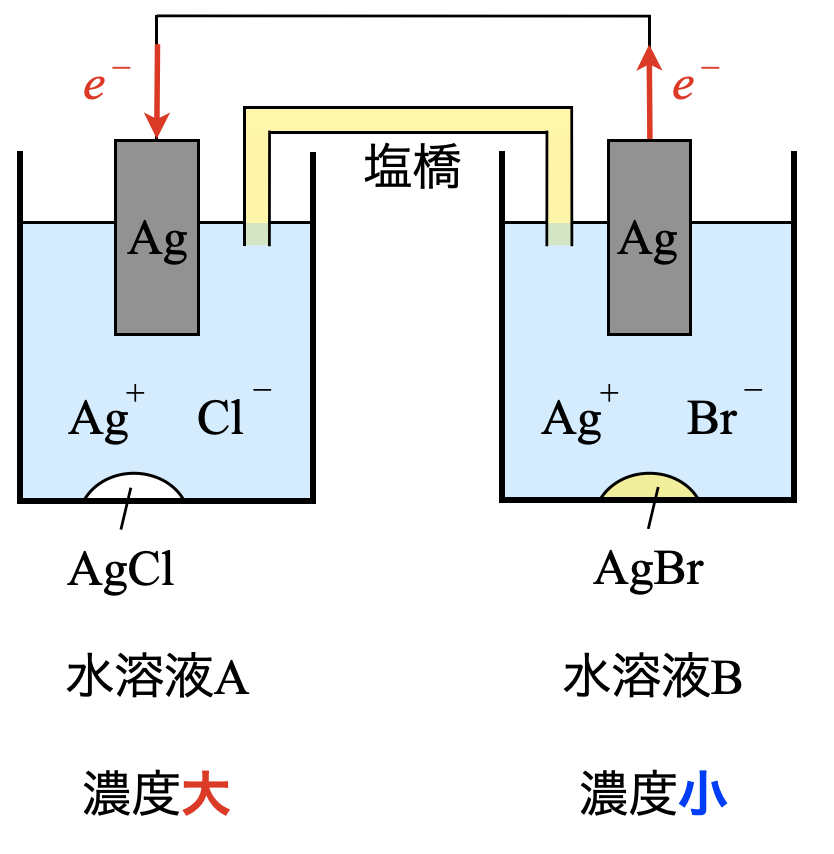
濃淡電池に関する問題です.濃淡電池については馴染みのない方も多いと思いますが,問題の流れにのっていけば解けるようになっています.今回で濃淡電池の知識もつけていきましょう!
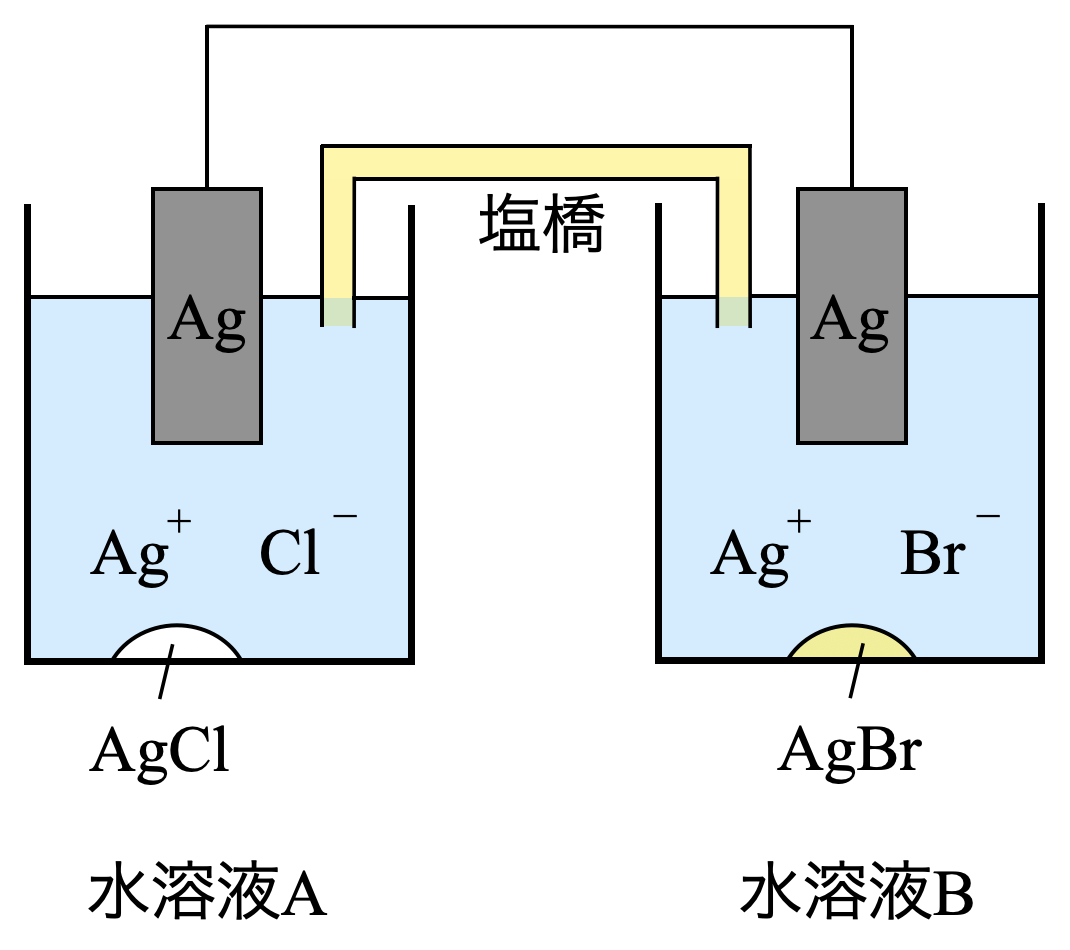
濃淡電池とは,溶液の濃度差だけで働く電池です.
濃度の小さい溶液では,単体→イオンになり,溶液濃度が大きくなります.一方で,濃度の大きい溶液では,イオン→単体となり,溶液濃度は小さくなります.
そしてこれらの2つの溶液の濃度が等しくなった点がこの電池の終点となり,電流が流れなくなります.
この知識を実際の問題で活用していきましょう!
問\(4\)
\(\rm{I\hspace{-.15em}I\hspace{-.15em}I}\)
水溶液\(\rm{A}\)では,\(\rm{[Cl^-] = 1.0 × 10^{-3}\ mol/L}\)なので,溶解度積\(K_{\rm{sp}}\)\(\rm{(AgCl) = 1.8 × 10^{-10}\ mol/L}\)を使って,\(\rm{[Ag^+]_A}\)を求めていきます.
\(\rm{[Ag^+]_A = }\)\(\large \frac{K_{\rm{sp}}\rm{(AgCl)}}{\rm{[Cl^-]}} \small = \large \frac{1.8\ ×\ 10^{-10}}{1.0\ ×\ 10^{-3}} \small = 1.8 × 10^{-7}\ \rm{mol/L}\)
\(\rm{I\hspace{-.15em}V\hspace{-.15em}}\)
水溶液\(\rm{B}\)では,\(\rm{[Br^-] = 1.0 × 10^{-3}\ mol/L}\)なので,こちらも溶解度積\(K_{\rm{sp}}\)\(\rm{(AgBr) = 5.4 × 10^{-13}\ mol/L}\)を使って,\(\rm{[Ag^+]_B}\)を求めていきます.
\(\rm{[Ag^+]_B =} \large \frac{K_{\rm{sp}}(\rm{AgBr})}{[Br^-]} \small =\)\(\rm{ \large \frac{5.4\ ×\ 10^{-13}}{1.0\ ×\ 10^{-3}} \small = 5.4 × 10^{-10}\ mol/L}\)
\(\rm{\hspace{-.15em}V\hspace{-.15em}}\)については,問\(5\)の後に解説しますね!
問\(5\)
ア
各溶液中の\(\rm{[Ag^+]}\)の濃度を比較してみましょう!
\(\rm{[Ag^+]_A = 1.8 × 10^{-7}\ mol/L}\)
\(\rm{[Ag^+]_B = 5.4 × 10^{-10}\ mol/L}\)
つまり,\(\rm{[Ag^+]_A > [Ag^+]_B}\)となっています.
スイッチを接続すると,この\(\rm{[Ag^+]}\)のかたよりをなくすように電気分解が生じます.つまり,\(\rm{[Ag^+]_A}\)が減少し,\(\rm{[Ag^+]_B}\)が増加することで,両溶液の濃度は等しくなると考えられます.
この考え方をもとにすると,各電極では下のような反応が起こります.
\(\rm{A:Ag^+\ +\ }\)\(e^-\ \rm{→\ Ag}\)
\(\rm{B:Ag\ →\ Ag^+\ +\ }\)\(e^-\)
これより\(\rm{A}\)は還元反応になります.
イ
\(e^-\)が\(\rm{B→A}\)に流れています.電流は\(e^-\)と逆向きに流れることになるので,\(\rm{A→B}\)となります.
勘違いしないように,図に書き込むなど基本的なことを大切にしていきましょう!
ウ
電流が流れると,\(\rm{[Ag^+]_A}\)は減少します.すると,
\(\rm{AgCl(s)\ ⇄\ Ag^+\ +\ Cl^-}\)
の平衡が右に移動するので,\(\rm{AgCl(s)}\)の溶解が進み,\(\rm{AgCl(s)}\)は減少します.
最後に,問\(4\)の\(\rm{\hspace{-.15em}V\hspace{-.15em}}\)について解説します.
\(\rm{[Ag^+]_A > [Ag^+]_B}\)となっている間は電流が流れ続けますが,\(\rm{[Ag^+]_A = [Ag^+]_B}\)となると,電流が流れなくなります.このとき共に沈殿が生じているので,以下の\(2\)式が成立します.
\(\rm{[Ag^+]_A [Cl^-] = 1.8 × 10^{-10}\ (mol/L)^2}\)
\(\rm{[Ag^+]_B [Br^-] = 5.4 × 10^{-13}\ (mol/L)^2}\)
これらを\(\rm{[Ag^+]}\)について考えると,
\(\rm{\large \frac{1.8\ ×\ 10^{-10}}{[Cl^-]} \small = \large \frac{5.4\ ×\ 10^{-13}}{[Br^-]}}\)
となり,これに\(\rm{[Cl^-] = 2.0 × 10^{-3}\ mol/L}\)を代入すると,
\(\rm{[Br^-] = 6.0 × 10^{-6}\ mol/L}\)
となります.
最後に
最後まで閲覧していただきありがとうございました.
今回の問題は,溶解度積をうまく使えるのか,そして初めての状況をしっかりと混乱せずに落ち着いて解答できるかがポイントでした.京大化学は初見の問題が多いですが,落ち着いて考えると今までに学習したことのある問題を違う角度から問う問題であることも多いです.経験を多く積むことで,少しずつ自分のものにしていきましょう!
本記事の内容についてわからない点があれば,遠慮なく質問していただければと思います.
(Twitter:chem_story1)
京都大学の化学は難問が多いと言われますが,その分多くのことを学ぶことができます.
皆さんの学習の一助になれば幸いです.



コメント