今回のメニューです!
✅共役(きょうやく)の見分け方
物質の変化の中の「酸・塩基」について徹底解説していきます。
酸と塩基の定義については、「アレニウスの定義」と「ブレンステッドの定義」の\(2\)つがあります。
それぞれの違いがわかるように丁寧に解説していきますので、ぜひ最後までご覧ください。
酸・塩基の定義
酸・塩基の定義には、アレニウスの定義とブレンステッドの定義があります。
それぞれの内容を学習するために、それぞれの違いをまとめておきましょう!
| アレニウスの定義 | 酸 | \(\rm{H^+}\)を出すもの |
| 塩基 | \(\rm{OH^-}\)を出すもの | |
| ブレンステッドの定義 | 酸 | \(\rm{H^+}\)を出すもの |
| 塩基 | \(\rm{H^+}\)を受け取るもの |
この違いをしっかりと覚えておきましょう。
アレニウスの定義
\(1887\)年スウェーデンのアレニウスは、「水溶液中で、\(\rm{H^+}\)を放出する物質を酸、\(\rm{OH^-}\)を放出する物質を塩基」と定義しました。
アレニウスの定義のポイントは\(3\)点あります。
\(2\). \(\rm{H^+}\)(水素イオン)を放出する物質 → 酸
\(3\). \(\rm{OH^-}\)(ヒドロキシ基)を放出する物質 → 塩基
すると、以下のようにそれぞれの物質を見分けることができます。
酸:\(\rm{HCl→H^+ + Cl^-}\) (\(\rm{H^+}\)を放出するので、\(\rm{HCl}\)は酸)
塩基:\(\rm{NaOH→Na^+ + OH^-}\) (\(\rm{OH^-}\)を放出するので、\(\rm{NaOH}\)は塩基)
ただし、このアレニウスの定義には、次のような問題点があります。
\(2\). \(\rm{OH^-}\)(ヒドロキシ基)のないアンモニアが塩基性であることを説明できない
この問題点を解決するために、ブレンステッドの定義というものが提案されました。
ブレンステッドの定義
\(1923\)年、ブレンステッドとローリーは、「\(\rm{H^+}\)を出す物質を酸、\(\rm{H^+}\)を受け取る物質を塩基」と定義しました。
\(\rm{H^+}\)だけを使って酸・塩基を判断することで、先ほどのアレニウスの定義の問題点を解消できるようになりました。
具体例を見てみましょう!
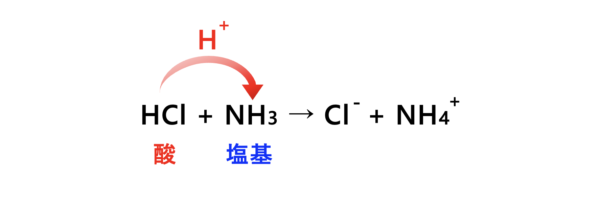
酸である\(\rm{HCl}\)が\(\rm{H^+}\)(水素イオン)を出して\(\rm{Cl^-}\)となります。
一方で、塩基である\(\rm{NH_3}\)は\(\rm{H^+}\)を受け取って\(\rm{{NH_4}^+}\)になるというわけです。
こうすることで、\(\rm{OH^-}\)(ヒドロキシ基)をもっていない\(\rm{NH_3}\)も塩基と区別することができました。
ブレンステッドの定義による\(\rm{H_2O}\)の酸・塩基
ここで、ブレンステッドの定義を使って、水(\(\rm{H_2O}\))の酸・塩基を判断してみましょう。
\(\rm{CH_3COOH + H_2O ⇄ CH_3COO^- + H_3O^+}\)
化学反応式の左右を見比べて、\(\rm{H^+}\)の移動を考えてみましょう。
すると、
\(\rm{CH_3COOH}\):\(\rm{H^+}\)を出して、\(\rm{CH_3COO^-}\)に変化
\(\rm{H_2O}\):\(\rm{H^+}\)を受け取って、\(\rm{H_3O^+}\)に変化
なので、\(\rm{H_2O}\)は塩基になります。
では、もう\(1\)題考えてみましょう。
\(\rm{NH_3 + H_2O ⇄ {NH_4}^+ + OH^-}\)
\(\rm{NH_3}\):\(\rm{H^+}\)を受け取って、\(\rm{{NH_4}^+}\)に変化
\(\rm{H_2O}\):\(\rm{H^+}\)を出して、\(\rm{OH^-}\)に変化
なので、\(\rm{H_2O}\)は酸になります。
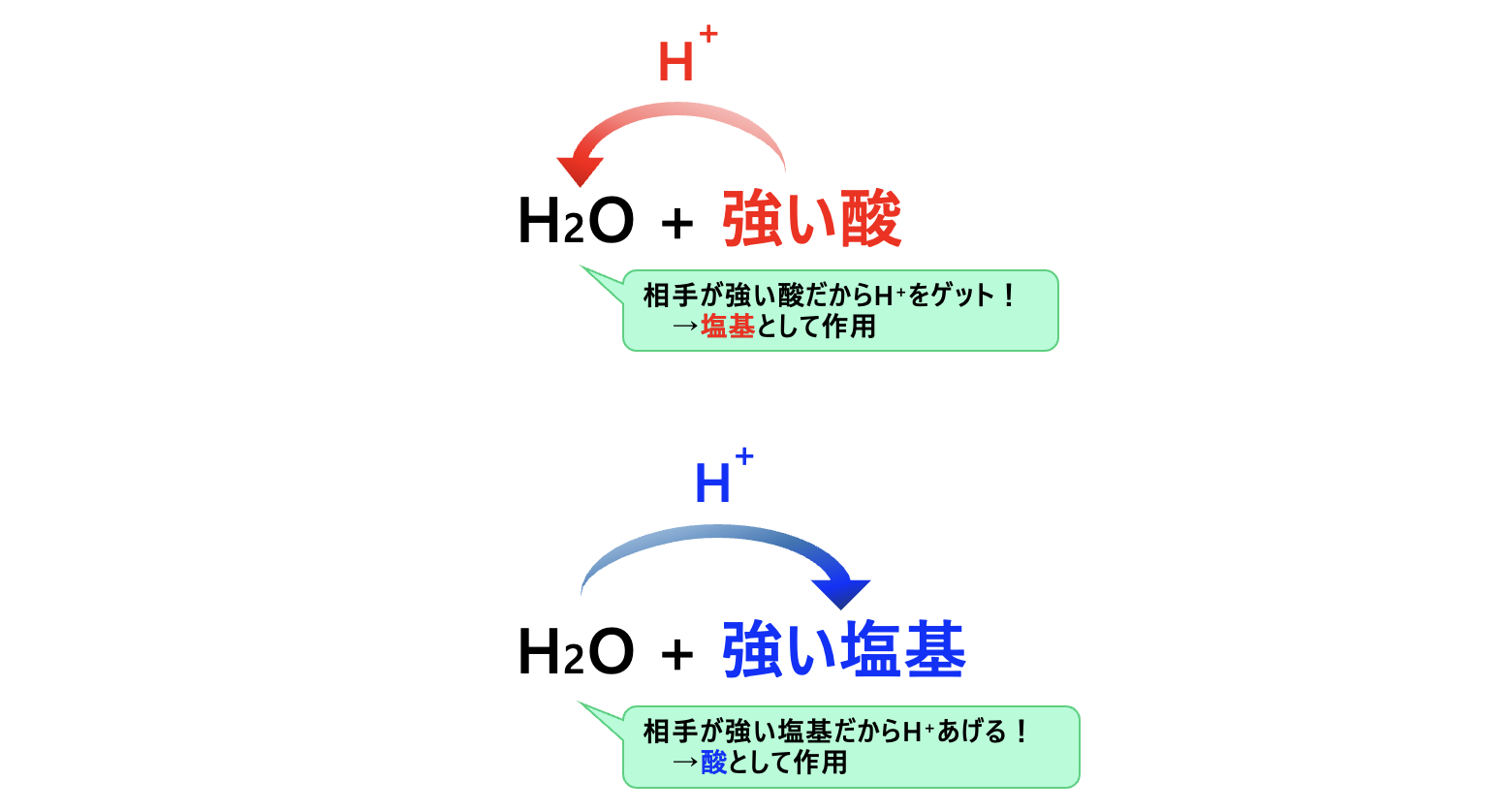
上の\(2\)つの反応式を見比べると、\(\rm{H_2O}\)は酸にも塩基にもなることがわかります。
つまり、ブレンステッドの酸・塩基の定義では、反応する相手物質との関係で、酸 \(\rm{or}\) 塩基の性質が変化することがわかります。
例えば、水の場合、
・自分より強い塩基に対しては酸として作用する
共役な酸・塩基
それでは次に、共役な酸、塩基について解説していきます。
共役な酸、塩基もブレンステッドの定義を使って考えていきましょう。
共役(きょうやく)な酸、塩基の見分け方のポイントは、\(\rm{H^+}\)です。
・共役な酸:\(\rm{H^+}\)がついているもの
・共役な塩基:\(\rm{H^+}\)がついていないもの
これさえ覚えておけば、しっかりと共役な酸、塩基を区別することができます。
先ほどの化学反応式をもう一度見てみましょう。
\(\rm{CH_3COOH + H_2O ⇄ CH_3COO^- + H_3O^+}\)
共役な酸、塩基を\(\rm{H^+}\)で区別してみましょう。
・\(\rm{CH_3COOHはH^+}\)があるので共役酸、\(\rm{CH_3COO^-}\)は\(\rm{H^+}\)がないので共役塩基
・\(\rm{H_3O^+}\)は\(\rm{H^+}\)があるので共役酸、\(\rm{H_2O}\)は共役塩基
と判断することができます。
\(\rm{NH_3 + H_2O ⇄ {NH_4}^+ + OH^-}\)
・\(\rm{NH_3}\)は\(\rm{H^+}\)がないので共役塩基、\(\rm{{NH_4}^+}\)は\(\rm{H^+}\)があるので共役酸
・\(\rm{OH^-}\)は\(\rm{H^+}\)がないので共役塩基、\(\rm{H_2O}\)は共役酸
と判断することができます。



コメント