
塩素系の反応を惰性で覚えている人はいませんか?また塩素の発生装置をまる覚え…なんてことをしてはいけませんよ!
必ず仕組みを理解して覚えることでどんな状況でも間違えずに解答できるようになります!
それでは今日も頑張っていきましょう!
\(\rm{Cl}\)系列の全体像
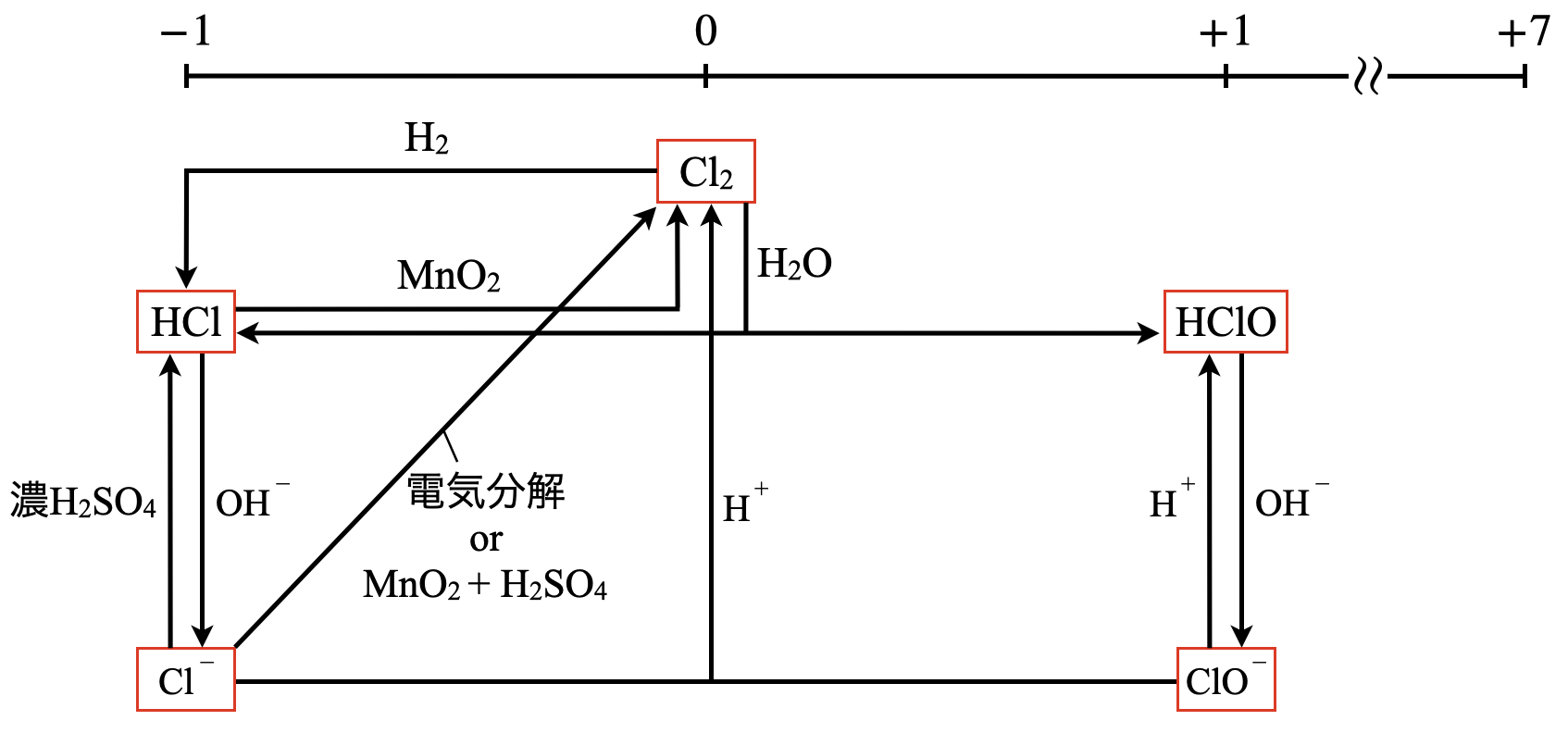
\(\rm{Cl}\)原子のとりえる酸化数は\(-1\)〜\(+7\)になりますが,基本的に入試に出る酸化数は\(+1\)までなので,\(-1\)〜\(+1\)までを詳しくみていきましょう.
実験室での気体生成
\(\rm{Cl}\)系列の気体は\(\rm{HCl}\)と\(\rm{Cl_2}\)です.
塩素を含む物質で容易に手に入るのは,もちろん食塩\(\rm{NaCl}\)です.この食塩を酸\(\rm{HCl}\)に戻すには濃硫酸を加えて加熱し(熱濃硫酸),揮発性の\(\rm{HCl}\)を追い出して生成します.
\(\rm{Cl_2}\)については,酸化剤として\(\rm{MnO_2}\)を使用して発生させます.
これらの詳細についても,しっかりと暗記できるようにわかりやすく解説していきますね!
工業的製法
工業的には,\(\rm{HCl}\)の製法だけをおさえておけば十分です!
食塩\(\rm{NaCl}\)を電気分解することで,まず\(\rm{Cl_2}\)を得ます.そしてここで得た\(\rm{H_2}\)と\(\rm{Cl_2}\)を反応させることで\(\rm{HCl}\)を得ています.
塩素
塩素は黄緑色の有毒気体で酸化力が非常に強いです.
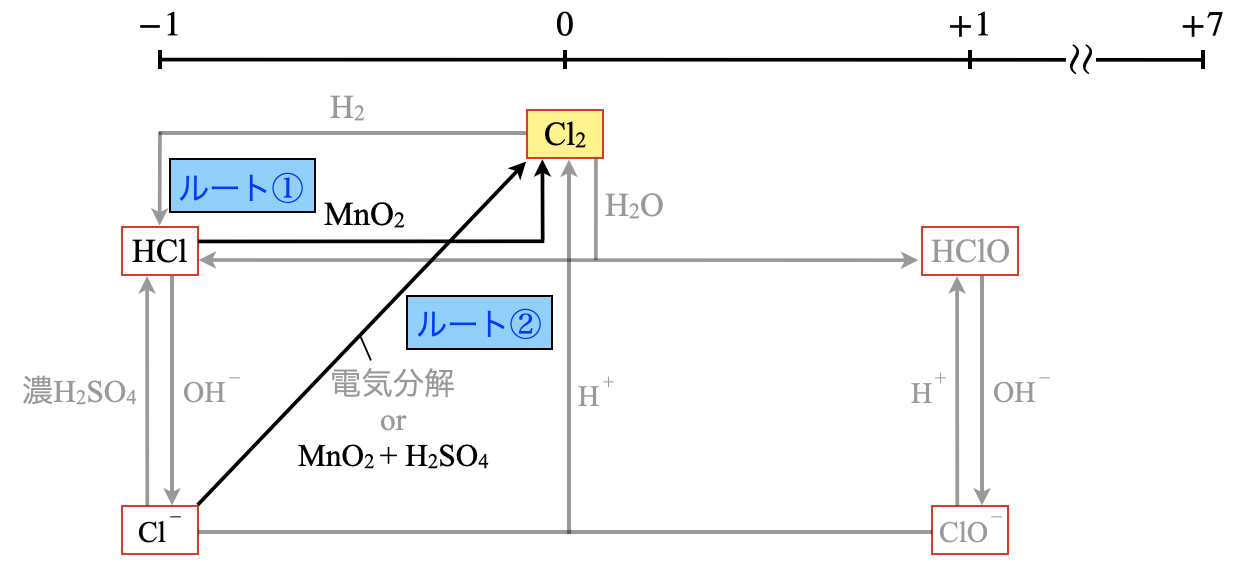
\(\rm{Cl_2}\)を生成するために,\(\rm{Cl^-}\)からのルートを考えてみましょう!
\(\rm{Cl^-}\)から\(\rm{Cl_2}\)を得るには酸化剤が必要ですが,\(\rm{Cl_2}\)は有毒なので慎重に発生させる必要があります…
そのため\(\rm{KMnO_4(aq)}\)のような液体の強い酸化剤を使うと,混ぜた瞬間に反応が進んで途中で反応を止めることができないため,かなり危険です…
そこで酸化剤として\(\rm{MnO_2}\)を使います!
さらに\(\rm{MnO_2}\)が酸化剤として働くためにはさらに\(\rm{H^+}\)と加熱が必要です.
これらを整理すると,\(\rm{Cl_2}\)が発生する条件は
\(\rm{Cl^-\ +\ MnO_2\ +\ H^+\ +\ }\)熱 \(\rm{\ →\ Cl_2}\)
となります.
具体的には,下の\(2\)ルートから\(\rm{Cl_2}\)を生成します.
- ルート\(1:\)\(\rm{HCl}\)(濃)\(\rm{\ +\ MnO_2\ +\ }\)熱
- ルート\(2:\)\(\rm{NaCl\ +\ MnO_2\ +\ H_2SO_4}\)(濃)\(\rm{\ +\ }\)熱
ルート\(1\)は,\(\rm{HCl}\)から\(\rm{H^+}\)と\(\rm{Cl^-}\)を出しています.そしてルート\(\rm{2}\)は,\(\rm{NaCl}\)から\(\rm{Cl^-}\)を出し,\(\rm{H^+}\)を出すために\(\rm{H_2SO_4}\)を使用しています!
- ルート\(1\):\(\rm{MnO_2\ +\ 4HCl\ →\ MnCl_2\ +\ Cl_2↑\ +\ 2H_2O}\)
- ルート\(2\):\(\rm{2NaCl\ +\ MnO_2\ +\ 3H_2SO_4\ →\ MnSO_4\ +\ 2NaHSO_4\ +\ Cl_2↑\ +\ 2H_2O}\)
ルート\(1\)とルート\(2\)の反応を見ると,\(2\)つ覚える必要があると思ってしまうかもしれません…
ただ,触媒として使う\(\rm{MnO_2}\)は同じであるため,\(\rm{Cl_2}\)の生成条件である
\(\rm{Cl^-\ +\ MnO_2\ +\ H^+\ +\ }\)熱 \(\rm{\ →\ Cl_2}\)
も同じです.
つまり,この\(2\)ルートの違いは,\(\rm{H^+}\)と\(\rm{Cl^-}\)を同時に供給するか(\(\rm{HCl}\)),別々に供給するか(\(\rm{NaCl}\)と\(\rm{H_2SO_4}\))という点だけになります.
\(2\)つの反応式を別々に覚えるのではなく,このように関連して考えることで格段に覚えやすくなりますよ!
あともう\(1\)つ塩素の発生で覚えておいてほしいのが,塩素系漂白剤(サラシ粉)を使った反応です.下の項で解説します!
次にテストでも頻出の塩素の発生装置について解説していきます!
塩素の発生装置
塩素の発生装置についてもテストで問われることがあるのでしっかりとおさえておきましょう!
\(\rm{MnO_2\ +\ 4HCl\ →\ MnCl_2\ +\ Cl_2↑\ +\ 2H_2O}\)
上の反応式の発生装置を問われることがほとんどです.
ここで,揮発性の塩酸を加熱するため,目的物質である\(\rm{Cl_2}\)に加えて\(\rm{HCl}\)が気体として発生します.つまり上の反応式と合わせて考えると,\(\rm{HCl \cdot H_2O \cdot Cl_2}\)の\(3\)種類の気体が発生します.
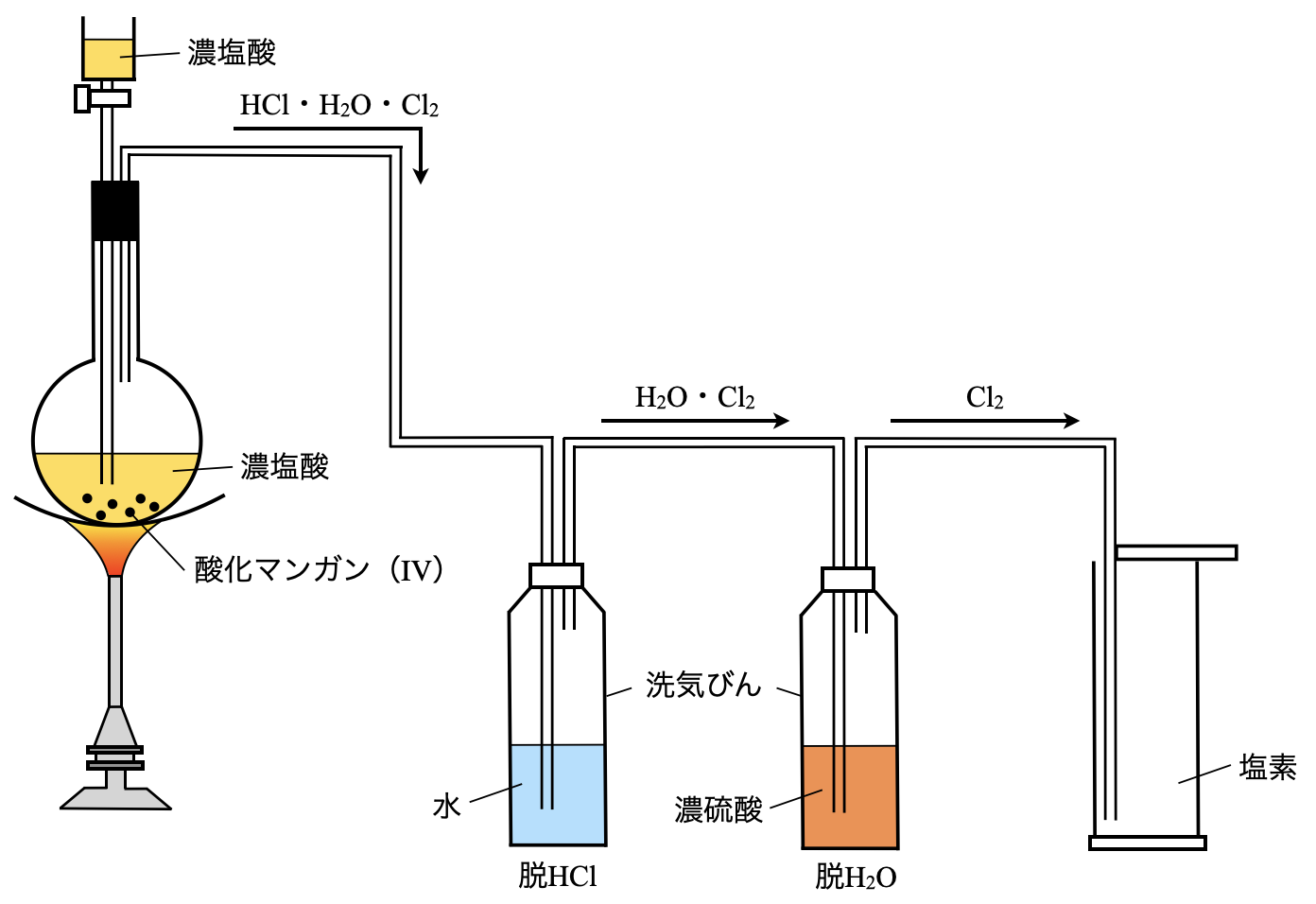
これを\(3\)ステップで解説していきます!
\(\rm{Step2:}\)脱\(\rm{H_2O}\)(濃\(\rm{H_2SO_4}\))
\(\rm{Step3:}\)塩素の捕集
\(\rm{Step1}\)
洗気びんの水に気体を通過させることで,\(\rm{HCl}\)を吸収します.これによって,次に流す気体の成分は\(\rm{H_2O \cdot Cl_2}\)となります.
厳密にいうと,\(\rm{Cl_2}\)も若干水に吸収されます.
ただ,下の反応式を見てください!
\(\rm{Cl_2\ +\ H_2O\ ⇄\ HCl\ +\ HClO}\)
このとき,平衡はほとんど左に大きくかたよっているため,\(\rm{Cl_2}\)の水への溶解度はかなり小さいです.そのため,\(\rm{Cl_2}\)の水への溶解は考える必要はありませんよ!
\(\rm{Step2}\)
次は,濃硫酸を用いて\(\rm{H_2O}\)を捕集します.濃硫酸は脱水剤としても使われます.そのため,\(\rm{H_2O}\)を取り除くことができます.
\(\rm{Step3}\)
最後に塩素を捕集しましょう!\(\rm{Cl_2}\)は空気より重く水に溶ける気体です.そのため,下方置換で捕集します.
水は水蒸気となって流れてくる気体に入り込んでしまいます.そのため濃硫酸のあとに水をくぐらせると,最後に水蒸気を含んだ塩素が取り出されてしまいます.
「最後に\(\rm{H_2O}\)が発生しないように最後に濃硫酸を置く」と覚えておきましょう!
サラシ粉を使った反応
\(\rm{Cl_2}\)は酸化力が非常に強いため,殺菌剤や漂白剤に利用されます.
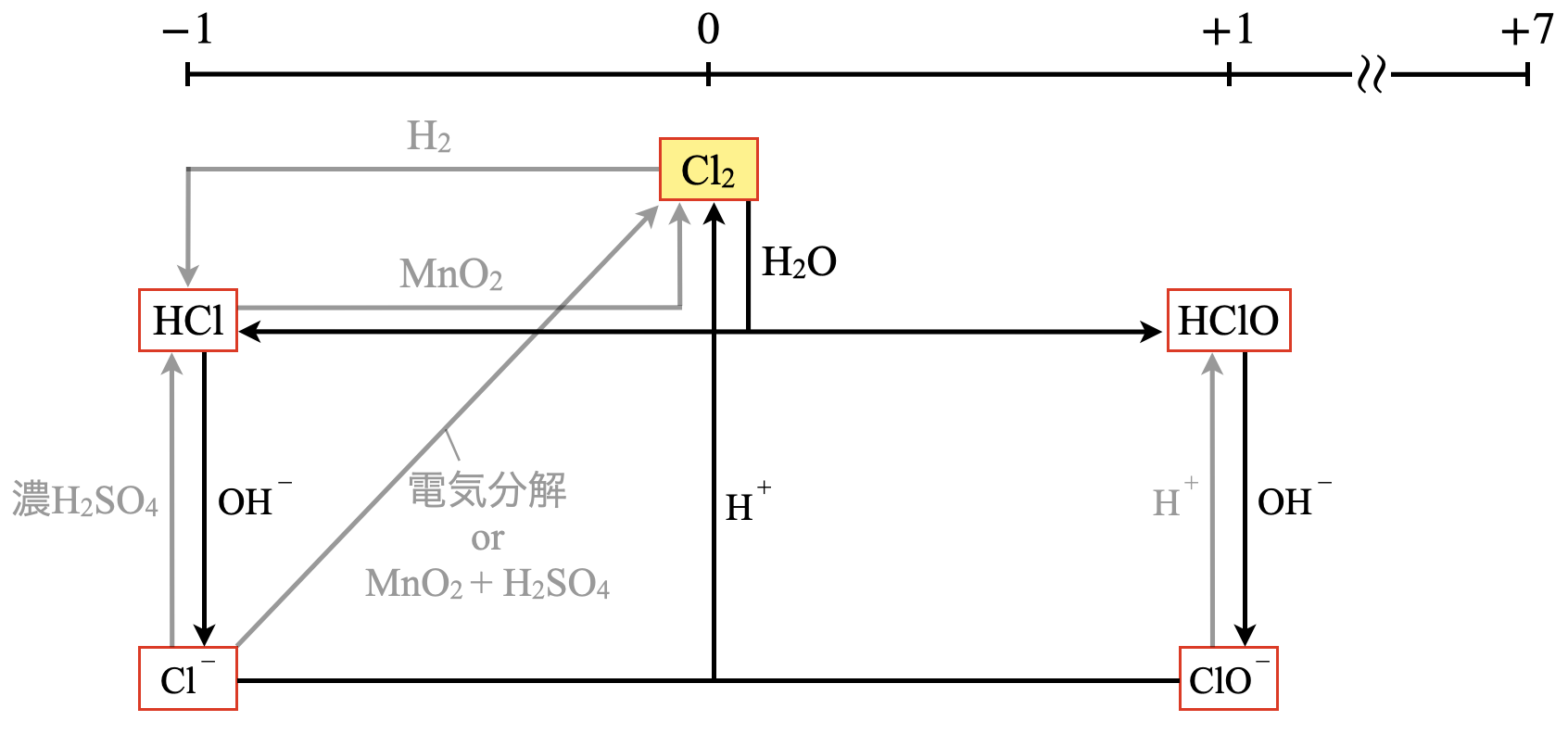
\(\rm{Cl_2}\)は水と反応して\(\rm{HCl \cdot HClO}\)という\(2\)つの酸に変化します.
\(\rm{Cl_2\ +\ H_2O\ →\ HCl\ +\ HClO}\)
さらにこれに\(\rm{OH^-}\)を加えることで\(\rm{Cl^- \cdot ClO^-}\)というイオンになります.
\(\rm{HCl\ +\ HClO\ +\ 2OH^-\ →\ Cl^-\ +\ ClO^-\ +\ 2H_2O}\)
ところで,家庭用に使用されている\(\rm{Cl_2}\)系の漂白剤を酸性にすると今までの逆反応が起こり,再び\(\rm{Cl_2}\)が生成します.
\(\rm{Cl^-\ +\ ClO^-\ +\ 2H^+\ →\ Cl_2↑\ +\ H_2O}\)
そのため,塩素系漂白剤に酸性の洗剤を混ぜると危険!というわけです!これは受験だけでなく,日常生活でも非常に大切なので,しっかりと覚えておいてくださいね!
塩化水素

塩化水素を実験室で発生させるルートは,ルート①になります.食塩\(\rm{NaCl}\)に濃硫酸を加えて加熱し(熱濃硫酸),揮発性の\(\rm{HCl}\)を追い出すしかありません.
\(\rm{NaCl\ +\ H_2SO_4\ →\ NaHSO_4\ +\ HCl↑}\)
また塩化水素とアンモニアを接触させると,塩化アンモニウムの白煙を生じます.
\(\rm{HCl\ +\ NH_3\ →\ NH_4Cl}\)
この反応は,\(\rm{HCl}\)や\(\rm{NH_3}\)の検出に利用されます.
工業的な塩化水素の製法
工業的に塩化水素を生成するルートが,ルート②になります.
まず\(\rm{NaCl}\)の水溶液を電気分解します.
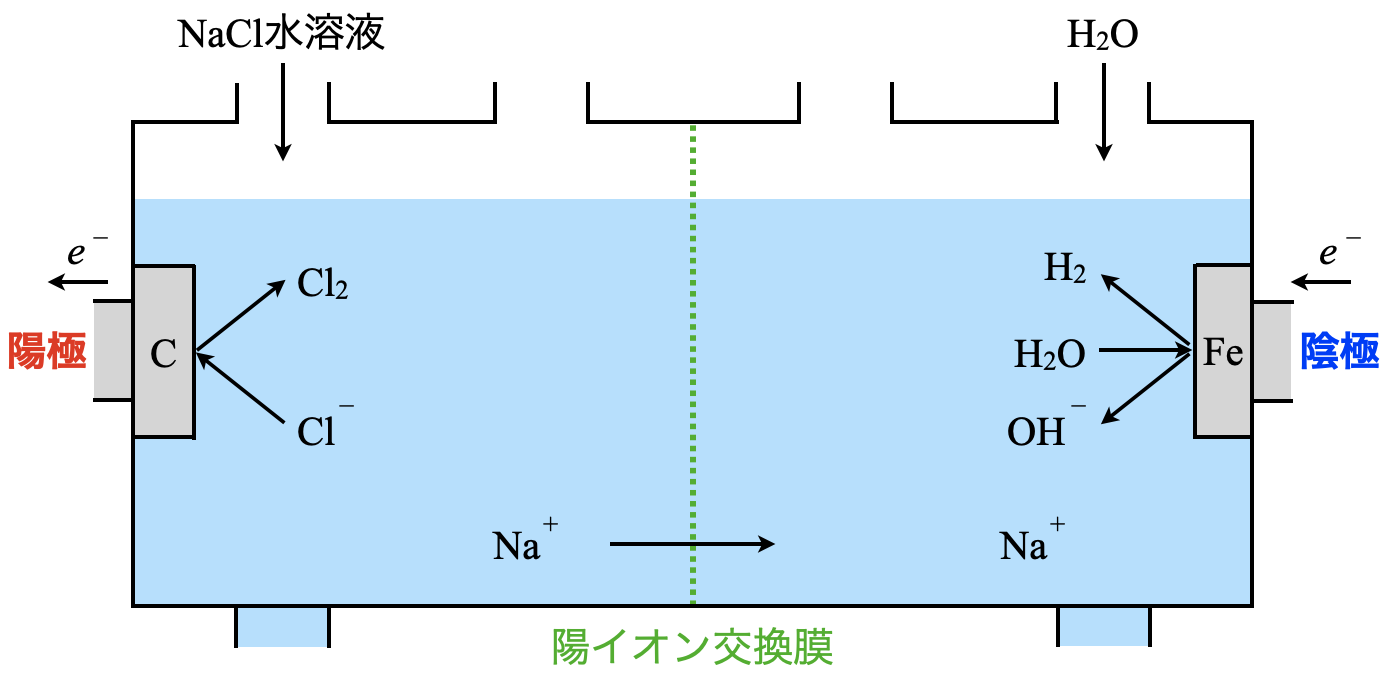
陰極:\(\rm{2H_2O\ +\ }\)\(2e^-\ \rm{→\ H_2\ +\ 2OH^-}\)
陽極:\(\rm{2Cl^-\ →\ Cl_2\ +\ }\)\(2e^-\)
ここの電気分解の詳細については,また今度詳細について解説します!
この電気分解によって,\(\rm{Cl_2}\)を生成することができます.さらに陰極で生成した\(\rm{H_2}\)を活用することで,
\(\rm{H_2\ +\ Cl_2\ →\ 2HCl}\)
となり,\(\rm{HCl}\)を生成することができます.
今日は以上となります!
今日も覚えることが多くて大変ですが,覚えるときにはなぜそうなるのか?を必ずおさえながら覚えるようにしてくださいね!
今後も「なぜ」を大切にしながら詳しく解説していきます!



コメント