
電池の原理
電池とは,発熱する酸化還元反応を利用し,反応熱を電気エネルギーに変換する装置のことです.電子の流れる方向は,化学においては還元剤から酸化剤に移動すると考えます.一方で,物理では-から+に移動すると考えます.電子の流れる方向は,化学でも物理でも一致するはずなので,還元剤が負極,酸化剤が正極となります.これを図で覚えようとすると,下のようになります.

参考書には「イオン化傾向の大きい金属が負極」と書いてあるものもあります.これは「イオン化傾向が大きい金属は還元剤として働きやすく,還元剤は負極になりやすい」という考えによるものだと思われます.ただ,電池の還元剤,酸化剤が金属元素以外であれば,この考え方は成り立たなくなります.そのため,「還元剤が負極になる」と覚えてください!
ボルタ電池
ボルタ電池の仕組み
下の図のように,希硫酸中に亜鉛版と銅板とを離して浸したものをボルタ電池といいます.
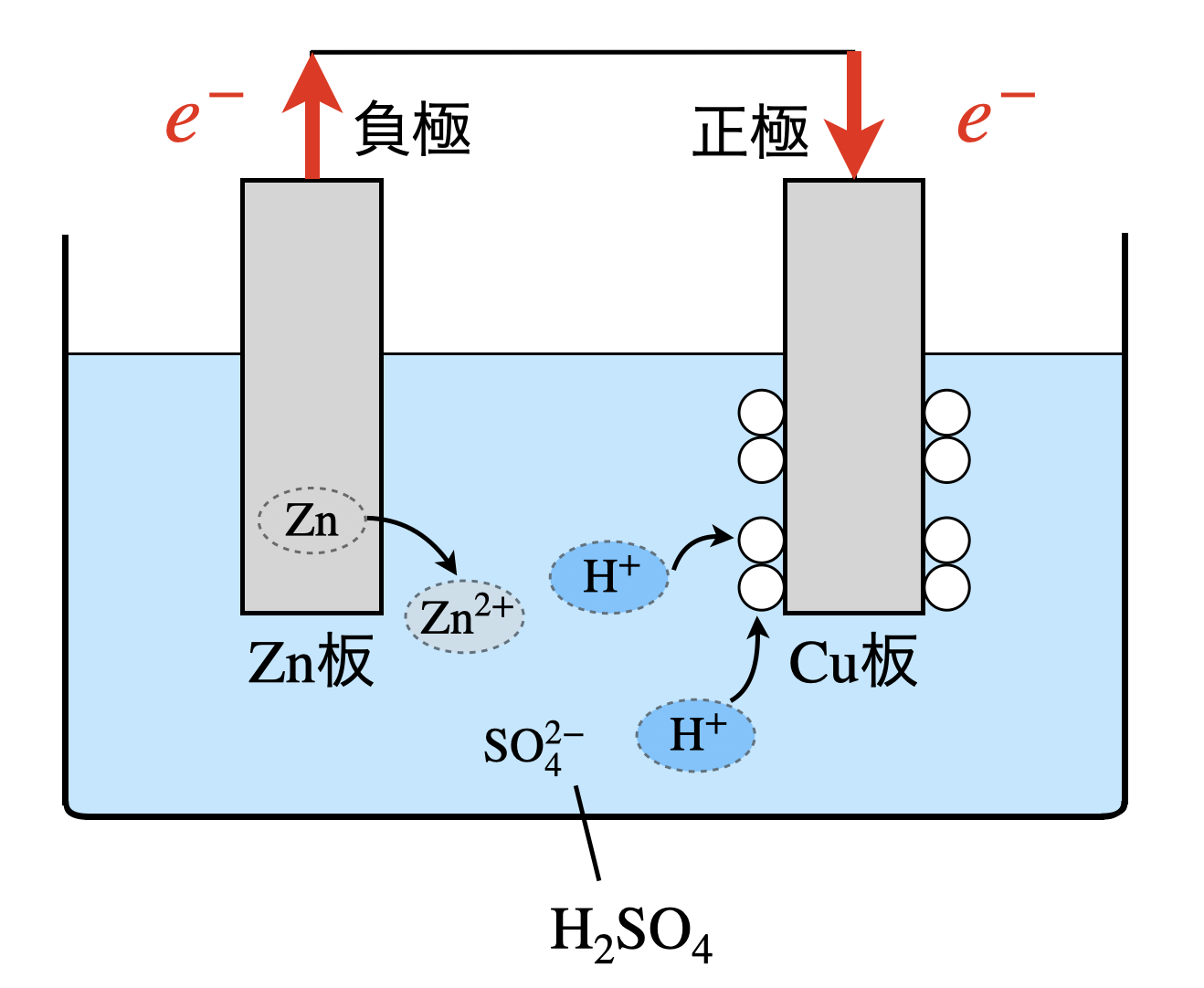
それでは,電池の考え方を説明していきましょう.基本的な電池の考え方は次の\(3\ \rm{step}\)になります.
①イオン化傾向の大きい金属板が溶ける
②\(e^-\)がもう片方の金属板の方へ行く
③もう片方の金属板でイオン化傾向の小さい物質と反応する
まず,それぞれの電極が還元剤,酸化剤のどちらになるかを考えていきましょう.イオン化傾向を考えると,\(\rm{Zn > Cu}\)となります.つまり,\(\rm{Zn}\)の方がイオンになりたいということです.そのため,\(\rm{Zn}\)が還元剤なので,負極となります.
負極:\(\rm{Zn\ →\ Zn^{2+}\ +\ }\)\(2e^-\)
一方で溶液中には,\(\rm{H^+}\)が存在するので,\(\rm{H^+}\)が\(e-\)を受け取ります.そのため,\(\rm{H^+}\)が酸化剤なので,正極となります.それぞれの反応をまとめてみましょう!
正極:\(\rm{2H^+\ +\ }\)\(2e^-\ →\ \rm{H_2}\)
分極
分極という言葉を覚えてください.分極とは,電池の放電により起電力が急激に低下する現象のことです.
では,なぜ分極が起こるのか,その原因について\(3\)点考えていきましょう.
①水素がCu板の表面を覆う
\(\rm{Cu}\)板で発生する\(\rm{H_2}\)が\(\rm{Cu}\)板に付着しその表面を覆うと,\(\rm{2H^+\ +\ }\)\(2e^-\ →\ \rm{H_2}\)という反応が妨げられます.そのため,起電力が低下してしまいます.
②負極付近の\(\rm{Zn^{2+}}\)濃度が高くなる
ずっと反応が続くと,負極付近の\(\rm{Zn^{2+}}\)濃度が高くなります.すると,\(\rm{Zn\ →\ Zn^{2+}}\)へと変化する反応が起こりにくくなり,\(e^-\)が回路に流れにくくなります.
③逆起電力を生み出す
これは少し難しいです.\(\rm{Cu}\)板を\(\rm{H_2}\)が完全に覆うと,水素電極のような性質をもつようになります.ここでイオン化傾向を考えると,\(\rm{H > Cu}\)となるので,\(\rm{H}\)の方がイオンになりたがります.よって,
\(\rm{H_2\ →\ 2H^+\ +\ }\)\(2e^-\)
という期待していたのとは逆の反応が起こるようになります.これが逆起電力を生み出してしまうということです.
この分極を防ぐには,どのようにすればよいでしょうか?
過酸化水素水\(\rm{H_2O_2}\)や二クロム酸カリウム\(\rm{K_2Cr_2O_7}\)などの酸化剤を電解液に加えましょう.すると,正極に発生した\(\rm{H_2}\)が酸化されて\(\rm{H_2O}\)となります.

ダニエル電池
ダニエル電池の仕組み
下の図のように,亜鉛板を浸した硫酸亜鉛水溶液と,銅板を浸した硫酸銅(\(\rm{I\hspace{-.01em}I}\))水溶液を,両液が混じり合わないように素焼き板で仕切って組み立てた電池をダニエル電池といいます.なかなか文章だとイメージがわかないと思いますので,下の図で覚えてください!
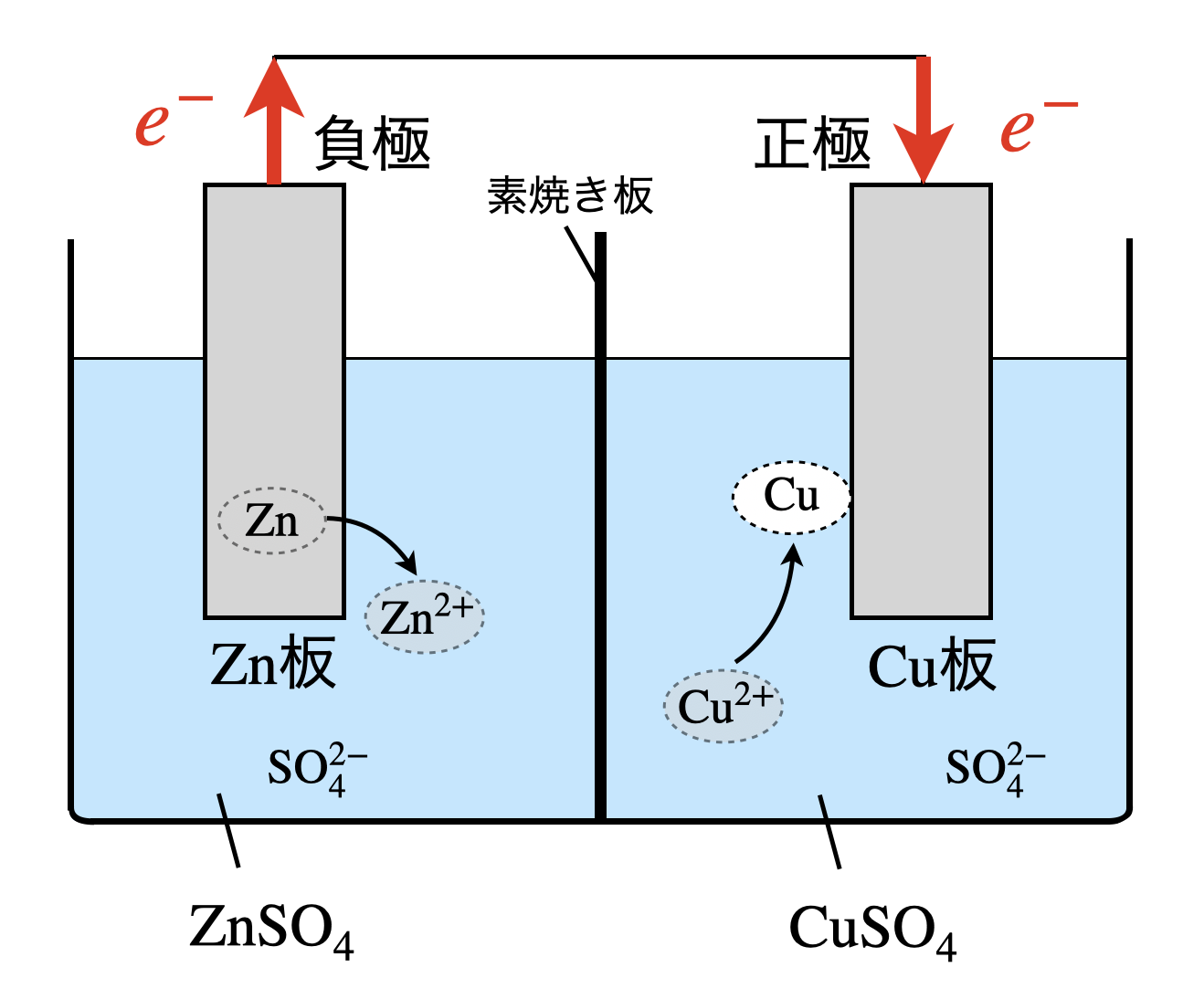
それぞれの電極のイオン化傾向を考えると,\(\rm{Zn > Cu}\)となります.つまり,\(\rm{Zn}\)の方がイオンになりたいということです.イオン化傾向をそのまま覚えるのではなく,どちらの方がイオンになりたいのか,という感覚で覚えてくださいね!そしてどんどん実際の問題で使えるようにしていきましょう!
そのため,\(\rm{Zn}\)が還元剤となり,負極となります.
負極:\(\rm{Zn\ →\ Zn^{2+}\ +\ }\)\(2e-\)
さて,正極はなにになるでしょうか?反対の電極側には,水溶液中に\(\rm{Cu^{2+}}\)があります.この\(\rm{Cu^{2+}}\)が\(e^-\)を受け取るため,酸化剤となります.
正極:\(\rm{Cu^{2+}\ +\ }\)\(2e^-\ →\ \rm{Cu}\)
素焼き板の役割
ダニエル電池に使われている素焼き板にはどのような役割があるのでしょうか?主に以下の\(2\)点を覚えてください!
①液の混合を防ぐ
素焼き板を用いることで,電解液である\(\rm{ZnSO_{\rm{4aq}}}\)と\(\rm{CuSO_{\rm{4aq}}}\)の混合を防ぐことができます.これらの液が混合すると,以下のような反応が起こります.
\(\rm{Zn\ +\ Cu^{2+}\ →\ Zn^{2+}\ +\ Cu}\)
この反応が\(\rm{Zn}\)板で起こります.すると,\(e^-\)が外部回路へ流れず,電流が取り出せなくなります.
②両液間でイオンが動く
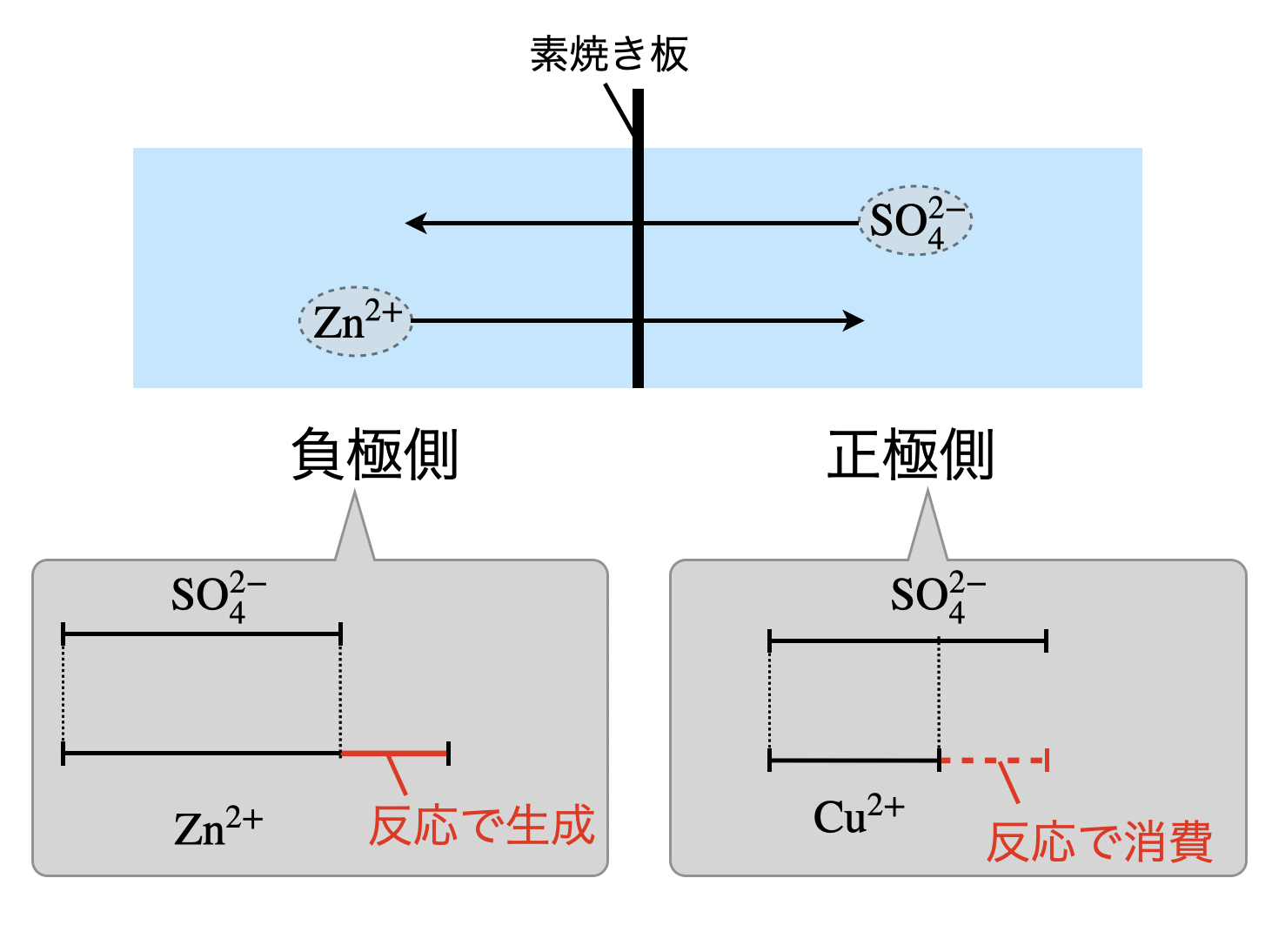
素焼き板を通して,\(\rm{Zn^{2+}}\)と\(\rm{SO_4^{2-}}\)といったイオンが移動します.その移動する理由を考えていきましょう.
負極では,\(\rm{Zn\ →\ Zn^{2+}}\)になることで,\(\rm{[Zn^{2+}] > [SO_4^{2-}]}\)となります.(\(\rm{[SO_4^{2-}]}\)は増加していません!)
そのため,陽イオンが相対的に過剰になります.
一方で正極では,\(\rm{Cu^{2+}\ →\ Cu}\)になることで,\(\rm{[Cu^{2+}] > [SO_4^{2-}]}\)となります.(\(\rm{[SO_4^{2-}]}\)は減少していません!)そのため,陰イオンが相対的に過剰になります.
両方のイオンがつり合っていないため,そのバランスを保つためにイオンが移動します.つまり,各溶液中で濃度が高い方が低い方に移動します.ダニエル電池であれば,\(\rm{Zn^{2+}}\)が陰極から正極に,\(\rm{SO_4^{2-}}\)が正極から陰極に移動します.
ここからは少し難しい話になるので,参考です.興味がある人は読んでみると,知識が深まりますよ!
先ほども説明したように,水溶液中では,\(\rm{Zn^{2+}}\)と\(\rm{SO_4^{2-}}\)が移動しています.その移動速度については,\(\rm{SO_4^{2-}}\)の方が少し速いです.\(\rm{SO_4^{2-}}\)の方が移動速度が速いと,\(2\)つの溶液に電位差が生じます.(これを液間電位といいます.)\(\rm{ZnSO_{4aq}}\)により陰イオンが集まり,\(\rm{CuSO_{4aq}}\)により陽イオンが集まるため,\(\rm{ZnSO_{4aq}}\)の方がより低い電位となります.
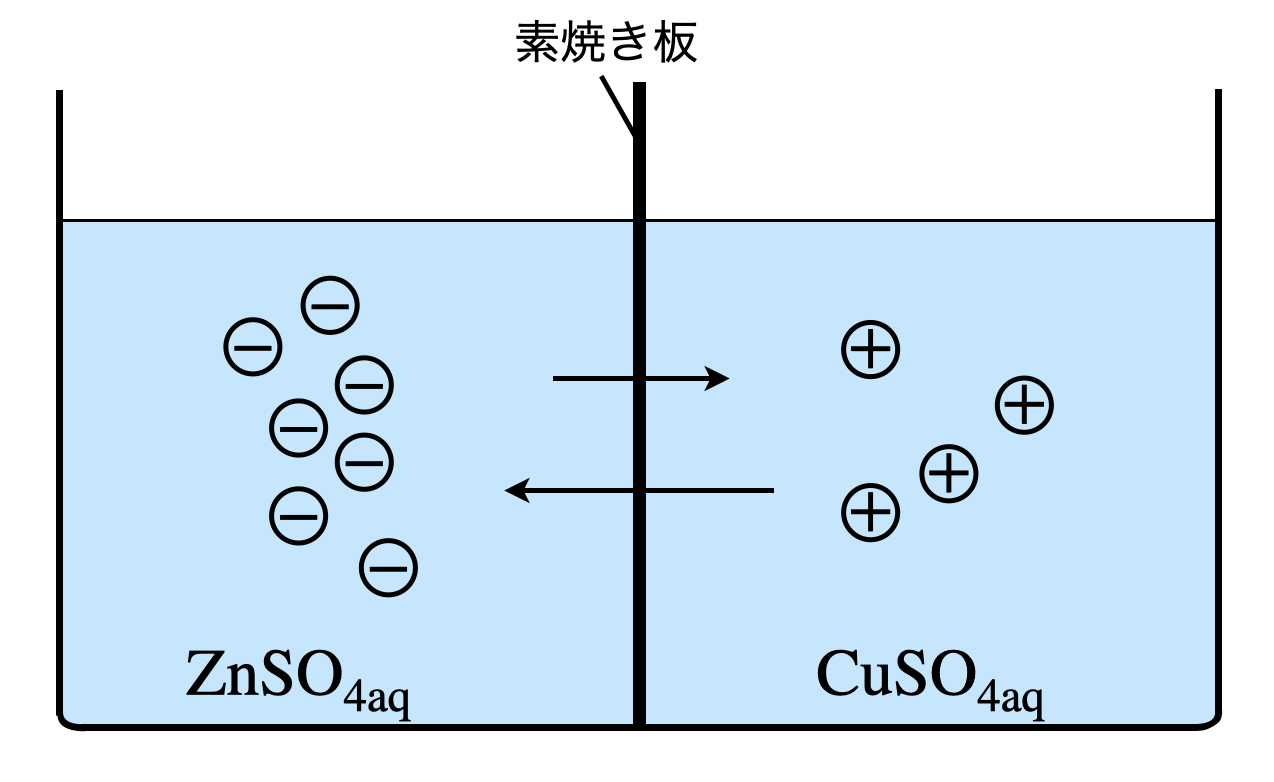
\(\rm{ZnSO_{4aq}}\)と\(\rm{CuSO_{4aq}}\)の間に電位差が生じるため,より\(\rm{SO_4^{2-}}\)の移動が速くなり,\(\rm{Zn^{2+}}\)の移動が遅くなります.これをずっとそのままにしておくと,分極が生じてしまいます.これを解決するには,塩橋という方法があります.
起電力をUpさせる方法
電池の起電力を\(\rm{up}\)させるためには,ル・シャトリエの原理からそれぞれの電極での反応がより右へ行きやすくするようにすればよいことがわかります.
負極:\(\rm{Zn\ →\ Zn^{2+}\ +\ }\)\(2e^-\)
正極:\(\rm{Cu^{2+}\ +\ }\)\(2e^-\ →\ \rm{Cu}\)
負極については,\(\rm{Zn^{2+}}\)が小さければより右に反応が進みます.つまり,\(\rm{ZnSO_4}\)の濃度が薄いほど,\(\rm{Zn}\)のイオン化が起こりやすくなります.
正極については,\(\rm{Cu^{2+}}\)が大きければより右に反応が進みます.つまり,\(\rm{CuSO_4}\)の濃度が濃いほど,\(\rm{Cu^{2+}}\)が\(\rm{Cu}\)に戻りやすくなります.
次回は,鉛蓄電池や燃料電池について解説していきます!



コメント