今回のメニューです。
✅化学反応式の作り方
✅化学反応式の意味
今回の記事では、化学反応式の作り方を徹底解説しています。
イラストや例えを多く用いて初学者にも分かりやすいように解説していますが、もっと分かりやすく解説してほしいという部分がありましたら、遠慮なくブログのコメントまでご連絡ください!
解説してほしい分野があればぜひ次の記事のコメント欄で教えてくださいね!

私はYouTubeでも高校化学の解説をしているので、ぜひそちらもご覧ください。
そもそも化学反応式ってなに?
化学という科目は、ある物質同士をくっつけたり、引き離したりする学問です。
つまり、反応前と反応後の物質を考える必要があります。
そのときに重要なのが、化学反応式です。
例えば、下のような化学反応式を見てみましょう!
\(\rm{C_2H_4 + 3O_2 → 2CO_2 + 2H_2O}\)
この化学反応式を見ると、エチレン(\(\rm{C_2H_4}\))が酸素(\(\rm{O_2}\))と反応することで二酸化炭素(\(\rm{CO_2}\))と水(\(\rm{H_2O}\))に変化することがわかります。
それだけではありません。
化学反応式の係数を見ると、エチレン分子\(1\)個と酸素分子\(3\)個が反応して、結果として二酸化炭素分子\(2\)個と水分子\(2\)個が生成されることもわかります。
これを図にして、考えてみましょう。
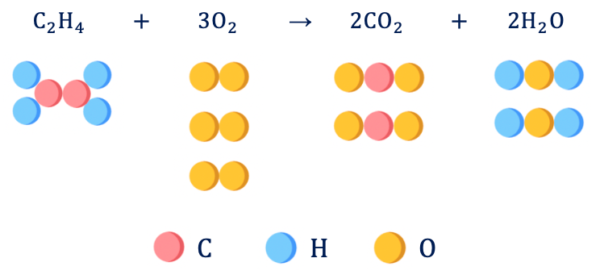
このように、各原子の繋がりを切断して他の原子とつながる変化を化学変化、つまり化学反応といいます。
そしてその変化がわかるように書いたものを化学反応式といいます。
化学反応式の係数の求め方
まずは化学反応式の書き方を下の問題を例として\(3\)ステップで解説していきます。
アンモニアと酸素が反応することで、一酸化窒素と水が生成した。
このときの化学反応式は?
テストでは、このような文が出てきて、化学反応式を求められることがあります。
ステップ\(1:\)反応に出てくる物質を書き出す
化学反応式を書くためには、まず→を真ん中に書きます。
そして反応する物質(反応物)を→の左側(左辺)に、反応した結果生じた物質(生成物)を→の右側(右辺)に書きます。
今回の問題では、反応物がアンモニア(\(\rm{NH_3}\))と酸素(\(\rm{O_2}\))、生成物が一酸化窒素(\(\rm{NO}\))と水(\(\rm{H_2O}\))になります。
これらを→を使って書くと、以下のようになります。
\(\rm{NH_3\ +\ O_2\ →\ NO\ +\ H_2O}\)
ステップ\(2:\)化学反応式の両辺の原子の数を合わせる
先ほどの化学反応式を見ると、両辺の原子数が一致していないことがわかります。
化学反応の前後で、原子がどこかに飛んでいってなくなる、ということはないので、
化学反応の前後で原子数は同じになる必要があります。
そこで各物質の前に係数をつけることで、両辺の原子数を合わせていきます。
ここでポイントが\(2\)つあります。
そうすることで、手際よく係数合わせをすることができます。
\(2\)つ目は、\(\rm{O}\)原子は後回しにすることです。
この理由は\(\rm{O}\)原子はよく他の物質と反応して、化学反応式のいろんなところに登場するからです。
そのため、\(\rm{O}\)原子は最後に係数合わせをした方が手際よく係数合わせをすることができます。
このようなちょっとしたテクニックを知っておくだけで、他の受験生と圧倒的な差をつけることができるので、
ぜひ使っていきましょう!
今回の場合、
\(\rm{N:1+1=2}\)
\(\rm{H:3+2=5}\)
なので、
\(\rm{N→H→O}\)の順に考えていきます。
\(\rm{N}\)
\(\rm{NH_3}\)の係数を\(1\)として考えると、左辺が\(1\)なので、右辺も\(1\)となります。
\(1\)\(\rm{NH_3\ +\ O_2\ →\ }\)\(1\)\(\rm{NO\ +\ H_2O}\)
ここでは便宜上、係数が\(1\)でも明記していますが、実際の答案では書いてはいけないので、ここだけ注意してくださいね!
\(\rm{H}\)
左辺には\(\rm{H}\)原子が\(3\)個あります。
そのため、右辺も\(3\)個にする必要があります。
ここで\(\rm{H_2O}\)分子にはすでに\(\rm{H}\)原子が\(2\)個あるので、\(\large \frac{3}{2}\)倍すれば\(\rm{H}\)原子が\(3\)個となります。
\(\rm{1NH_3\ +\ O_2\ →\ 1NO\ +\ }\)\(\large \frac{3}{2}\)\(\rm{H_2O}\)
\(\rm{O}\)
最後に、\(\rm{O}\)原子の係数を合わせればゴールです!
先に右辺から数えましょう。
右側は\(1 + \large \frac{3}{2} \small = \large \frac{5}{2}\)なので、左側も\(\large \frac{5}{2}\)にする必要があります。
\(\rm{O_2}\)原子はすでに\(\rm{O}\)原子が\(2\)個あるので、\(\large \frac{5}{4}\)倍すれば\(\rm{O}\)原子が\(\large \frac{5}{2}\)個になります。
\(\rm{1NH_3\ +\ }\)\(\large \frac{5}{4}\)\(\rm{O_2\ →\ 1NO\ +\ \large \frac{3}{2} \small H_2O}\)
つまり、最後に\(\rm{O_2}\)が単独で現れるので、そこで係数を調整すれば\(\rm{OK}\)というわけです!
ステップ\(3:\)化学反応式に分数があれば解消する
化学反応式を解答するときに、係数は整数にする必要があります。
そこで先ほど求めた係数の分母の最小公倍数を化学反応式全体にかけることで、係数をすべて整数にします。
今回であれば、全体を\(4\)倍しましょう!
\(\rm{4NH_3\ +\ 5O_2\ →\ 4NO\ +\ 6H_2O}\)
化学反応式を作るのに3ステップと思うと多く見えますが、慣れると簡単にできるようになりますよ!
何度も練習していきましょう!
化学反応式の意味
ではここで、化学反応式の意味を考えてみましょう。
先ほどの化学反応式をもう一度書いてみます。
\(\rm{4NH_3 + 5O_2 → 4NO + 6H_2O}\)
この反応式を見ると、アンモニア\(\rm{NH_3\ 4}\)分子と酸素\(\rm{O_2\ 5}\)分子が反応して、一酸化窒素\(\rm{NO\ 4}\)分子と水\(\rm{H_2O\ 6}\)分子が生成していることがわかります。
ここで、それぞれの比で各分子が大量に存在するとします。
そしてそれらをモル\(\rm{BOX}\)に入れていくとすると、下の図のようにモル\(\rm{BOX}\)の数は係数比と同じになります。
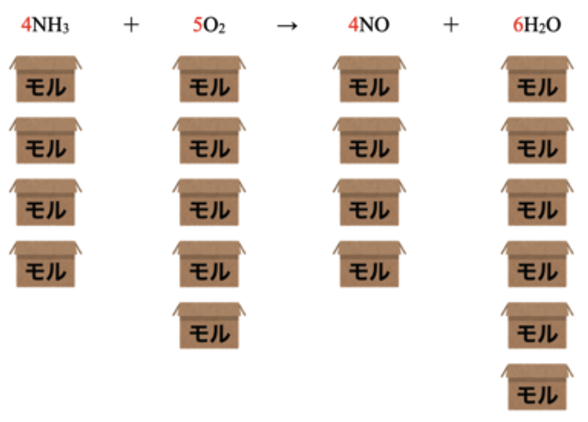
つまり化学反応式の係数比は、各物質量の比(モル比)を表しているということになります。
そしてモル比がわかると、粒子数や質量、体積もわかるというわけです!
ここで,注意してもらいたいことが\(1\)点あります.
上の図を見るとわかるのですが、反応の前後で原子の種類と総数が変化しないということです。
これをドルトンの原子説といいます。
各物質量の比(モル比)を表す
まとめ
今回は、化学反応式の作り方についてどこよりもわかりやすく徹底解説しました。
\(3\)ステップでどんな化学反応式も作ることができるので、ぜひマスターしてくださいね!
また化学反応式を作る際のポイントとして、
✅登場する回数の少ない原子に着目する
✅\(\rm{O}\)原子は後回しにする
この\(2\)つをマスターすることで、無駄なく化学反応式が作れるようになるので、ぜひ覚えておきましょう!
私はYouTubeでも高校化学の解説をしているので、ぜひそちらもご覧ください。


コメント