今回のメニューです!
✅原子の表記法
この記事を読むことで、化学の基礎である原子の構造については完全に理解できます!
ぜひ最後まで読んで、重要な2つの図を覚えてくださいね!
理論化学の中での原子の構造のポジションを確認しておきましょう。
原子の構造は、「物質の構造」の中の「原子の構造」に関する項目です。
原子の構造はこれから学んでいく化学の核となる部分で、各反応を考える際にも重要になるので、しっかりと理解していきましょう。
原子とは
私たちの身の回りのものはすべて小さなツブから構成されています。
そのツブのことを原子といいます。
現在確認されている原子の種類は118種類であり、これらの原子がそれぞれ異なる原子とくっつく(結合する)ことで色々な性質があらわれます。
まずは原子の構造について徹底解説していくので、ぜひ一緒に勉強していきましょう!
原子の構造
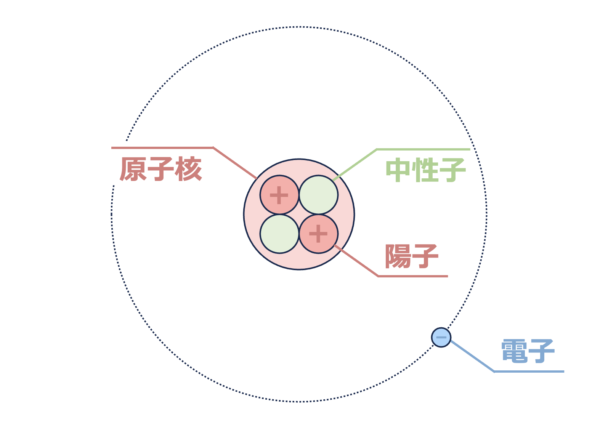
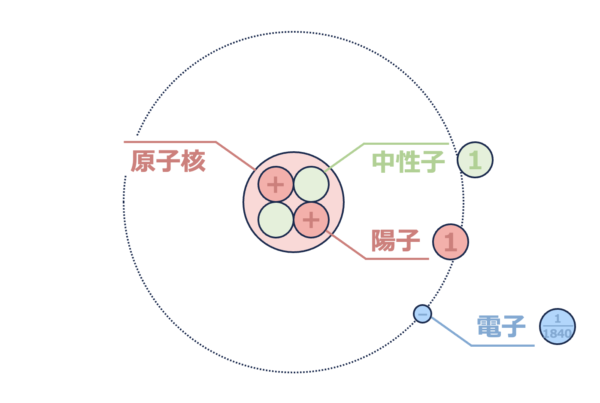
原子の構造を理解するには、下の図が重要になります!
この図に原子の全てが詰まっています。
1つずつ詳しく見ていきましょう。
原子核(陽子・中性子)
原子の中心には、プラスの電荷をもつ陽子と電荷をもたない中性子が存在しています。
そのため、原子核は全体としてプラスの電荷を帯びています。
電子
一方で、原子核のまわりをマイナス電荷をもつ電子がグルグルまわっています。
原子全体としては電気的に中性なので、電子数は原子核にある陽子数と同じになります。
原子の質量
陽子、中性子、電子の質量はそれぞれ下の表のようになります。
これをそれぞれ比で見ていくと、陽子や中性子に比べて電子は極めて小さく、\(\large \frac{1}{1840}\)程度です。
この質量比は質量数を考える際に非常に重要になるので、ぜひ理解しておきましょう。
| 質量 [\(\rm{g}\)] | 比率 | |
| 陽子 | \(1.673×10^{-24}\) | \(1\) |
| 中性子 | \(1.675×10^{-24}\) | \(1\) |
| 電子 | \(9.109×10^{-28}\) | \(\large \frac{1}{1840}\) |
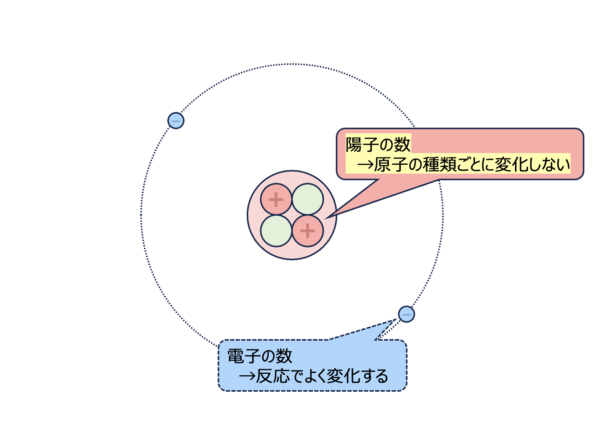
原子番号
原子を考える際のポイントは、陽子の数になります。
化学の勉強をするときは、電子に着目することが多いですが、
化学反応などによって各原子の電子数はよく変化します。
そのため原子の種類ごとに変化しない陽子の数に着目して原子を識別していきます。
このように、原子の化学的な性質を決めるのは陽子なので、陽子の数をその原子の番号(原子番号)といいます。
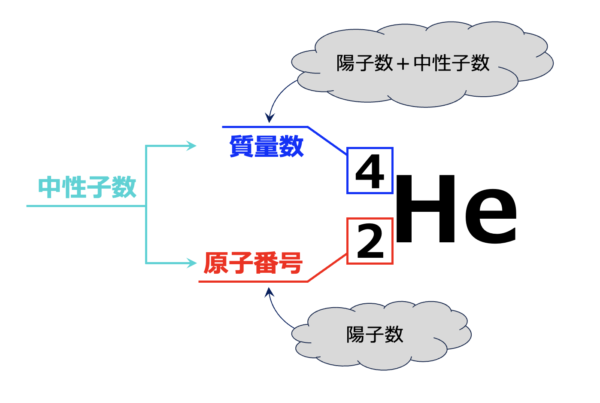
質量数
原子の物理的な性質を決める要素は「質量」になります。
原子の各パーツの質量比は先ほど説明したように、以下のようになります。
陽子:中性子:電子\(=1:1:\large \frac{1}{1840} \small =1:1:0.0005\)
これを見ると、陽子や中性子に対して電子はかなり小さいです。
そのため、
原子の質量\(\ =\ \)陽子\(\ +\ \)中性子\(\ +\ \)電子\(\ ≒\ \)陽子\(\ +\ \)中性子
と考えることができます。
つまり、原子の質量は陽子と中性子の質量で考えれば良いことがわかります。
ここで、陽子や中性子の質量はかなり小さいので、計算するのが大変です。
そこで、原子の質量を本当の質量ではなく、「陽子と中性子の粒子数」で表すこととしました。
これを質量数と呼びます。
例えば、ヘリウム(\(\rm{He}\))原子で考えてみましょう。
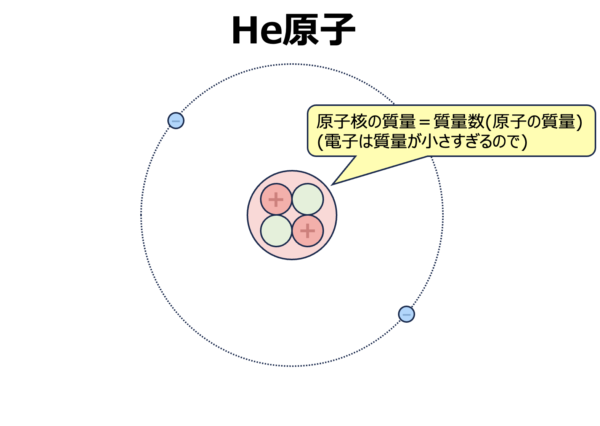
この図を見ると、陽子が\(2\)個、中性子が\(2\)個なので、\(\rm{He}\)原子の質量数は\(2+2=4\)になります。
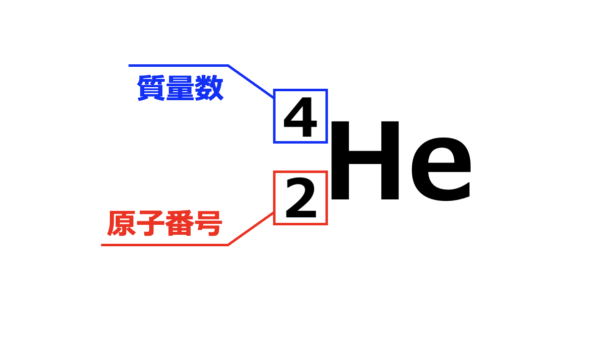
原子の表記
原子の表記方法についてしっかりと覚えておきましょう!
原子は以下のように、
元素記号の左上:質量数(陽子数+中性子数)
元素記号の左下:原子番号(陽子数)
と書きます。
今回の記事で覚えること
最後にまとめとして、今日の内容をまとめた図を作成しました。
この図を覚えることで、今回の解説ページの内容を理解できたことになります!
しっかりと復習してください。
①原子の構造
各構成粒子の名前およびそれぞれの質量比などを下の図で覚えておきましょう。
②原子の表記法
以下の表記方法を見るだけで、陽子数、中性子数、電子数が瞬殺できるように、各パーツ部分の内容を覚えておきましょう。



コメント