
接触法を勉強するときには,「なぜ?」という疑問を持ちやすいですが,その疑問をしっかりと解決します!
それでは今回は\(\rm{S}\)系列を一気に効率よく勉強していきましょう!
\(\rm{S}\)系列の全体像
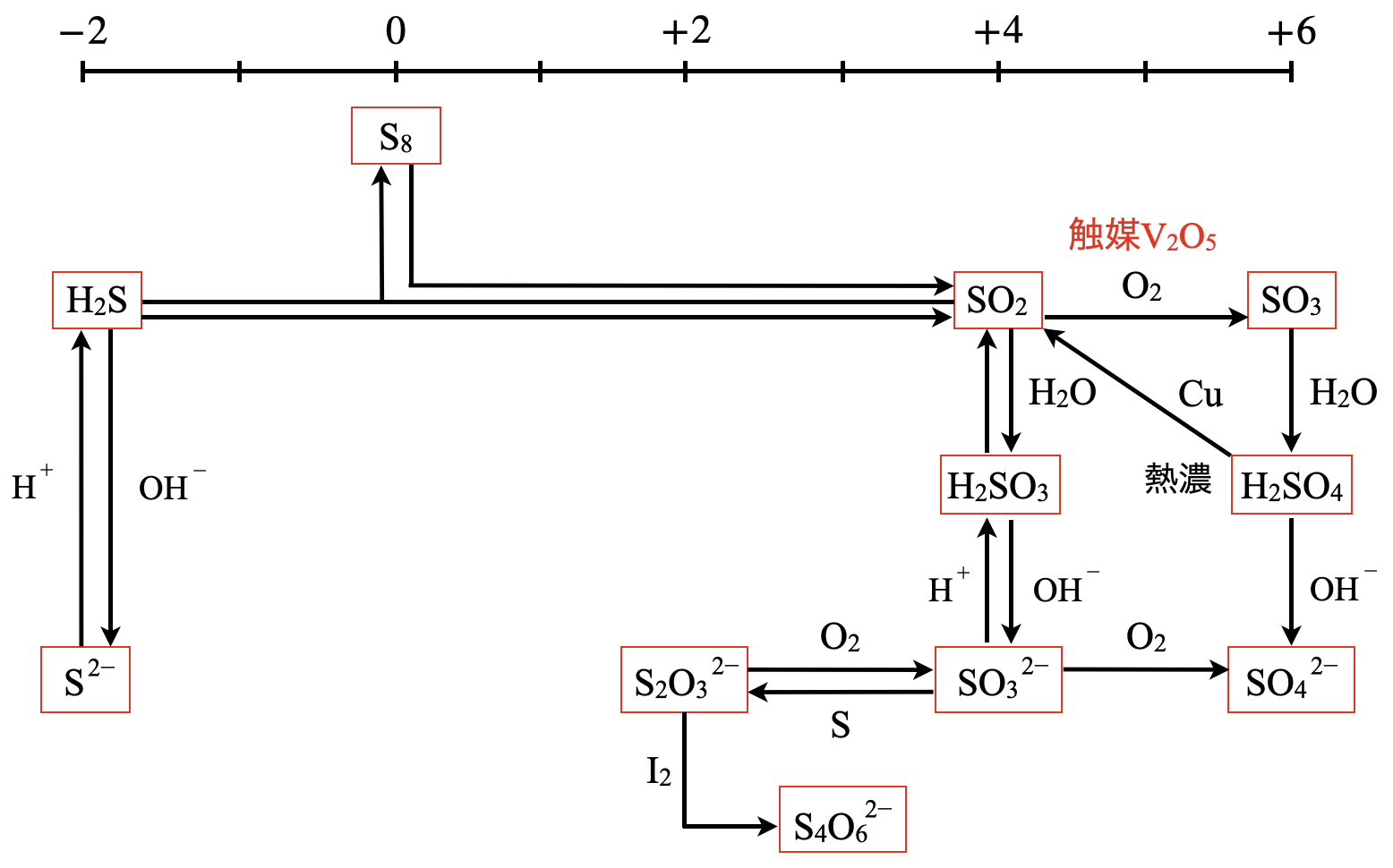
\(\rm{S}\)原子のとりえる酸化数は\(-2\)〜\(+6\)になります.
それでは少しずつ\(\rm{S}\)系列の詳細をみていきましょう!
実験室での気体生成
\(\rm{S}\)系列の気体は\(\rm{H_2S}\)と\(\rm{SO_2}\)になります.
\(\rm{H_2S}\)は同じ酸化数である\(-2\)の\(\rm{S^{2-}}\)に\(\rm{H^+}\)を加えることで生成されます.
また\(\rm{SO_2}\)については\(3\)通りの方法があります.簡単に説明すると,\(\rm{S → SO_2}\),\(\rm{SO_3^{2-} → SO_2}\),\(\rm{H_2SO_4 → SO_2}\)という\(3\)通りです.詳細については,\(\rm{SO_2}\)の項目で詳細に解説していきます!
チオ硫酸ナトリウムの反応についてここでふれておきます!
チオ硫酸ナトリウムはヨウ素のような弱い酸化剤とは,以下のように反応します.この反応は,ヨウ素滴定の際に用いられます.
\(\rm{2Na_2S_2O_3\ +\ I_2\ →\ Na_2S_4O_6\ +\ 2NaI}\)
工業的製法
工業的には\(\rm{S}\)を含む物質を燃やして得られた\(\rm{SO_2}\)を\(\rm{V_2O_5}\)という触媒を用いて酸化します.酸化することで\(\rm{SO_3}\)へと変化し,これを水と反応させることで硫酸を製造しています.この一連の方法を接触法といいます.
詳細については硫酸のところで解説していきますね!
単体の硫黄
単体の硫黄として覚えてほしいものが\(3\)つあります.
それが斜方硫黄・単射硫黄・ゴム状硫黄になります.
ここでの覚え方としては,斜方硫黄・単射硫黄とゴム状硫黄を別々に覚えてください!ゴム状硫黄については,名前の通りゴム状になっていて弾性があります.
問題は斜方硫黄と単射硫黄です.どちらも分子式\(\rm{S_8}\)からなり,八面体状結晶で下のような構造になっています.

単体の硫黄として,最も安定しているのが斜方硫黄になります.単射硫黄については,常温で放置すると,斜方硫黄に変化します.
- 斜方硫黄→最も安定
- 単射硫黄→常温で斜方硫黄に変化
これだけ覚えてもらえれば大丈夫です!
硫化水素
硫化水素\(\rm{H_2S}\)は無色,腐卵臭の有毒気体です.火山ガスや温泉水に含まれているため,温泉に入ったときに,硫黄などの匂いがしたことがあるといった経験をしたことはありますか?
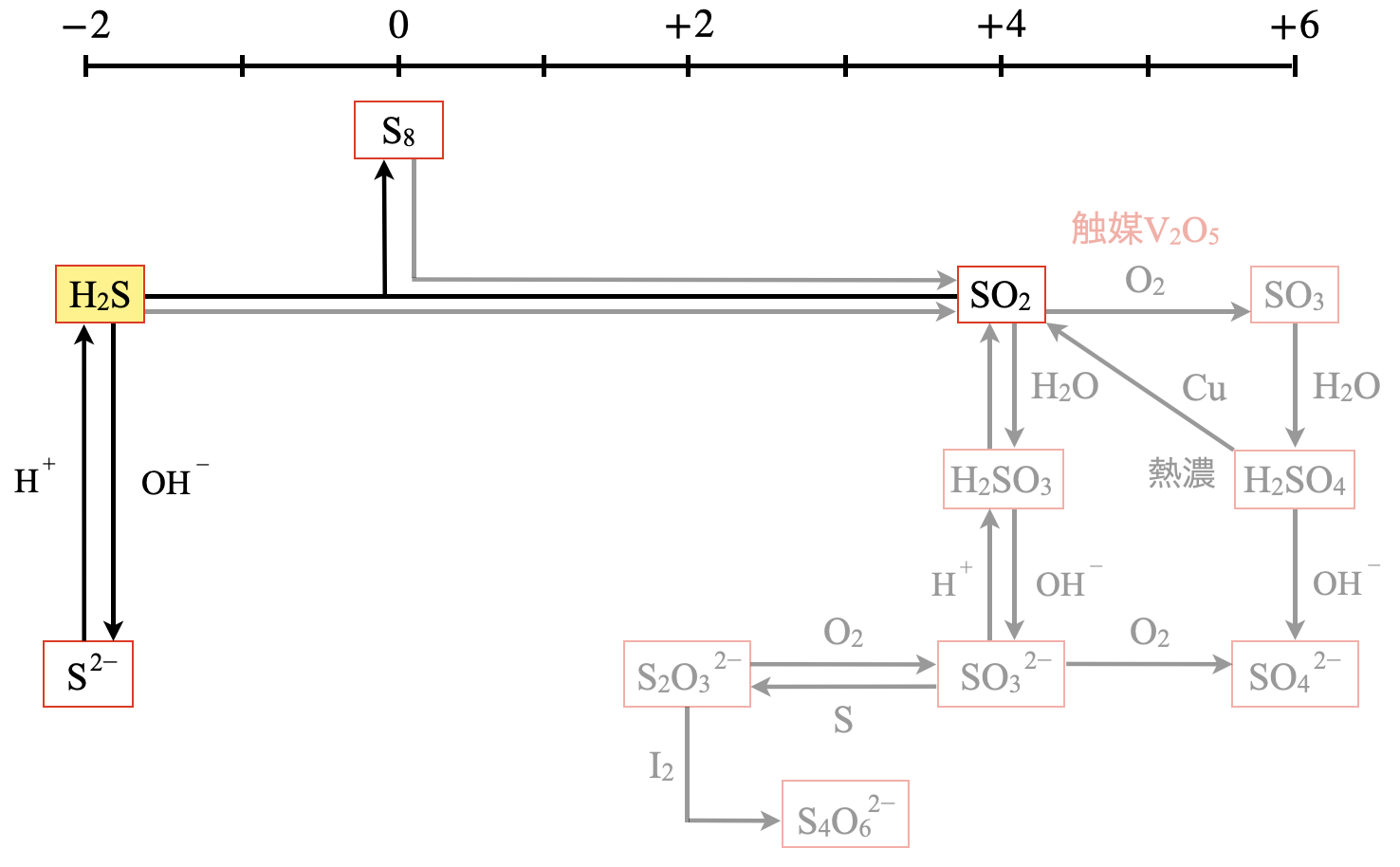
図を見ると,\(\rm{S^{2-}}\)を含む塩(硫化物塩)に\(\rm{H_2S}\)より強い酸を加えれば得られます.
\(\rm{FeS\ +\ H_2SO_4\ →\ FeSO_4\ +\ H_2S↑}\)
また\(\rm{H_2S}\)の水溶液に\(\rm{SO_2}\)を吹き込むと,白濁してきます.これは以下の反応で生じた\(\rm{S_8}\)分子が集合してコロイド粒子よりもさらに大きな粒子になって,光が強く散乱するためです.
\(\rm{2H_2S\ +\ SO_2\ →\ 2H_2O\ +\ 3S↓}\)
二酸化硫黄
二酸化硫黄は無色・刺激臭の有毒気体です.
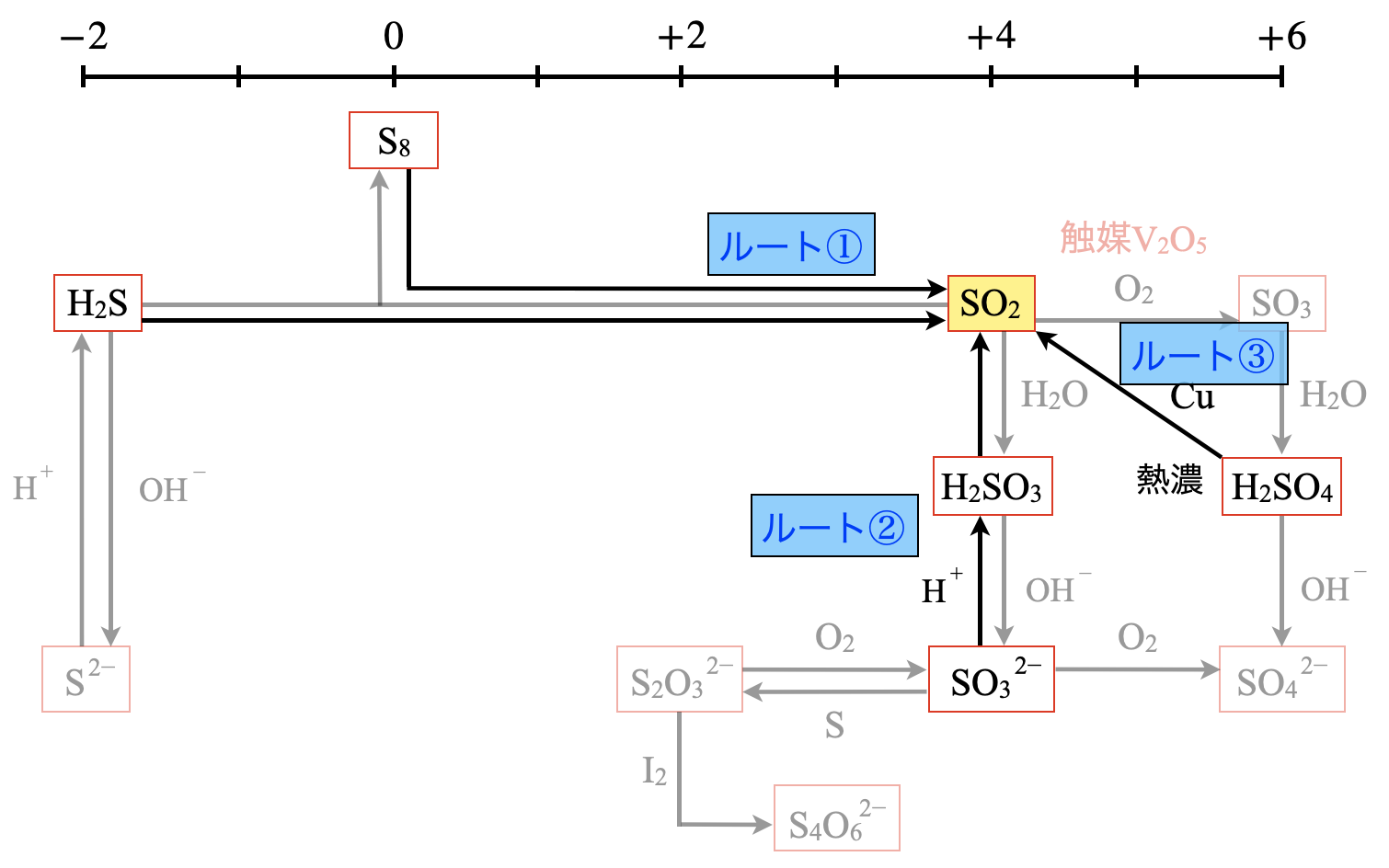
\(\rm{SO_2}\)には\(3\)ルートがあります.
①\(\rm{S}\)化合物の燃焼
\(\rm{S}\)を含む化合物を燃焼させると,\(\rm{S}\)成分はほとんど\(\rm{SO_2}\)となります.
\(\rm{S\ +\ O_2\ →\ SO_2}\)
\(\rm{2H_2S\ +\ 3O_2\ →\ 2SO_2\ +\ 2H_2O}\)
②酸化数\(+4\)からの生成
二酸化硫黄\(\rm{SO_2}\)と同じ酸化数である\(+4\)の\(4\)段目に\(\rm{SO_3^{2-}}\)があります.これを活用して\(\rm{SO_2}\)を生成しましょう.
\(\rm{Na_2SO_3\ +\ H_2SO_4\ →\ Na_2SO_4\ +\ H_2O\ +\ SO_2↑}\)
上の図から,まず\(\rm{SO_3^{2-}\ +\ 2H^+\ ⇄\ H_2SO_3}\)となります.
ところが,液中で生じた亜硫酸\(\rm{H_2SO_3}\)は,そのままの形で取り出すことはできません.\(\rm{H_2SO_3}\)の濃度がある程度以上になると,以下の平衡が右に移動して\(\rm{SO_2}\)と\(\rm{H_2O}\)に分解してしまいます.
\(\rm{H_2SO_3\ ⇄\ H_2O\ +\ SO_2↑}\)
そのため\(\rm{SO_2}\)が生成します.
③酸化数\(+6\)からの生成
酸化数\(+6\)から\(\rm{SO_2}\)を生成することも可能です.ただし,\(\rm{H_2SO_4}\)は極めて安定な分子のため,熱濃硫酸(濃硫酸をどんどん加熱して反応を促進させる条件)でないと酸化剤として働きません.還元剤の相手として覚えておいてほしいのが\(\rm{Cu}\)です.
\(\rm{Cu\ +\ 2H_2SO_4\ →\ CuSO_4\ +\ SO_2↑\ +\ 2H_2O}\)
硫酸
硫酸の工業的製法は,接触法と呼ばれます.
原料ガスを固体触媒と接触させるため,接触法と呼ばれています.
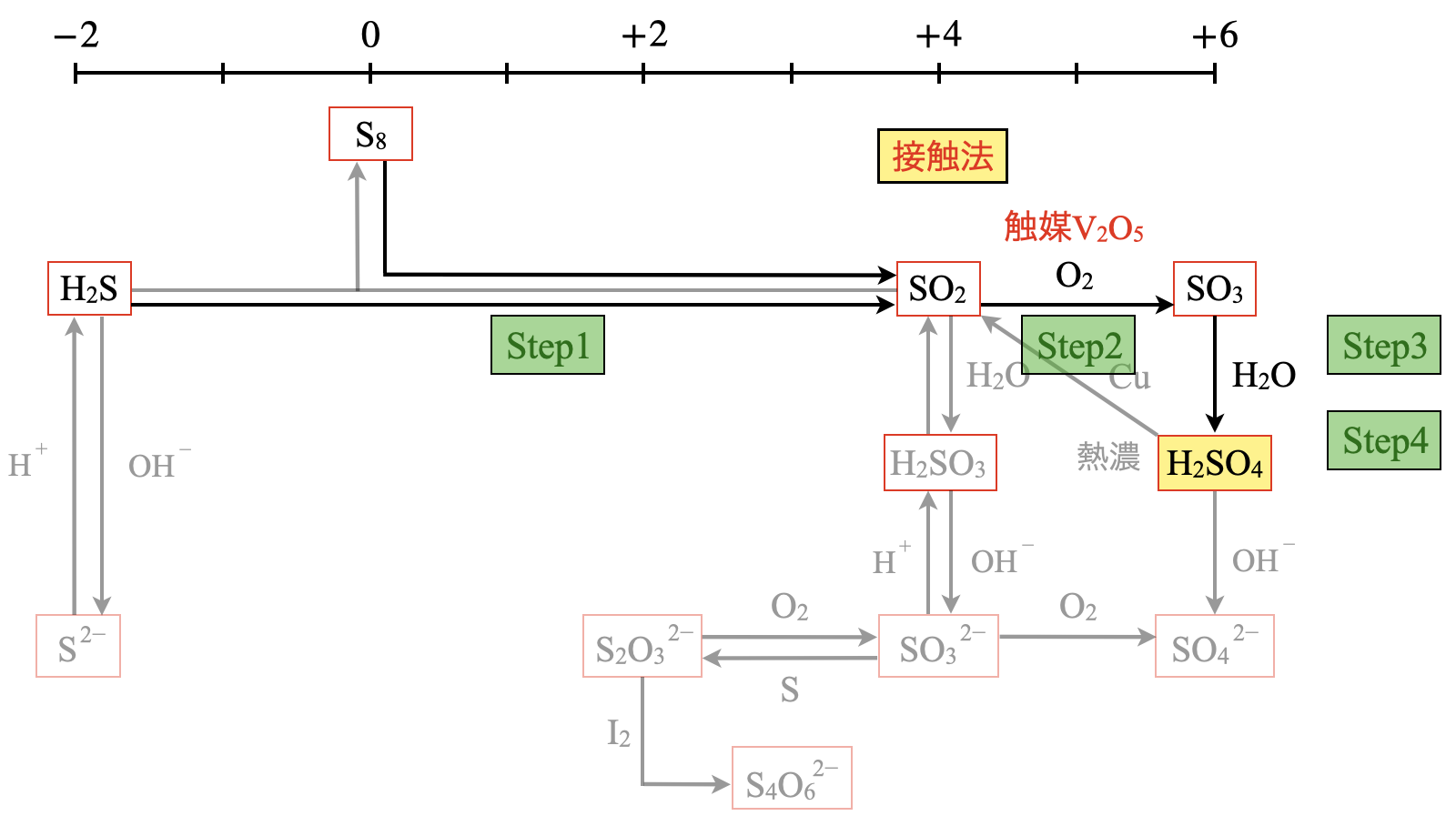
この接触法は以下の\(4\)ステップで解説します!
\(\rm{Step2:SO_2→SO_3}\)
\(\rm{Step3:SO_3→}\)発煙硫酸
\(\rm{Step4:}\)発煙硫酸\(\rm{→H_2SO_4}\)
このように長い反応を理解するときには,最初に全体の流れをおさえるようにしましょう!
\(\rm{Step1:SO_2}\)の生成
硫黄\(\rm{S}\)または黄鉄鉱(二硫化鉄:\(\rm{FeS_2}\))を燃焼させて,二酸化硫黄\(\rm{SO_2}\)を生成します.
\(\rm{S\ +\ O_2\ →\ SO_2}\)
\(\rm{4FeS_2\ +\ 11O_2\ →\ 2Fe_2O_3\ +\ 8SO_2}\)
\(\rm{Step2:SO_2→SO_3}\)
\(\rm{2SO_2\ +\ O_2\ ⇄\ 2SO_3\ +\ 184\ kJ}\)
この可逆反応で\(\rm{SO_3}\)の生成率を高めるためには,ルシャトリエの原理より低温・高圧とします.しかしながら,工業的に高圧で反応させるのは非常に大変なことですし,低温で反応させると反応速度の低下を招いてしまいます.
ここで,酸化バナジウム(\(\rm{V}\))\(\rm{V_2O_5}\)と呼ばれる触媒を用いて反応させます!
この触媒は非常に重要なので必ず覚えてくださいね!
\(\rm{Step3:SO_3→}\)発煙硫酸
\(\rm{SO_3}\)を水\(\rm{H_2O}\)と反応させることで,\(\rm{H_2SO_4}\)が生成されると思うかもしれません.
この反応では多量の熱が発生してしまうため,水で反応させると水が沸騰してしまいます…水が沸騰してしまうと,生じた水蒸気に\(\rm{SO_3}\)が溶け込み,細かな硫酸の霧となって空気中に散らばり,非常に危険な状態となってしまいます……
このようになると,空気中に拡散されてしまい,溶液中の水にはほとんど溶解しないため,液体として\(\rm{H_2SO_4}\)を取り出すことができません.
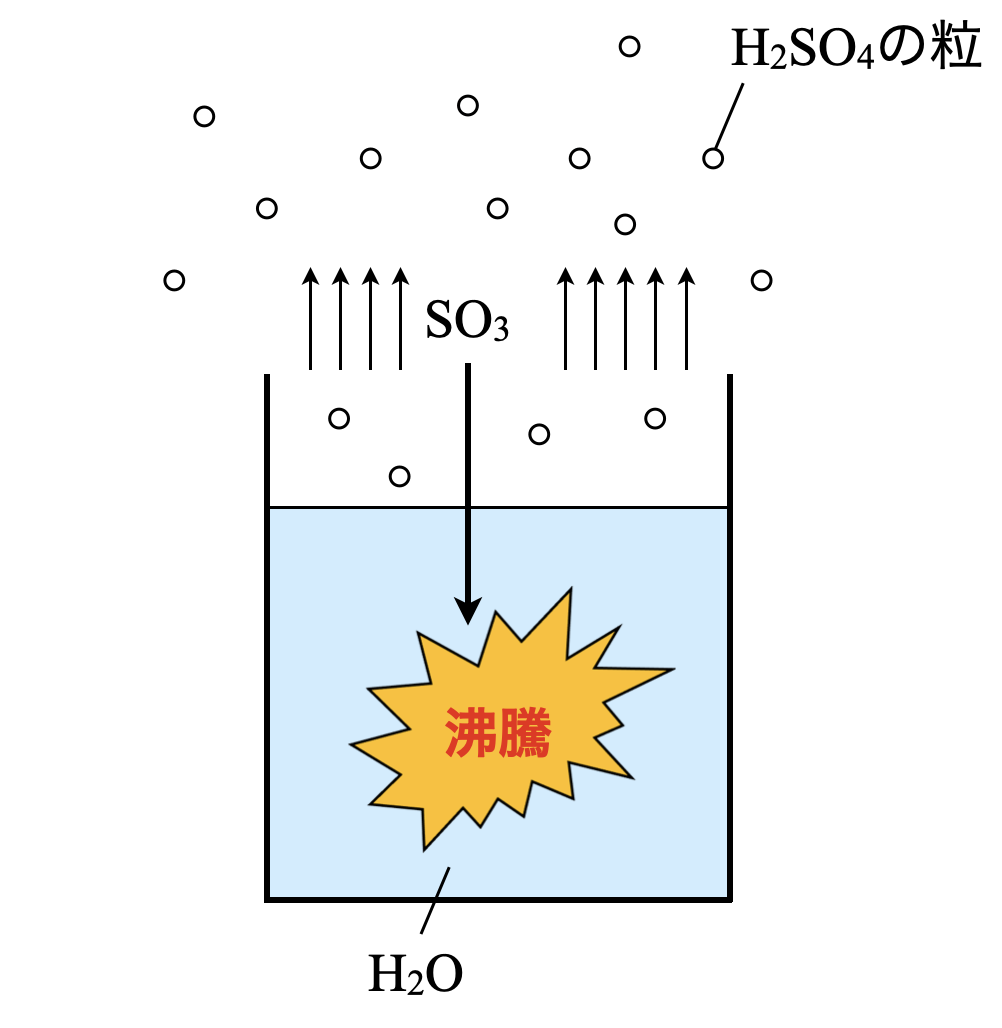
\(\rm{H_2SO_4}\)を上手に取り出せなかった原因はどこにあるのでしょうか?
それは「水\(\rm{H_2O}\)に溶解させた」ということです.
そこで,濃硫酸中に含まれる水へ\(\rm{SO_3}\)を溶解させてみましょう.すると発熱を抑えることができます.\(\rm{SO_3}\)を\(\rm{H_2SO_4}\)に溶解させたものを発煙硫酸といいます.
\(\rm{SO_3 + H_2O → H_2SO_4}\)
ここでの\(\rm{H_2O}\)は濃硫酸中に含まれる水を表しています.
ここは私が受験時代につまずいたポイントなので書いておきますね!
濃硫酸中に水なんてあるの?と当時の私は思っていました.
例えば,\(98\%\)硫酸というときには,\(98\%\)は\(\rm{H_2SO_4}\)ですが,\(2\%\)は\(\rm{H_2O}\)となっています.そのため,この\(2\%\)の\(\rm{H_2O}\)を使って,\(\rm{SO_3}\)と反応させる!という意味合いになります!
硫酸を生成するのに,硫酸を使うの?と思われるかもしれません…
私も全く同じことを思いました笑
ここで,頭に入れておいてほしいのは,今学んだいるのは硫酸の工業的製法である!ということです.
これは実験室で新たな物質を作り出したいのではなく,工業的に大量に安く作ることができれば\(\rm{OK}\)!ということなのです.そのため,硫酸を生成するときに,少量の硫酸を使うというのも\(\rm{OK}\)というわけです.
\(\rm{Step4:}\)発煙硫酸\(\rm{→H_2SO_4}\)
最後に,発煙硫酸を希硫酸で希釈することで,所定の濃度の硫酸にします.発煙硫酸はかなり濃度が高いので,希硫酸を使うことで,ある程度マイルドにしてから出荷されるというわけですね!
最後にこの接触法の一連の反応式を示しておきます!
\(\rm{Step1}\)の反応式を\(2\)倍にすると,あとは足し算を考えることで作ることができます.
\(\rm{2S\ +\ 2O_2\ +\ 2H_2O\ →\ 2H_2SO_4}\)
両辺を\(2\)で割って
\(\rm{S\ +\ O_2\ +\ H_2O\ →\ H_2SO_4}\)
濃硫酸の性質
濃硫酸で覚えておいてほしい特徴が\(4\)つあります.これはテストでもよく問われるので,確実に答えられるように暗記しておきましょう!
①脱水性
②吸水性
③酸化作用
④不揮発性
①脱水性
有機化合物の脱水に用いることがあります.例えば,ショ糖などから炭素\(\rm{C}\)まで生成することができます.
\(\rm{C_{12}H_{22}O_{11}\ →\ 12C\ +\ 11H_2O}\)
②吸水性
気体の乾燥剤などに使われます.
③酸化作用
\(\rm{Cu}\)などを酸化して溶解します.
④不揮発性
\(\rm{H_2SO_4}\)の不揮発性を利用することで,揮発性の酸(蒸発しやすい酸)を取り出します.
この詳細については,今後説明しますね!
とりあえず,硫酸には不揮発性がある!ということだけ覚えておいてくださいね!
練習問題
硫酸に関してぜひ解けるようになってほしい問題を厳選しました.一緒に頑張って解いていきましょう!
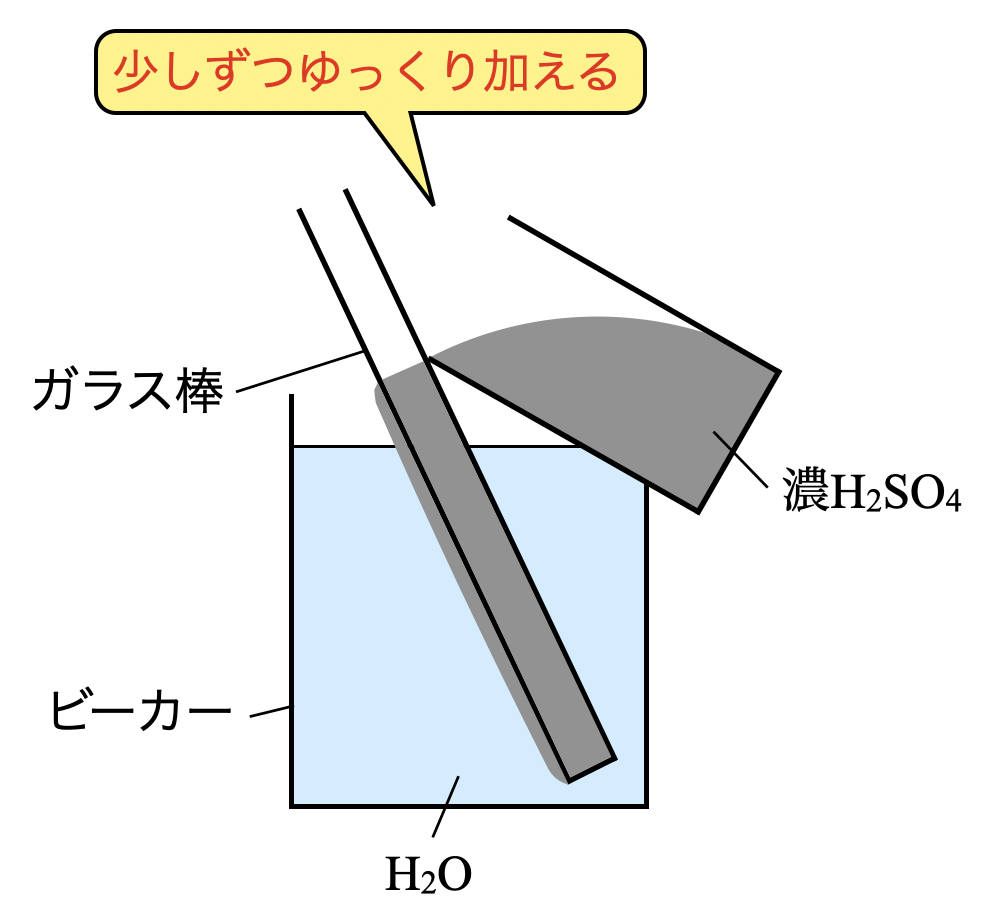
(\(1\))濃硫酸から希硫酸へと希釈するときの操作で注意すべきことは?
(\(2\))硫黄\(\rm{1.0\ kg}\)を完全に硫酸に変えたとすると,\(98\%\)硫酸は何\(\rm{kg}\)できるか?\(\rm{H_2SO_4 = 98}\)とする.
(\(3\))黄鉄鉱(主成分:\(\rm{FeS_2}\),純度\(90\%\))\(\rm{1.0\ kg}\)から\(98\%\)濃硫酸は最大何\(\rm{kg}\)得られるか?\(\rm{FeS_2 = 120}\)とする.
(\(1\))
濃硫酸を希釈するときには,\(\rm{H_2SO_4}\)と\(\rm{H_2O}\)を混合すればよいのですが,混合する際に大量の熱が発生して非常に危険な状態となるのでしたね.
また濃硫酸は水よりも重いため,濃硫酸に水を加えると,濃硫酸の表面上の水が沸騰して飛び散ってしまう危険性があります.
そのため,必ず水に濃硫酸をゆっくり加える必要があります.
(\(2\))
硫酸の工業的製法である接触法について一連の反応式をまとめました.これを再び書くと下のようになります.
\(\rm{S\ +\ O_2\ +\ H_2O\ →\ H_2SO_4}\)
これを見ると,\(\rm{S→H_2SO_4}\)は\(1:1\)の関係であることがわかります.
この問題は頻出なので,自分のパターンを作ってしまいましょう!私は下のような図を必ず書いて混乱しないようにしています!
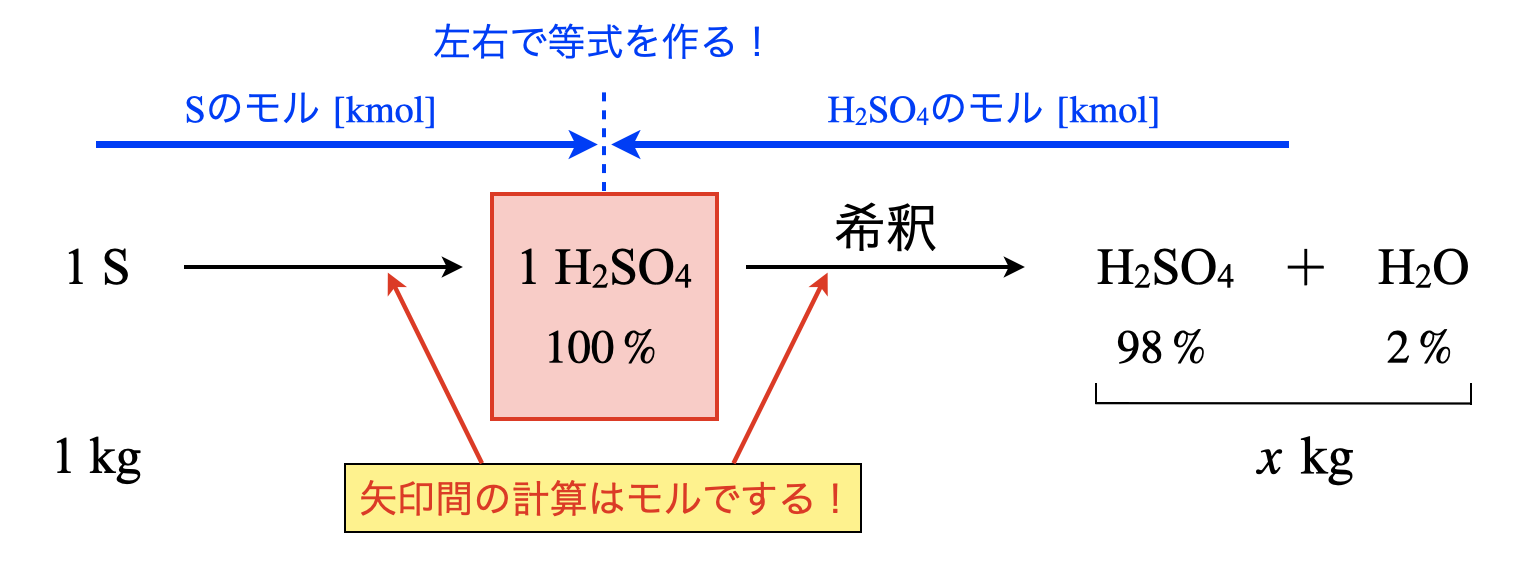
これを見ると,(\(\rm{S}\)のモル [\(\rm{kmol}\)])=(\(\rm{H_2SO_4}\)のモル [\(\rm{kmol}\)])という関係式を作ればよいことがわかります.\(98\%\)硫酸が\(x\ [\rm{kg}]\)できるとすると,
\(\large \frac{1.0}{32} \small = \left( x × \large \frac{98}{100} \right) \small × \large \frac{1}{98}\)
\(\rm{H_2SO_4}\)のモルについては,まず\(98\%\)の質量 \(\rm{[kg]}\)を求めています.それが\(x × \large \frac{98}{100}\)という意味です.そしてそのモルを求めています!
これを解くと,
\(x = 3.1\ \rm{kg}\)
となります.
(\(3\))
次は少し複雑ですが,テンプレの図を書ければこっちのものです!
まずは,\(\rm{FeS_2→H_2SO_4}\)がどのような繋がりになっているかを見てみましょう!硫酸の接触法の反応式から\(\rm{1FeS_2 → 2H_2SO_4}\)になっていることがわかります.
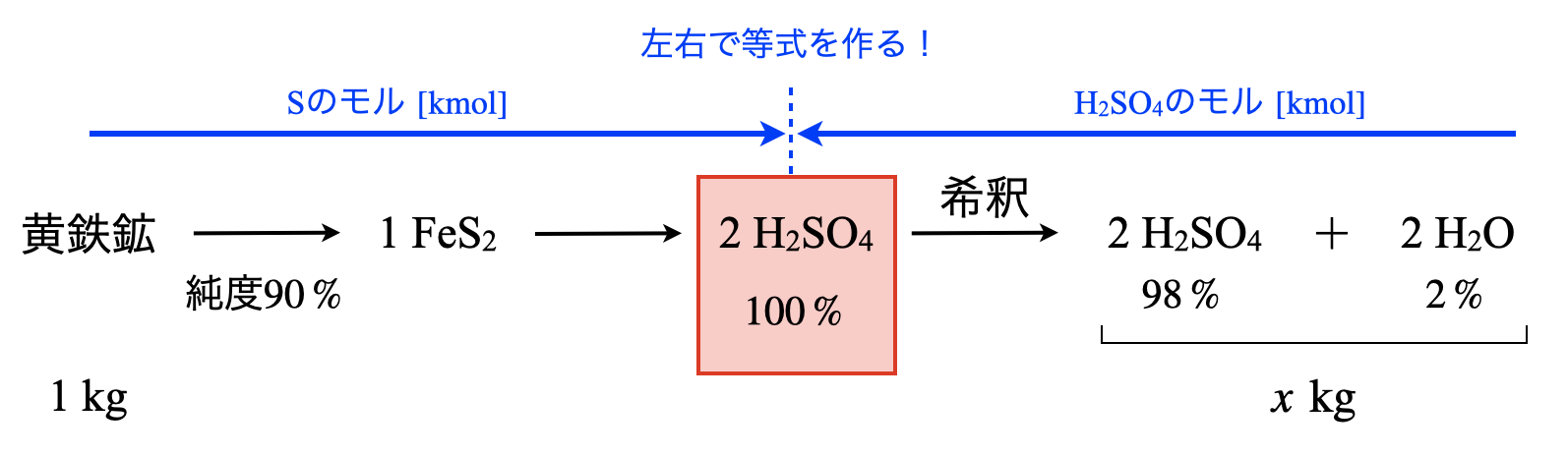
これを見て,(\(\rm{FeS_2}\)のモル [\(\rm{kmol}\)])\(× 2 = \)(\(\rm{H_2SO_4}\)のモル \(\rm{[kmol]}\))という関係式を作っていきます!
\(1 × 0.9 × \large \frac{1}{120} \small × 2 = \left( x × \large \frac{98}{100} \right) \small × \large \frac{1}{98}\)
これを解くと,
\(x = 1.5\ \rm{kg}\)
となります.
このようにテンプレートを自分で使いこなして得点アップしていきましょう!
今日は以上となります!
今日も覚えることが多くて大変ですが,覚えるときにはなぜそうなるのか?を必ずおさえながら覚えるようにしてくださいね!
今後も「なぜ」を詳しく解説していきます!



コメント