
それでは今日も頑張っていきましょう!
芳香族とは?
\(\rm{C}\)原子が「輪」を作る環式化合物のうちベンゼン環を含むものを芳香族化合物といいます.
ベンゼン環について知っておくべきことを下にまとめておきましょう!
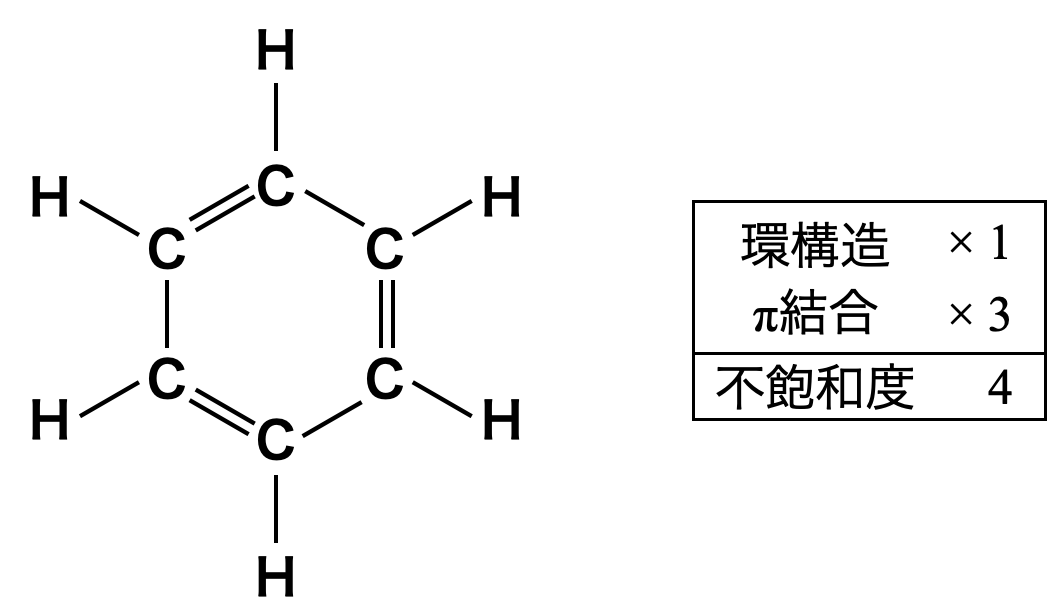
構造決定の際に必要となる不飽和度と分子量が重要になります.ベンゼン環の不飽和度は,環構造が\(1\)つと\(\pi\)結合が\(3\)つで,\(4\)となります.またベンゼンの分子式は\(\rm{C_6H_6}\)で,分子量は\(78\)となります.
ベンゼン環に他の原子団が置換されていた場合もこのように考えることができます.例としてサリチル酸の分子量を考えてみましょう!
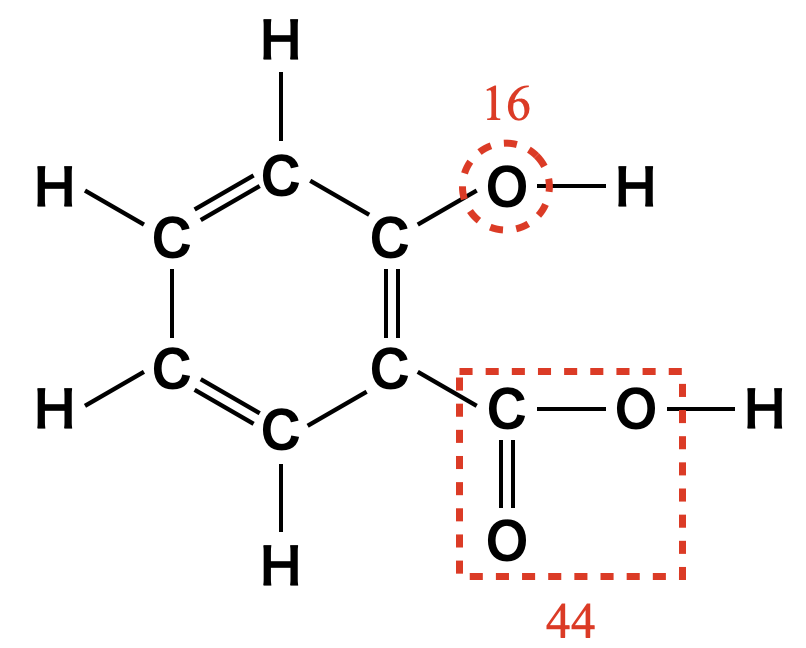
このようにすると,ベンゼン環が\(78\),\(\rm{-O-}\)が\(16\),\(\rm{-COO-}\)が\(44\)です.そのためサリチル酸の分子量は\(138\)となります.\(\rm{OH}\)基の\(\rm{H}\)と\(\rm{COOH}\)の\(\rm{H}\)はベンゼン環でカウントしてます!
ベンゼン環の構造
まずはベンゼン環に関する基礎知識をおさえていきましょう!
ベンゼン環の構造は,ケクレ構造と呼ばれています.ベンゼン環では,各\(\rm{C}\)原子のもつ\(4\)個の価電子のうちの\(1\)個(\(\pi\)電子と呼ばれています)が下の図のように広がっていると考えられています.これを非局在化といいます.このように\(\pi\)電子の非局在化した状態を共鳴と呼びます.

フェノールの性質
芳香族の分類でよく出題される物質の性質を詳しくみていきましょう.
まずはフェノールからです!
フェノールの弱酸性
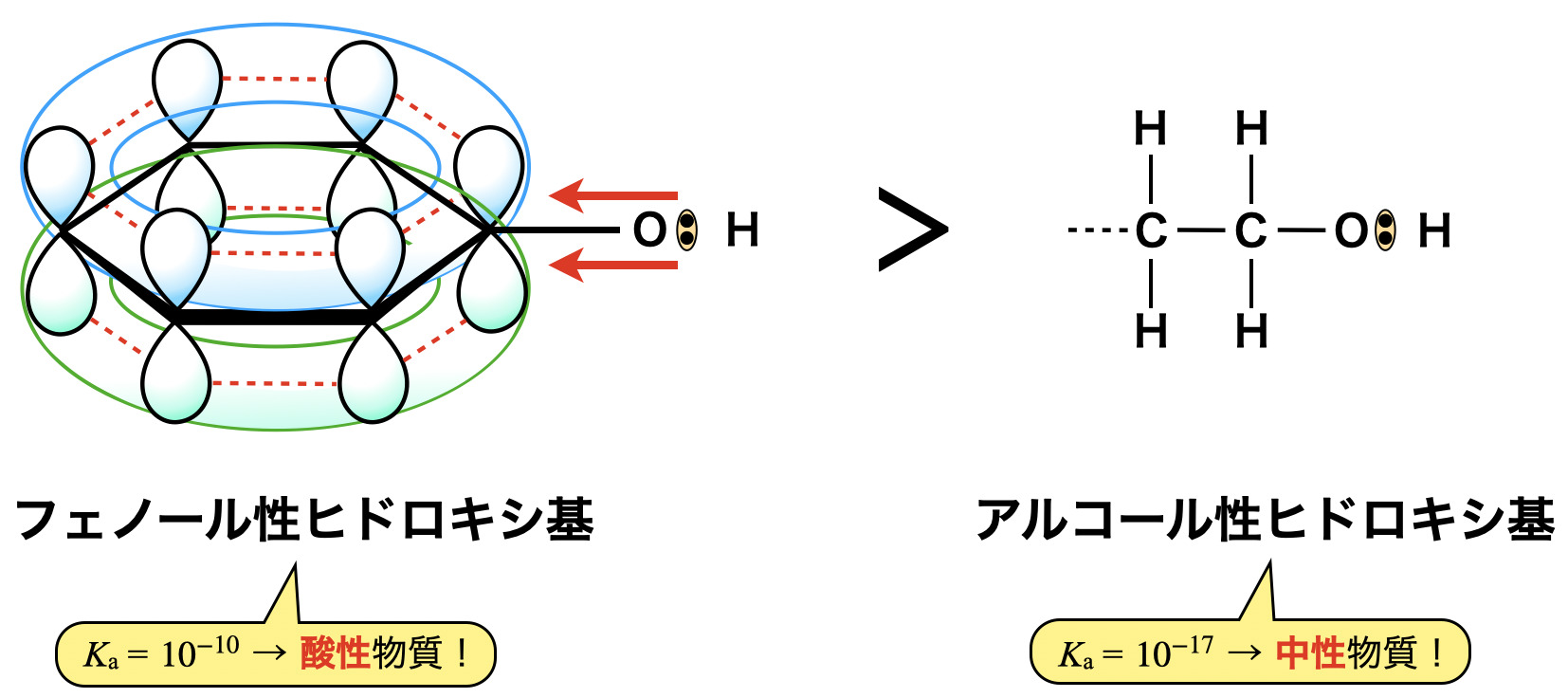
共鳴効果で安定しているベンゼン環にフェノール性ヒドロキシ基の\(\rm{O-H}\)間の共有電子対が引き付けられるので,\(\rm{H}\)が電離しやすくなり,酸性物質となります.それに対してアルキル基に結合したアルコール性ヒドロキシ基は,引き付けられるという効果がないので,中性物質となります.
電離定数を比較すると,フェノール性ヒドロキシ基の場合は\(K_{\rm{a}} = 10^{-10}\),アルコール性ヒドロキシ基の場合は\(K_{\rm{a}} = 10^{-17}\)です.(ちなみにカルボン酸の\(K_{\rm{a}}\)は\(K_{\rm{a}} = 10^{-5}\)程度でより強い酸性を示します.)
\(\rm{FeCl_3}\)による呈色反応
フェノールの\(\rm{O}\)原子については,\(\rm{O}\)のもつ非共有電子対もベンゼン環の\(\pi\)電子とともに共鳴しようとベンゼン環に流れ込み,非局在化します.この\(\pi\)電子が広がった状態に\(\rm{Fe^{3+}}\)が引き付けられて,赤紫〜紫〜青紫の化合物を形成します.
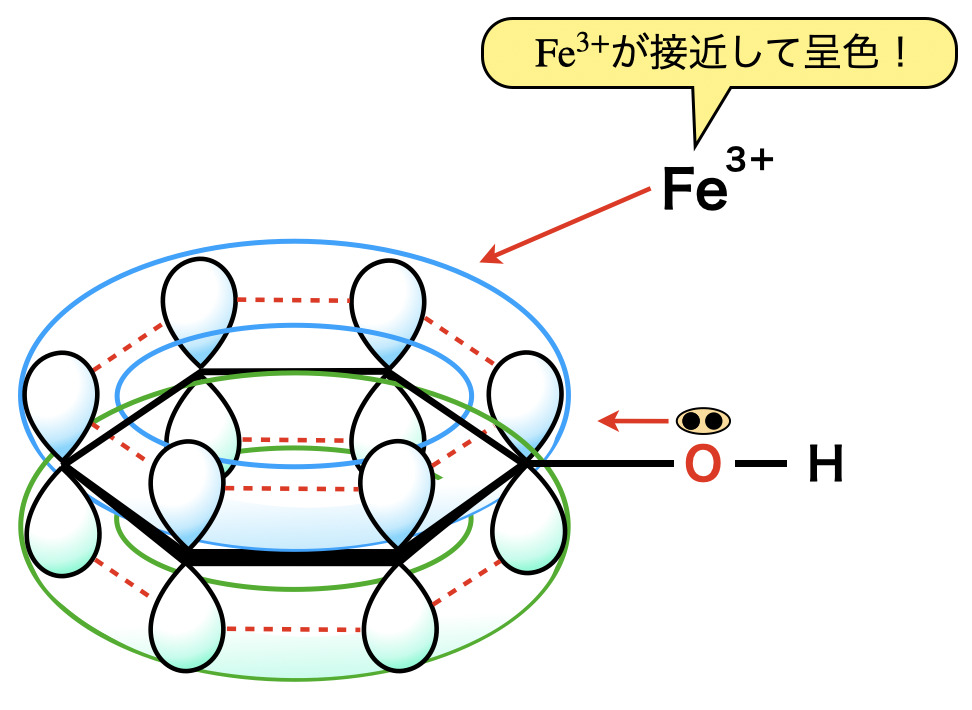
この反応はフェノール性ヒドロキシ基の検出反応となります.
カルボン酸無水物によるエステル化
今まで何度も説明してきたように,エステル化は「すきま」「うめます」の原理で反応します.
この内容がピンとこない方はこちらの記事をご覧ください!

ただフェノール性ヒドロキシ基の場合,\(\rm{OH}\)基の\(\rm{O}\)原子の非共有電子対がベンゼン環の\(\pi\)電子とともに共鳴するため,カルボニル基へ攻撃するパワーは減少しています.さらにエステル化は可逆反応であるため,カルボン酸への反応はあまり進みま線でした.
そこで登場するのがカルボン酸無水物です!前回のエステル化の記事でも不安定なカルボン酸無水物を使うことで,可逆反応が不可逆反応となり,収率が\(100\%\)になることを学びました.今回もこのカルボン酸無水物を使うことで,「すきま」「うめます」反応を進めます!
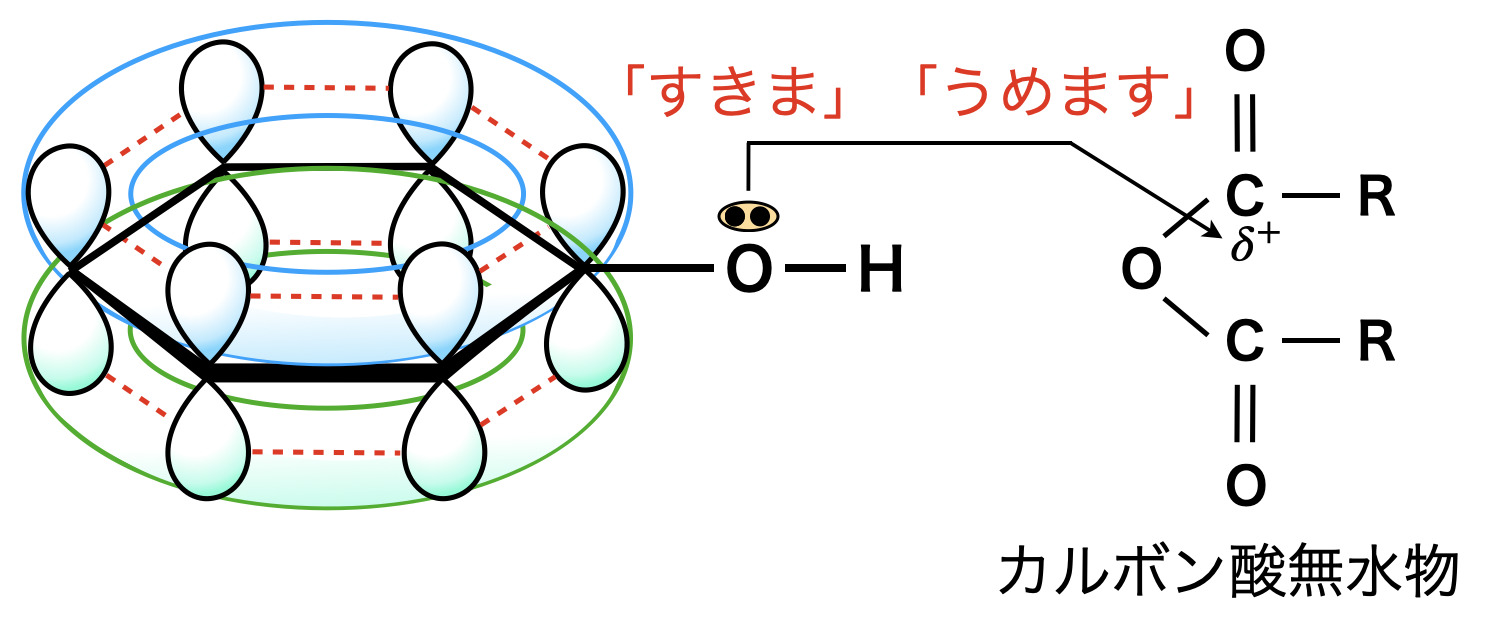
上に示したフェノール性ヒドロキシ基の性質は,ベンゼン環に直接結合したヒドロキシ基でないとこのような性質にはなりません.例えば下のようなベンジルアルコールを考えてみましょう!
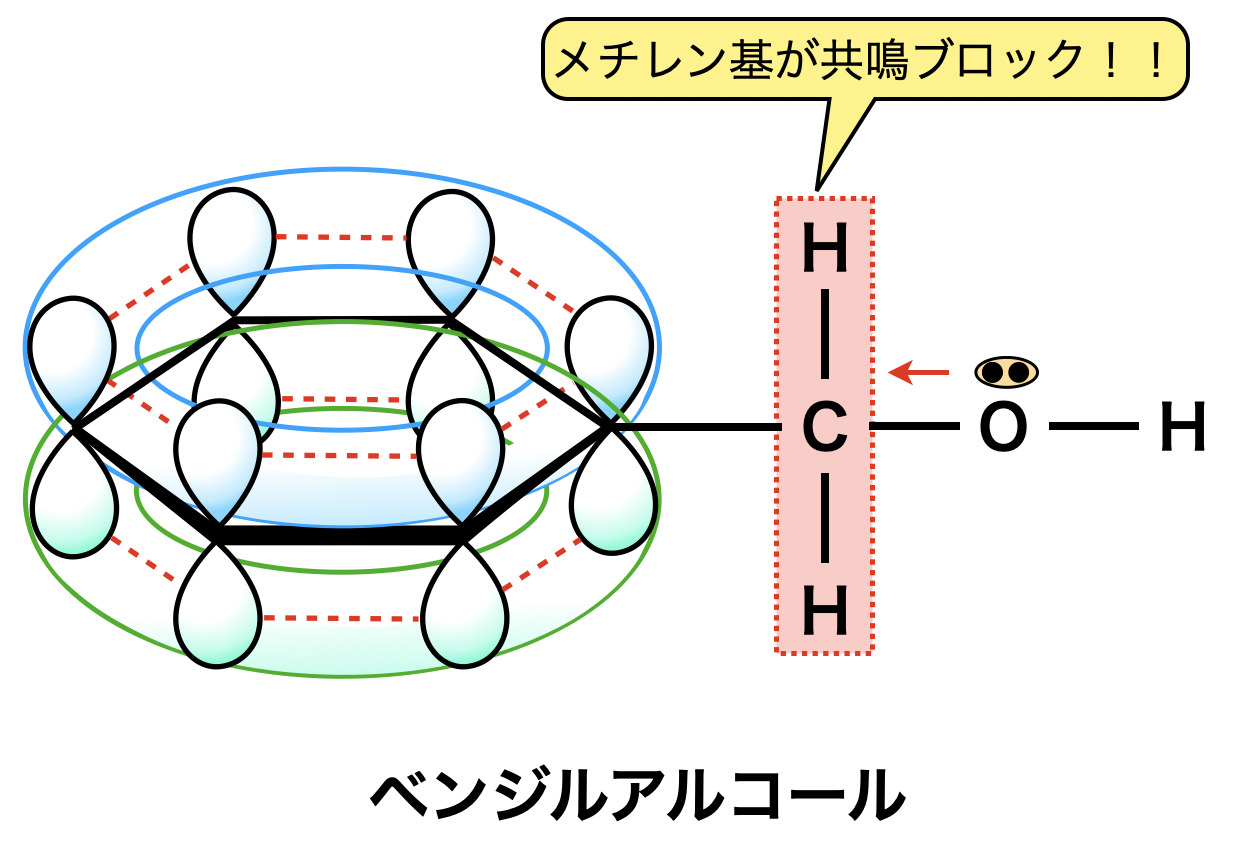
このような物質は\(\rm{OH}\)基の間にメチレン基(\(\rm{-CH_2-}\))が存在するため,\(\rm{OH}\)基の\(\rm{O}\)原子のもつ非共有電子対がベンゼン環へ共鳴のために流入できません.そのため普通のアルコール性ヒドロキシ基と同じ性質しか示しません.
芳香族カルボン酸の性質
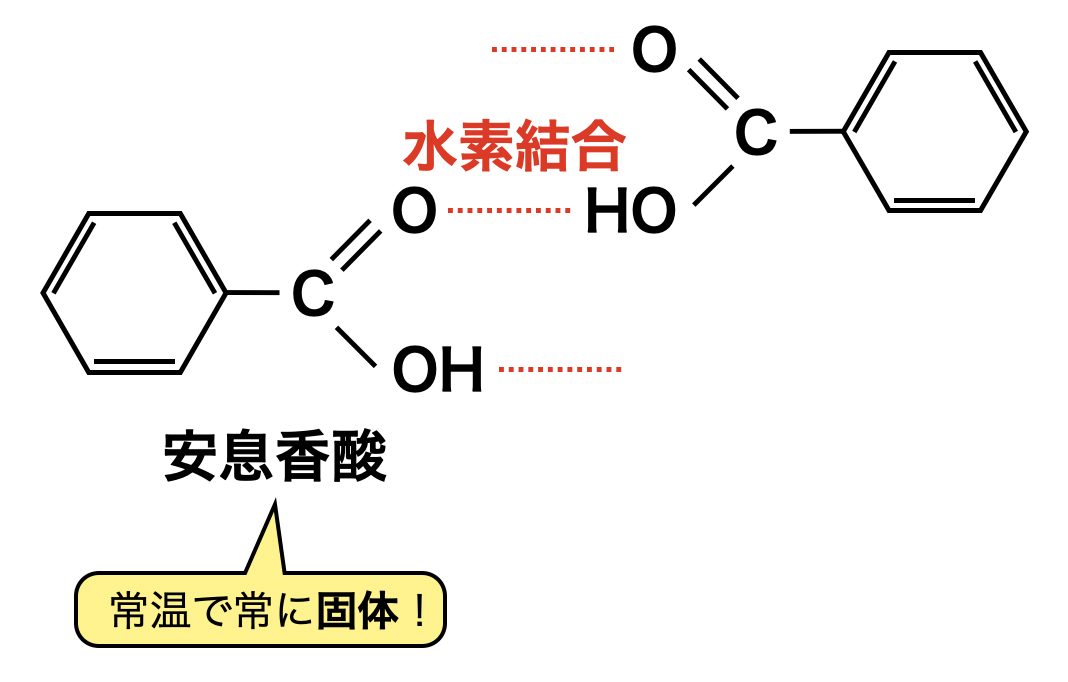
芳香族カルボン酸(例:安息香酸)の反応は,一般のカルボン酸とほぼ同じになります.ただカルボキシ基が水素結合する上に,分子量が大きいので,融点が高くなり,常温で固体になっています.
あとで説明しますが,芳香族化合物は一般的に水に対して難溶です.しかしながら芳香族化合物のイオンは官能基の親水性により,水に対して溶けやすくなります.
ここで,安息香酸ナトリウム水溶液を例にして考えてみましょう!安息香酸ナトリウム水溶液に\(\rm{HCl}\)を加えると下のような反応が起こります.

この反応で生成した安息香酸は水に溶けにくいため,白い固体となって沈殿します.
アニリン
アニリンとはベンゼン環にアミノ基(\(\rm{-NH_2}\))が直接結合した物質です.
このアニリンには重要な性質が\(3\)つあります.
① 弱塩基性物質
② 酸化されやすい
③ アミド化
これらの性質は,全てアミノ基(\(\rm{-NH_2}\))の\(\rm{N}\)原子のもつ非共有電子対が起因しています.\(1\)つずつ説明していきましょう!
弱塩基性物質
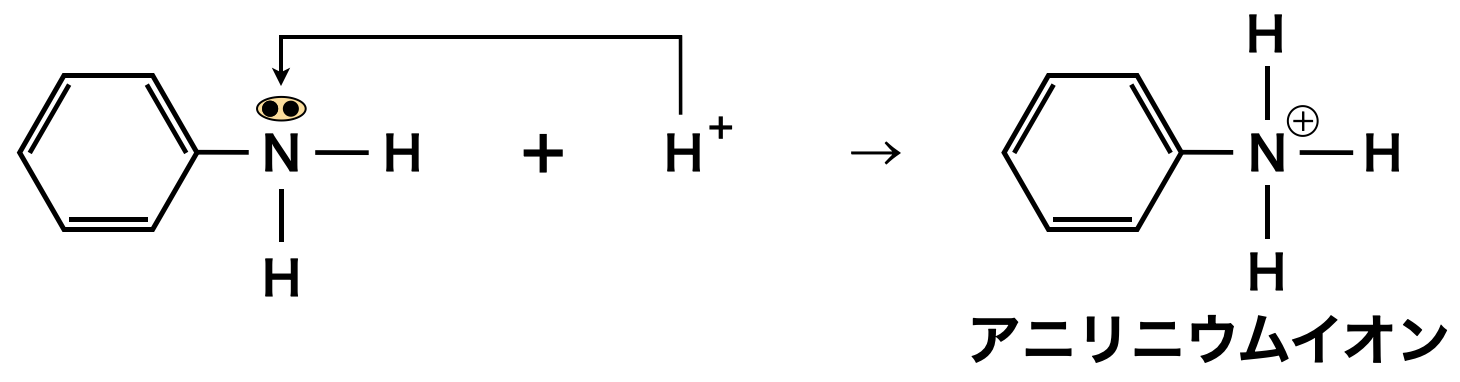
アニリンは\(\rm{N}\)原子に非共有電子対があり,強酸と反応すると非共有電子対に\(\rm{H^+}\)イオンが配位結合してアニリニウムイオンになります.
アニリンはフェノールと同様にアミノ基の\(\rm{N}\)原子のもつ非共有電子対がベンゼン環の\(\pi\)電子と共鳴するために流れこんでいき,\(\rm{H^+}\)イオンが非共有電子対に配位結合しにくくなっています.そのため塩基性としてのパワーはアンモニア \(>\) アニリンとなります.

酸化されやすい
アミノ基の\(\rm{N}\)原子に非共有電子対が酸化剤の攻撃を受けやすいため,容易に酸化されます.この性質を用いた反応が\(2\)つあるので,紹介していきましょう!
①アニリンとさらし粉水溶液の反応
さらし粉(\(\rm{CaCl(ClO) \cdot H_2O}\))に含まれる\(\rm{ClO^-}\)(次亜塩素酸イオン)は以下の半反応式のため酸化剤となります.
\(\rm{ClO^-\ +\ }\)\(2e^-\ +\ \rm{2H^+\ →\ Cl^-\ +\ H_2O}\)
アニリンとさらし粉を反応させると,アニリンが酸化され,赤紫色となります.つまり「さらし粉を加えて赤紫色になる→アニリン」と覚えておきましょう!
②アニリンと二クロム酸カリウムの反応
二クロム酸イオン(\(\rm{Cr_2O_7^{2-}}\))は,「硫酸酸性下」で強酸化剤となります.
\(\rm{Cr_2O_7^{2-}\ +\ 14H^+\ +\ }\)\(6e^-\ →\ \rm{2Cr^{3+}\ +\ 7H_2O}\)
アニリンと二クロム酸イオンを反応させると,アニリンは酸化されて黒色(アニリンブラック)となります.
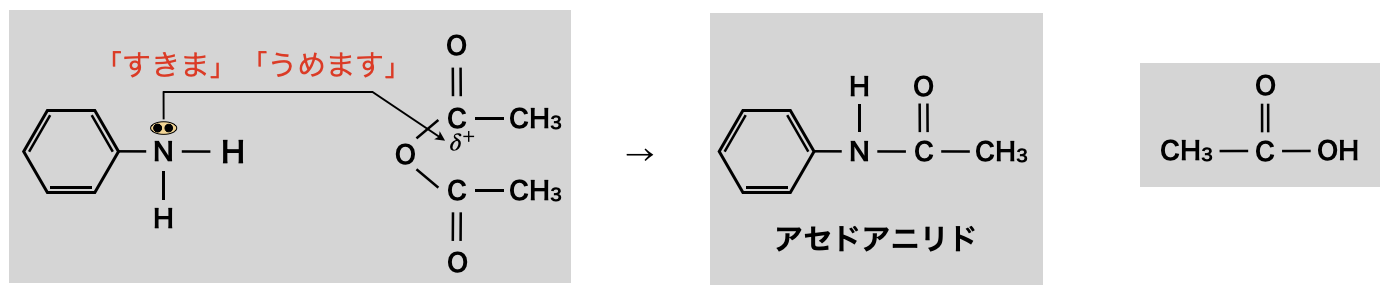
アニリンのアミド化
フェノールと同様に,無水酢酸のようなカルボン酸無水物と「すきま」「うめます」反応します.アニリンをアミド化したものをアニリドといいます.
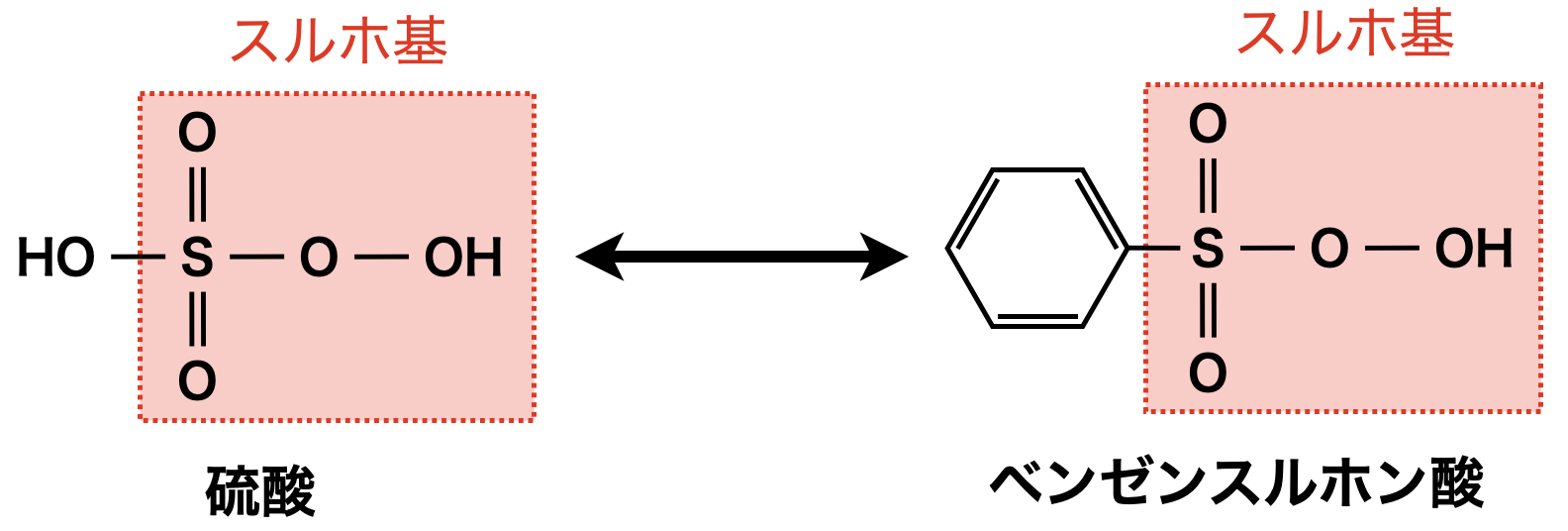
ベンゼンスルホン酸
ベンゼンスルホン酸は強塩基のスルホ基があるので,強酸性を示します.
芳香族の分離
ベンゼン環を分子内にもつ芳香族化合物は,ベンゼン環の疎水性が大きいため,基本的に水に溶け難く,疎水性の官能基をもつジエチルエーテルのような有機溶媒に良く溶けます.しかしながら,ベンゼン環の置換基がアニオン・カチオンによって水に溶けやすくなります.

混合物から目的とする物質をよく溶かす溶媒を用いて分離する方法を抽出といいます.
有機溶媒と水を混合すると混じり合わず,液体の密度が有機溶媒 \(<\) 水であるため,下のように有機溶媒が水に浮くようになります.

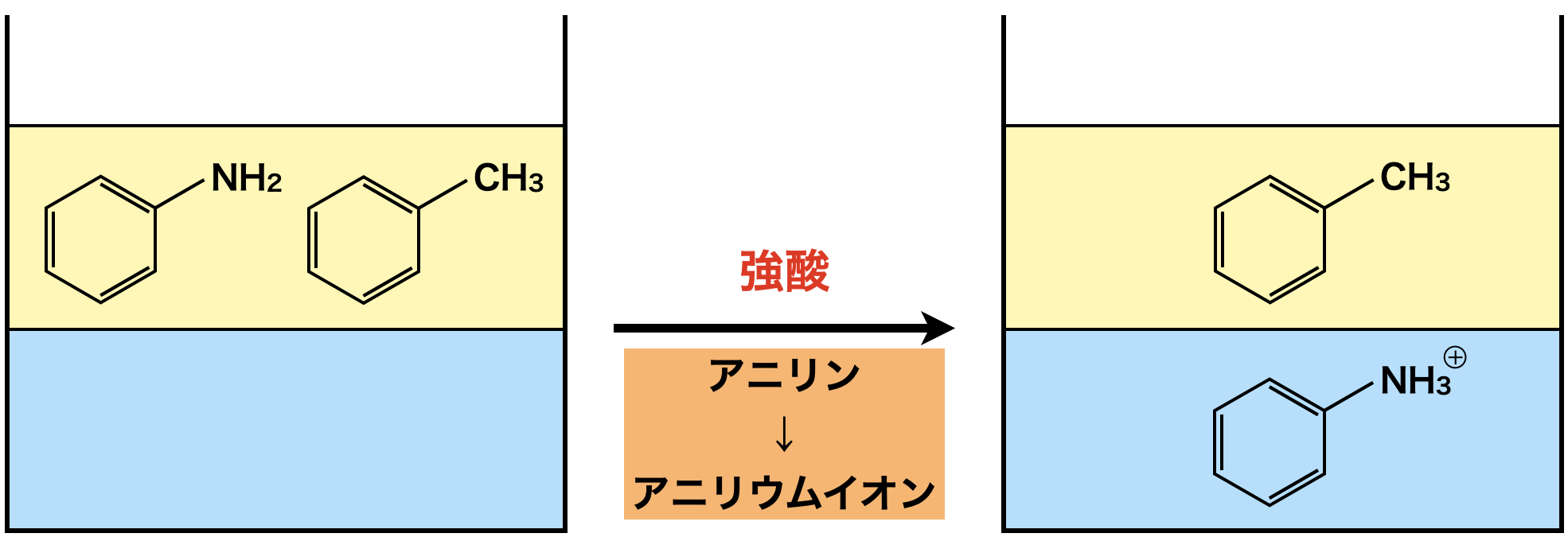
中性芳香族+アニリン→アニリン
\(\rm{HCl}\)や\(\rm{H_2SO_4}\)のような強酸を加えてアニリンをアニリウムイオンに変えて,水層へ抽出します.イオンになるため,水層へ移動します.
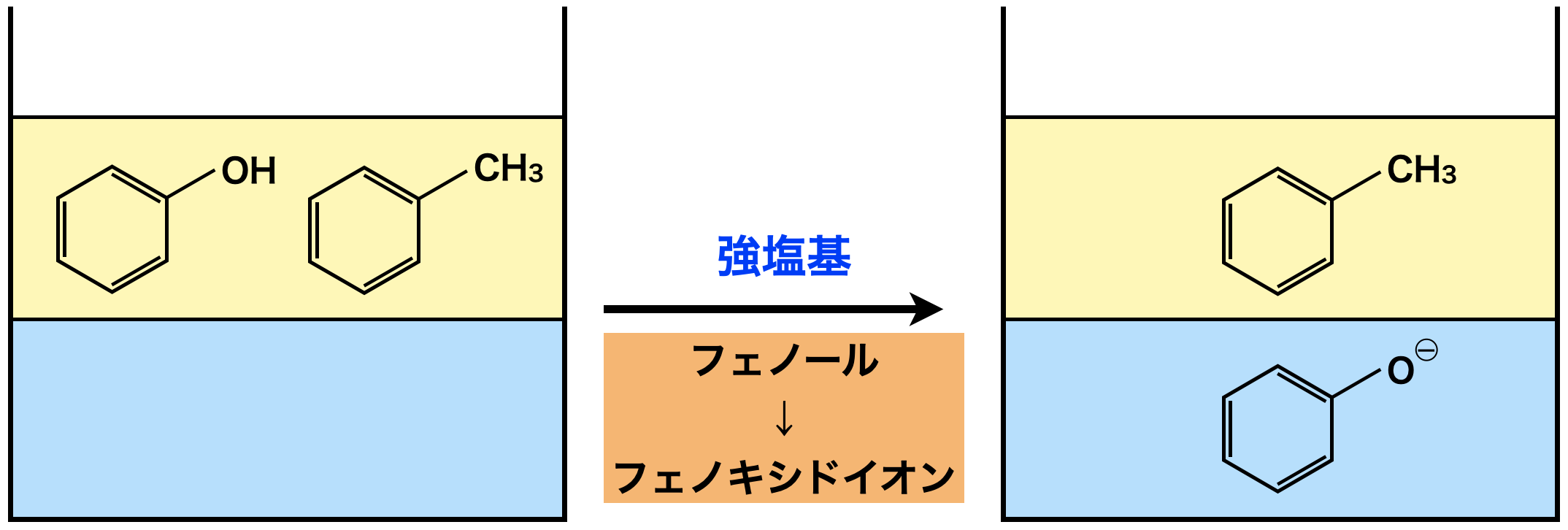
中性芳香族+フェノール→フェノール
\(\rm{NaOH}\)や\(\rm{Ba(OH)_2}\)のような強塩基を加えてフェノールをフェノキシドイオンに変えて,水層へ抽出します.
安息香酸+フェノール→安息香酸
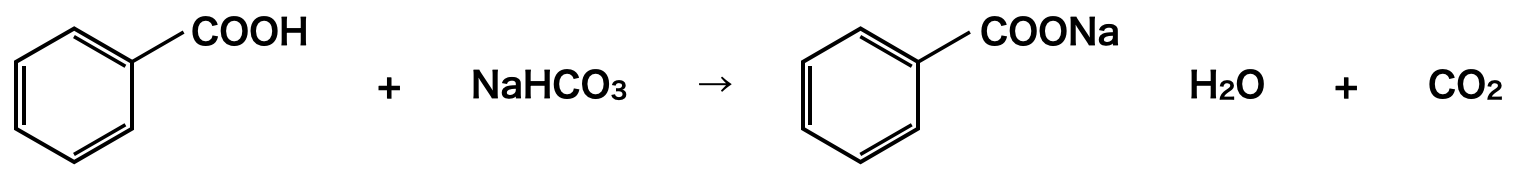
安息香酸+フェノールから安息香酸を抽出するには,弱酸遊離反応を活用します.\(\rm{NaHCO_3}\)を加えて安息香酸を安息香酸イオンに変化させ,水槽へ移動させます.
この原理を詳しく解説していきましょう!
脂肪族で説明した酸の強さを再確認していきましょう!「スカタンフェノール」で覚えられていますか?

まず酸の強さを比較すると,安息香酸 \(>\) フェノールとなります.酸性が強いということは,\(\rm{H^+}\)イオンを相手に投げるパワーが強いということです.つまり,安息香酸は\(\rm{HCO_3^-}\)へ\(\rm{H^+}\)イオンを投げます!
ところが,フェノールは\(\rm{HCO_3^-}\)へ\(\rm{H^+}\)イオンを投げることはできません.そのため安息香酸のみが安息香酸イオンになり,水槽へ移動します.

芳香族カルボン酸アニオン+フェノキシドイオン→フェノール
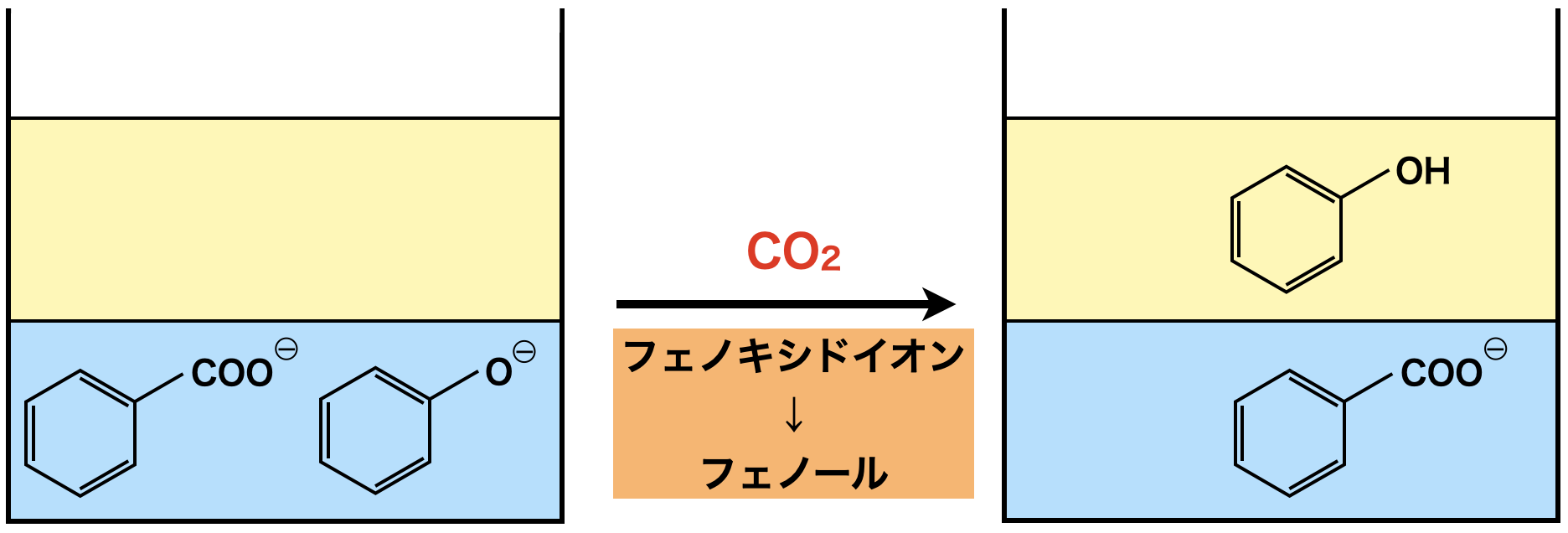
安息香酸などの芳香族カルボン酸アニオン+フェノキシドイオンからフェノールを抽出する際にも弱酸遊離反応を活用します.ここでのポイントは安息香酸もフェノールもともにイオンになっているということです.イオンで存在するということは,ともに水層に存在しています.
水層に\(\rm{CO_2}\)を加えると,フェノキシドイオンがフェノールになりエーテル層に移動するため,抽出することができます.
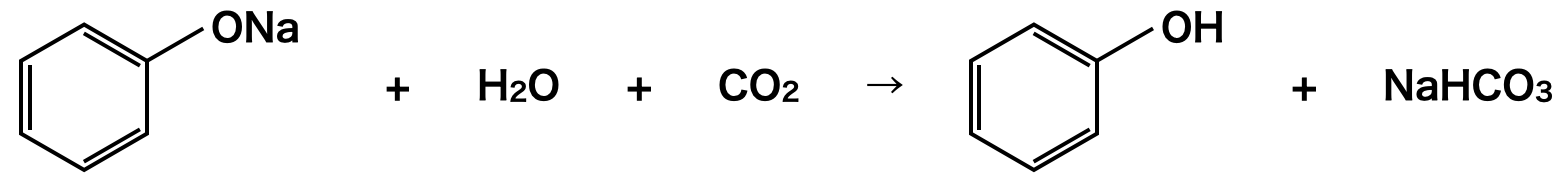
ここでも原理を理解しておきましょう!
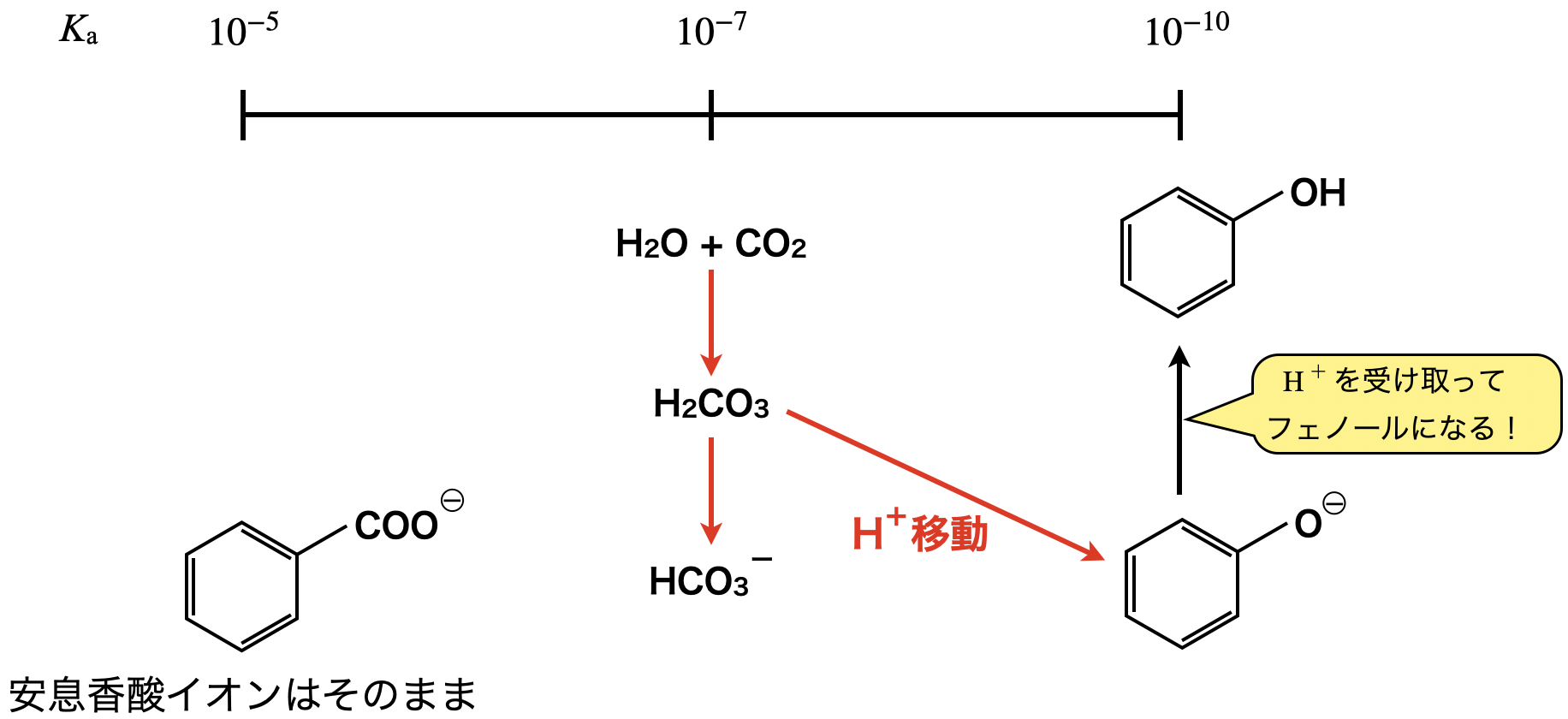
水層に\(\rm{CO_2}\)を加えると,炭酸(\(\rm{H_2CO_3}\))が生成します.
\(\rm{H_2O\ +\ CO_2\ ⇄\ H_2CO_3}\)
ここで電離定数を確認すると,\(\rm{H_2CO_3}\) \(>\) フェノールであるため,\(\rm{H_2CO_3}\)がフェノールに対して\(\rm{H^+}\)イオンを投げつけます.安息香酸は\(\rm{H_2CO_3}\)よりも電離定数が大きいため,\(\rm{H^+}\)イオンを受け取ることはできません.(安息香酸は\(\rm{H^+}\)イオンを投げつける力の方が大きいです!)そのためフェノールがエーテル層,安息香酸イオンは水層のままになります.

それでは今日はここまでです!お疲れ様です1




コメント