
芳香族の前半が見たいという方は以下の記事をご覧ください!


今回はベンゼン環の反応の後半戦を詳しく解説していきます!
① ラジカル付加反応
② 求電子置換反応\(-1\)
③ 求電子置換反応\(-2\)
④ 電子供与基の求電子置換反応の応用
________________________________(今回はここから!)
⑤ フェノキシドイオンの求電子置換反応の応用
⑥ フェノール生成法
⑦ アニリン・安息香酸の生成法
フェノキシドイオンの求電子置換反応の応用
最強の電子供与基であるフェノール性\(\rm{OH}\)基の\(\rm{SE2}\)反応を深く学んでいきましょう!
ジアゾカップリング反応
芳香族同士を結合させ,下の構造(アゾベンゼン)を生成することをジアゾカップリングといいます.
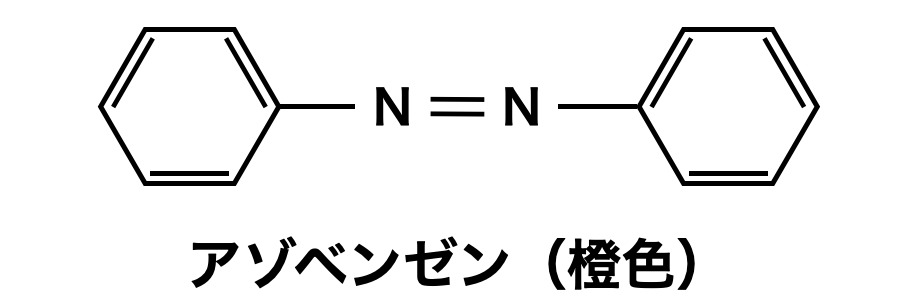
「アゾ」という言葉が出てくれば,窒素が関係すると思って大丈夫です!下に覚えておいて損がないものをまとめておきますね!

芳香族の基本反応は\(\rm{SE}\)反応です.そのため上の表から考えていくと,ジアゾカップリング反応には,ジアゾニウムイオンをベンゼン環に攻撃させれば良いと考えられます.しかしながら,ベンゼンジアゾニウムイオンのもつ\(\rm{-N_2^+}\)の\(+\)電荷にベンゼン環の\(\pi\)電子が引き付けられ,結果別のベンゼンに攻撃する能力が弱くなっています.
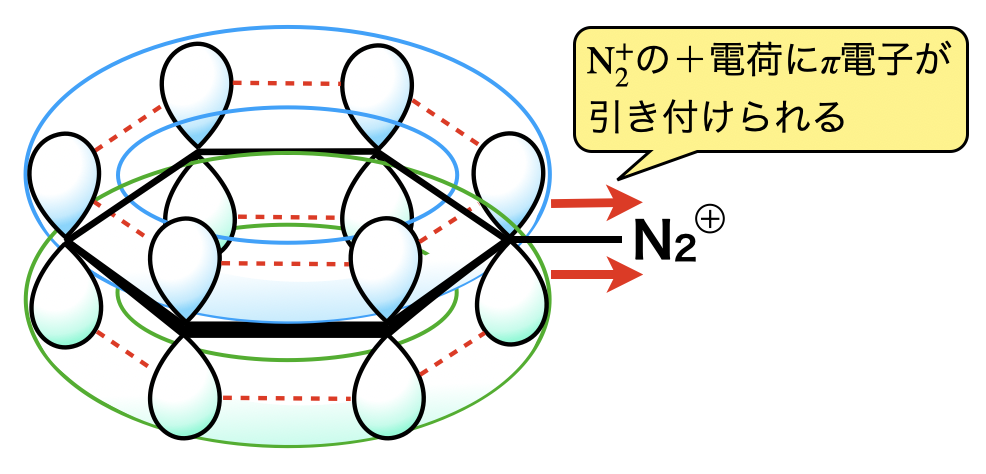
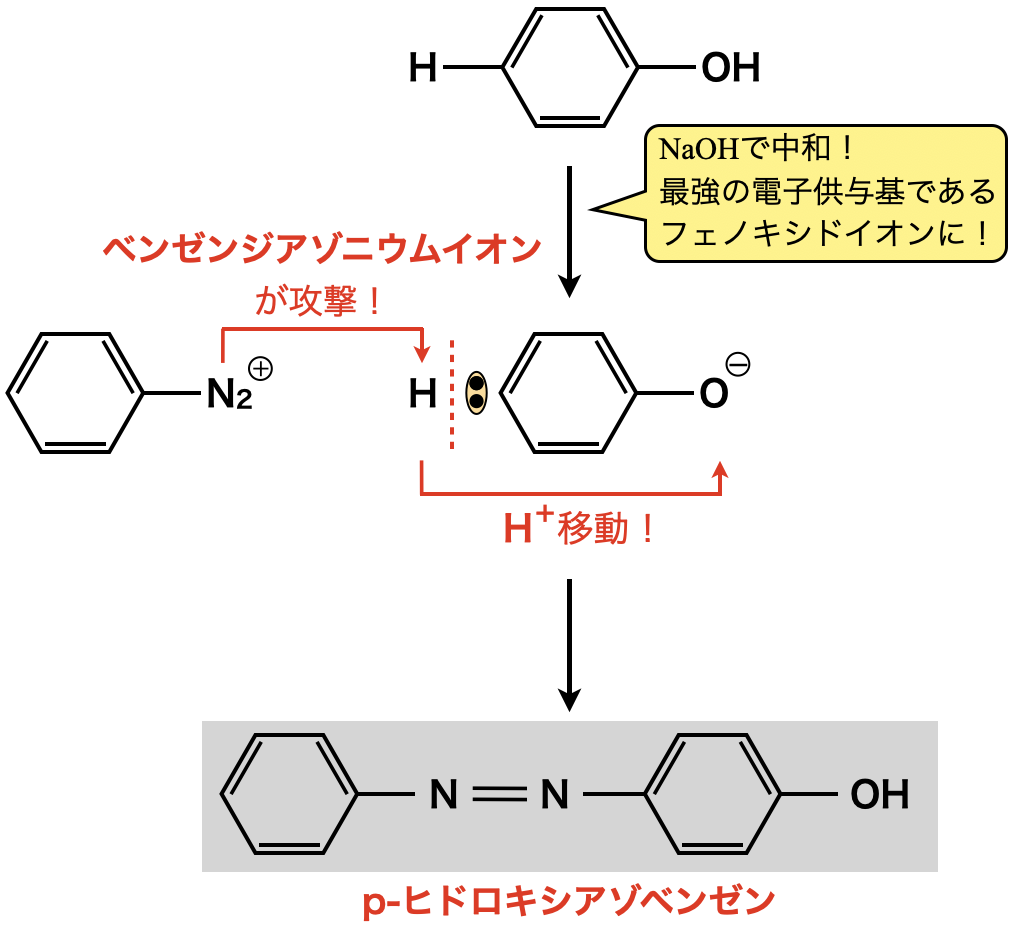
そこで登場するのが,最強電子供与基をもつフェノキシドイオンです!!フェノキシドイオンを用いることで,やっとこさ別のベンゼン環と反応させることができます.
なお,フェノキシドイオンは\(o,p\)配向性を示します.しかしながら,攻撃してくるベンゼンジアゾニウムイオンが大きすぎるため,立体的な障害の少ない\(p\)位に置換し,\(o\)位では置換しません.この一連の反応によって,\(p-\)ヒドロキシアゾベンゼンが生成します.そしてこの反応をジアゾカップリング反応といいます.
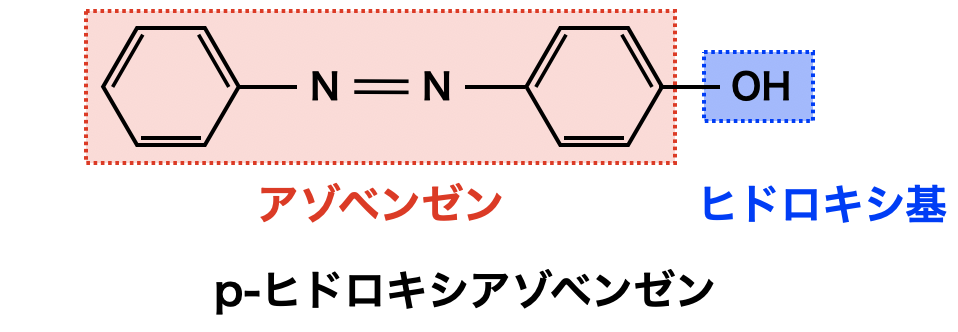
この物質は下のように構造を分けて考えると,名称を覚えやすくなります!
\(p-\)ヒドロキシアゾベンゼンはアゾベンゼン化合物の一種なので,橙色を呈します.
またベンゼンジアゾニウムイオンは,\(\rm{5^\circ C}\)以上の水溶液中で加水分解反応が始まり,フェノールと\(\rm{N_2}\)になるため,必ず\(\rm{0^\circ C}\)の氷冷下で反応させます.
サリチル酸の工業的製法
\(\rm{CO_2}\)の構造式は一般に\(\rm{O=C=O}\)となっていますが,実際は瞬間的に分子中に\(+,-\)がともに存在するイオンとなっています.
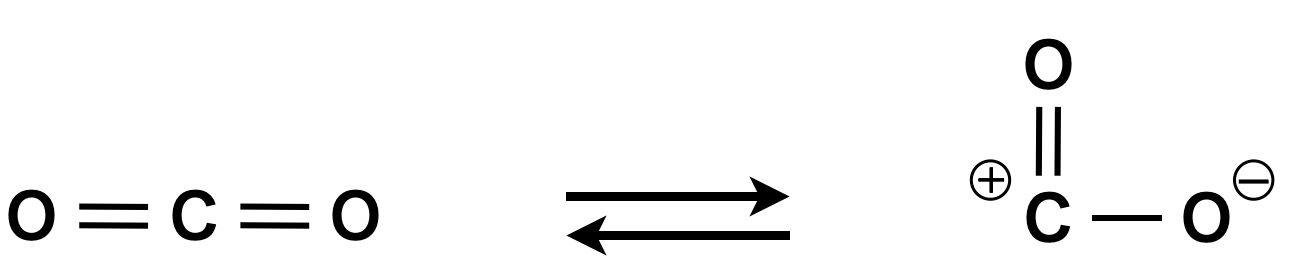
\(\rm{CO_2}\)が\(+\)電荷を帯びたときにベンゼン環を攻撃する\(\rm{SE}\)反応ができそうに思いますが,すぐに\(\rm{O=C=O}\)となるため,反応がうまくいきません.
そこで,最強の電子供給基をもつフェノキシドイオンが再び登場します.
ただ,フェノキシドイオンの\(+\)イオンを誘う効果だけではまだうまく反応が進まないため,\(\rm{CO_2}\)を高温(\(\rm{125^\circ C}\))・高圧(\(500\ \)〜\(\ 600\ \rm{kPa}\))の条件にして置換反応を行います.
\(o\)位に\(\rm{CO_2}\)が攻撃し,追い出された\(\rm{H^+}\)イオンがフェノキシドイオン由来の\(\rm{-O-}\)と結合するとサリチル酸イオンが生成します.(溶液中にナトリウムイオンが存在すれば,サリチル酸ナトリウムが生成します.)

上記の反応で生成したサリチル酸ナトリウムに\(\rm{HCl}\)などの強酸を反応させることで,サリチル酸が生成します.
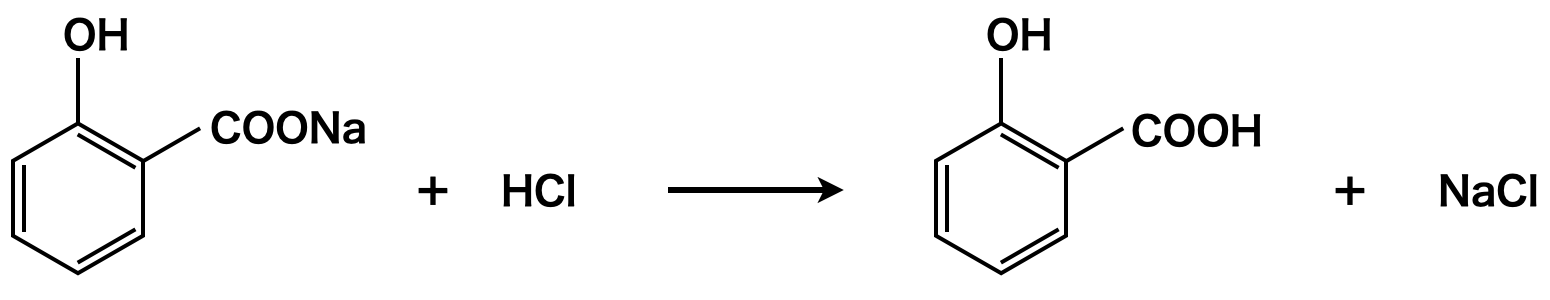
このサリチル酸の工業的製法をコルベ・シュミット法といいます.
① フェノールを\(\rm{NaOH}\)で中和し,最強の電子供与基をもつフェノキシドイオンにする.
② \(\rm{CO_2}\)を高温・高圧で無理やり反応させ,サリチル酸ナトリウムにする.
③ 強酸を加え,サリチル酸を生成する.
ナトリウムフェノキシド水溶液に\(\rm{CO_2}\)を高温・高圧条件でなく反応させると,酸の強さが炭酸 \(>\) フェノールのため,\(\rm{H^+}\)イオンが炭酸→フェノキシドイオンへ移動し,フェノールが遊離します.
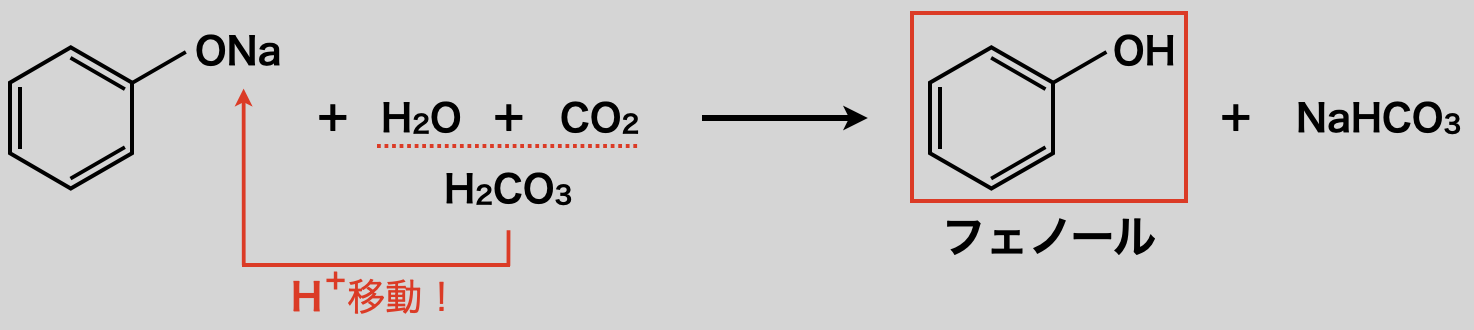
フェノールの生成法
芳香族の\(\rm{Big-3}\)の\(1\)つであるフェノールは,\(\rm{OH^+}\)イオンがどうしても生成できないので,\(\rm{SE}\)反応では生成できません.
ベンゼン環の\(\pi\)電子に反発する\(\rm{OH^-}\)イオンを無理やり攻撃させるため,\(\rm{300^\circ C}\)以上の高温・高濃度で反応させる必要があります.\(\rm{OH^-}\)イオンがベンゼンに攻撃した場合,その\(\rm{O}\)原子は非共有電子対をもっているので,置換反応でさらに電子を奪う必要がありません.この反応を反応する相手の原子の原子核だけを必要とするという意味で,求核置換反応(\(\rm{SN:Substitutional\ Nucleophilic\ reaction}\))といいます.
結果として,置換されて離脱する\(\rm{H}\)原子は,元の\(\rm{C}\)原子と\(\rm{H}\)原子の間の共有電子対をもらい\(\rm{:H^-}\)イオンとなって離脱します.
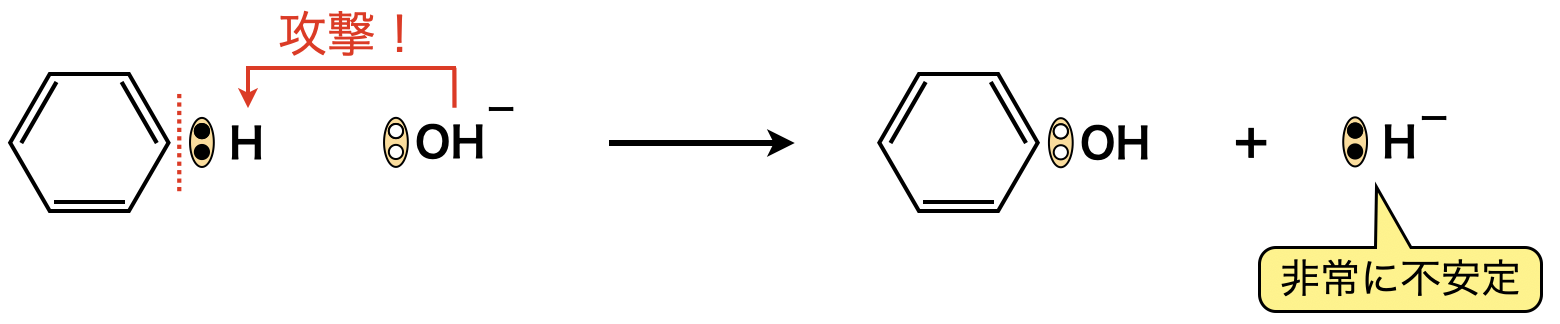
しかしながら,\(\rm{:H^-}\)イオンというのは非常に不安定な物質で,この反応はほとんど進みません!
そこで,まず\(\rm{SE}\)反応で\(\rm{H}\)を\(\rm{:X^-}\)イオンが安定であるような官能基に先に置換しておき,\(\rm{OH^-}\)イオンを\(\rm{300^\circ C}\)以上の高温・高濃度で反応させることが重要であるとわかります.この\(\rm{:X^-}\)イオンはダミー官能基です!

ここで,\(\rm{X}\)に該当するのは,\(\rm{X = Cl}\)(クロロベンゼン),\(\rm{SO_3H}\)(ベンゼンスルホン酸)です.
クロロベンゼン経由
\(\rm{:OH^-}\)イオンが置換する際のダミー官能基として\(\rm{X=Cl}\)を用います.
まず\(\rm{FeCl_3}\)を触媒として,\(\rm{Cl}\)から\(\rm{Cl^+}\)イオンを生成させ,\(\rm{SE1}\)反応でクロロベンゼンを生成します.
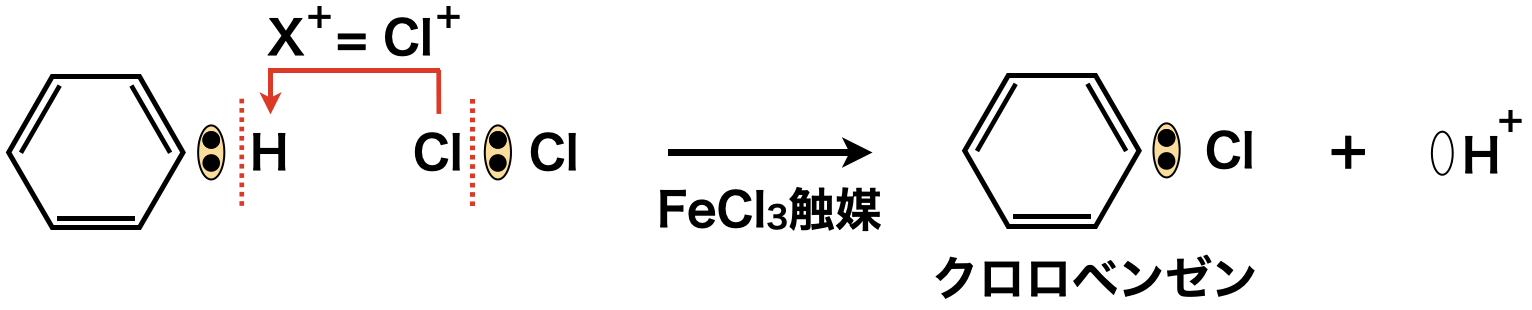
クロロベンゼンに\(\rm{NaOH}\)を高温(\(\rm{300^\circ C}\))・高圧(\(20\ \rm{MPa}\))の条件下でボコボコに反応させてやっとこさフェノールが生成します.
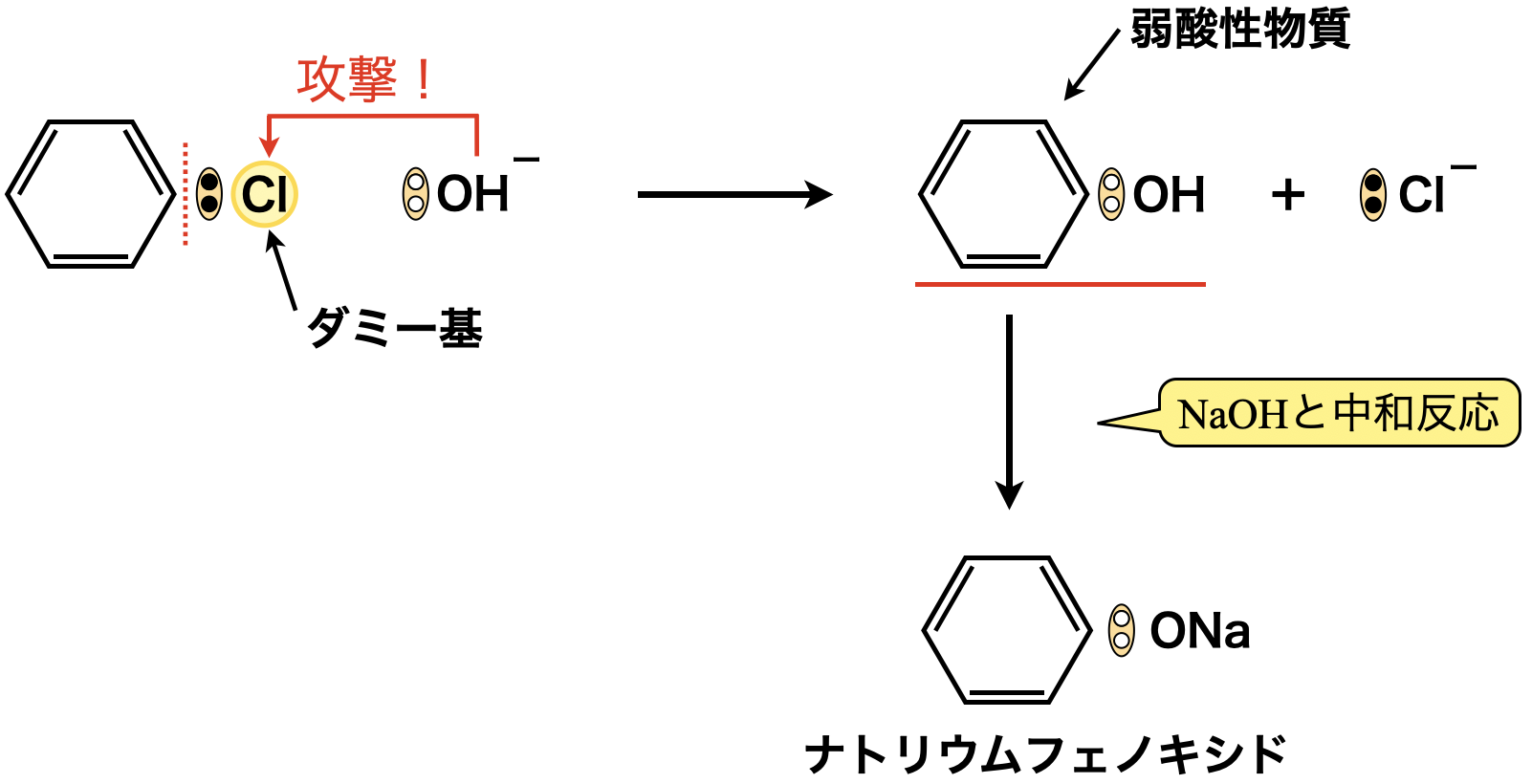
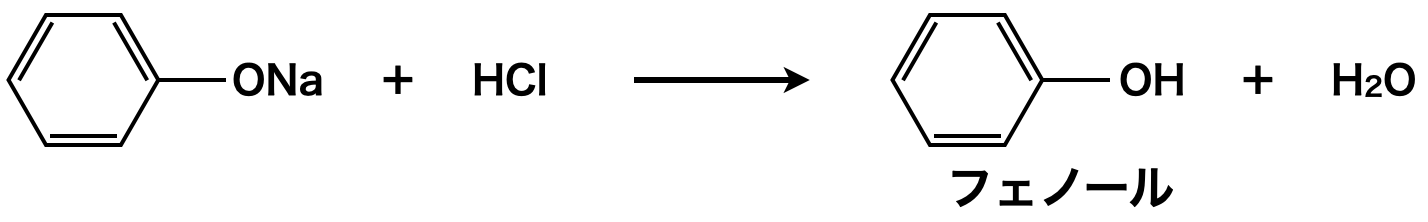
ただフェノールは\(\rm{NaOH}\)と中和反応を起こしナトリウムフェノキシドになります.そこで最後にフェノールより強い酸を用いてフェノールを生成します.
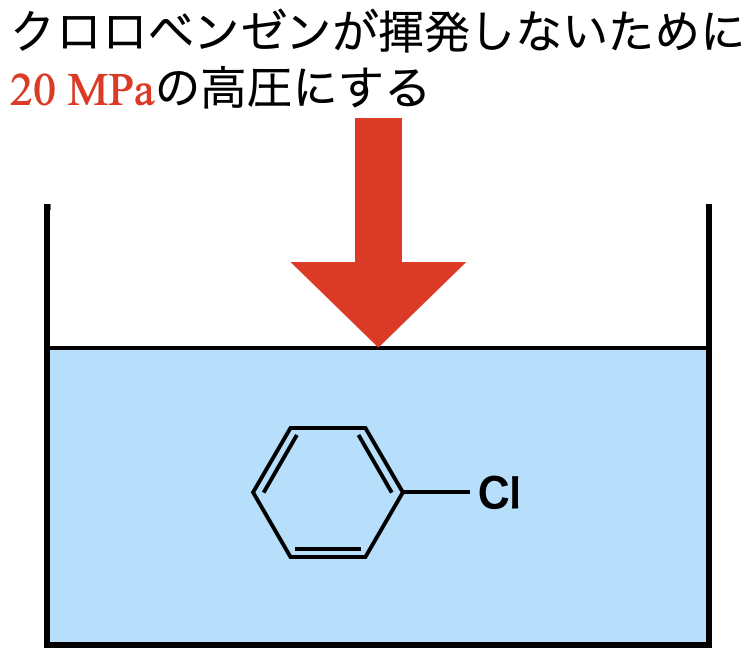
今回の反応で上記のような厳しい条件が必要な理由は,高温にしたとき圧力を上げなければクロロベンゼンが揮発してしまうためです.
ベンゼンスルホン酸経由
\(\rm{:OH^-}\)イオンが置換する際のダミー官能基として\(\rm{X=SO_3H}\)を用います.
まずベンゼンに濃\(\rm{H_2SO_4}\)を触媒として\(\rm{SO_3H^+}\)イオンを生成させ,\(\rm{SE1}\)反応でベンゼンスルホン酸を生成します.
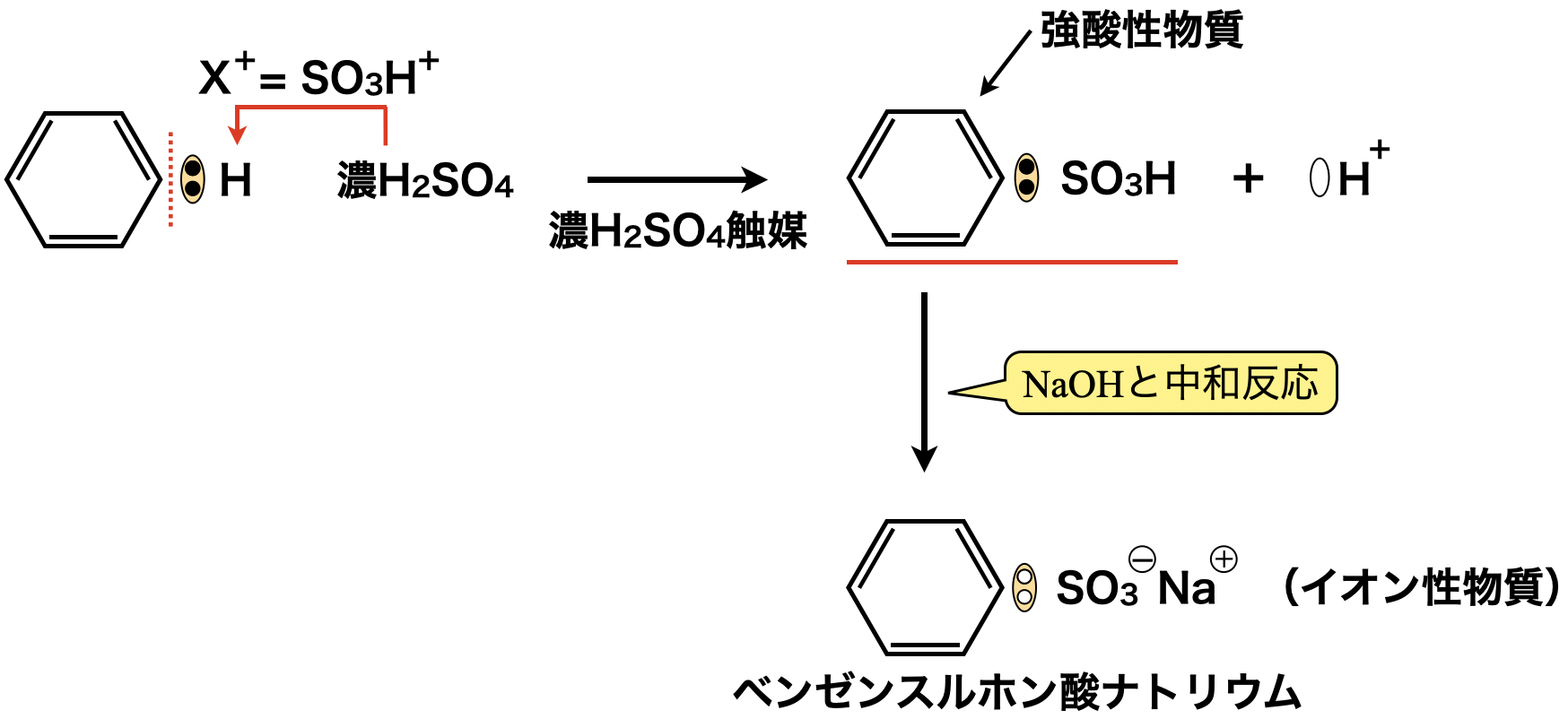
生成した強酸性のベンゼンスルホン酸を\(\rm{NaOH}\)で中和しベンゼンスルホン酸ナトリウムにします.
次に,生成したベンゼンスルホン酸ナトリウムを固体の\(\rm{NaOH}\)を約\(\rm{300^\circ C}\)にして融解させた融解液でボコボコに反応させ,やっとこさフェノールが生成します.これをアルカリ融解といいます.ここでは高圧条件はいりません!
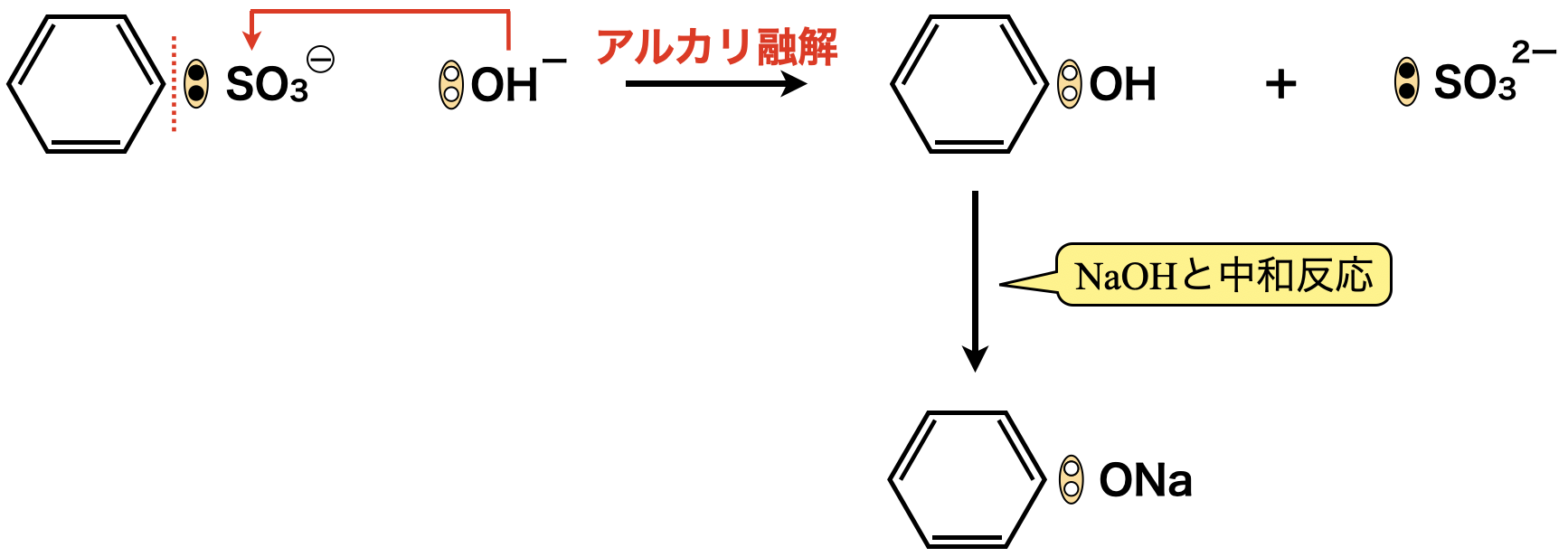
ここからはクロロベンゼン経由のときと同じです!フェノールを\(\rm{NaOH}\)と中和反応させ,ナトリウムフェノキシドになります.そして最後にフェノールより強い酸を用いてフェノールを生成します.

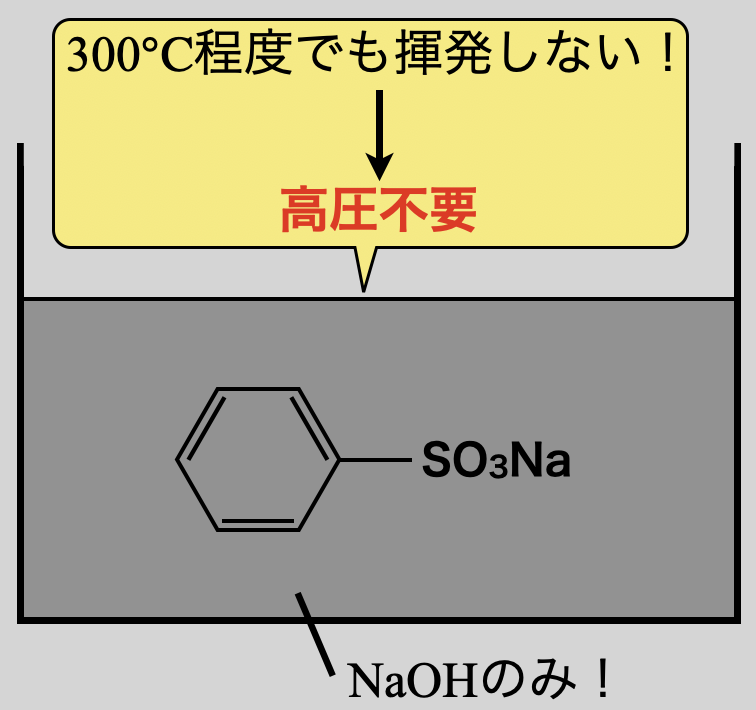
強酸性物質であるベンゼンスルホン酸を中和して得られるベンゼンスルホン酸ナトリウムはイオン性物質で融点も沸点も高く,約\(\rm{300^\circ C}\)の加熱では揮発しません.そのため,高圧にする必要もないのです!
今回の場合は,できる限り\(\rm{NaOH}\)の濃度を高くしようとした結果,固体の\(\rm{NaOH}\)を融解させ(\(\rm{NaOH}\)の濃度は最大で\(100\%\)になる!),その融解液の中で反応させています.
クメン法
かつてフェノールは先程示したアルカリ融解で工業的に製造されていました.しかしながら大量の固体の\(\rm{NaOH}\)を必要とし,さらに\(\rm{300^\circ C}\)近くまで加熱して融解する必要があったため,新たな方法が考えられました.
それが今回紹介するクメン法です.
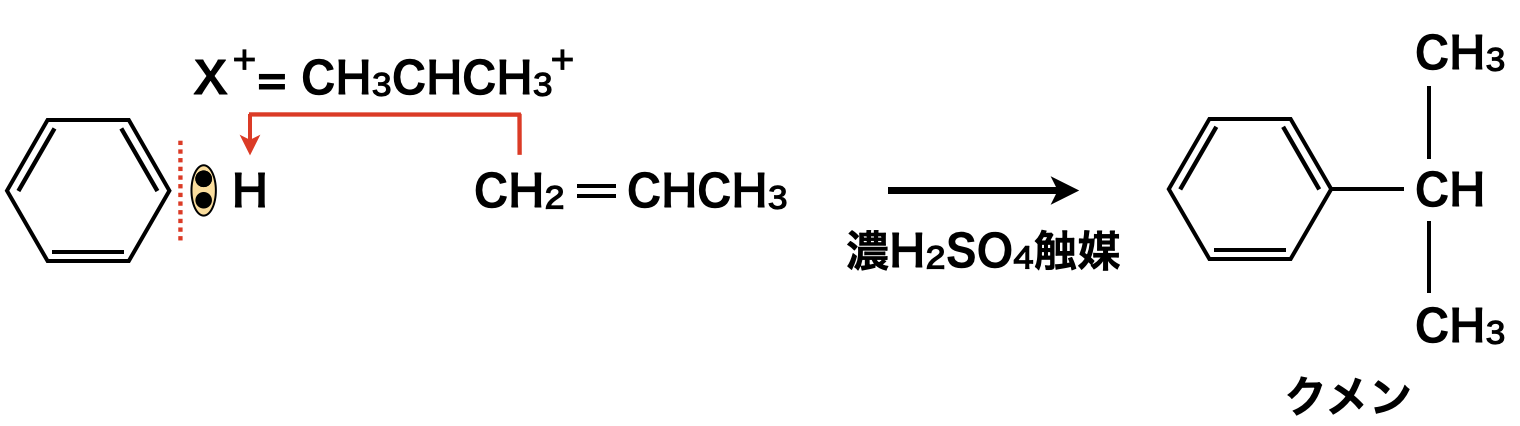
まず濃\(\rm{H_2SO_4}\)を触媒としてプロペン(\(\rm{CH_2=CHCH_3}\))に作用させると,\(\rm{CH_3CH_2CH_3^+}\)イオンが生成し,\(\rm{SE1}\)反応によってベンゼンに攻撃し,クメンが生成します.
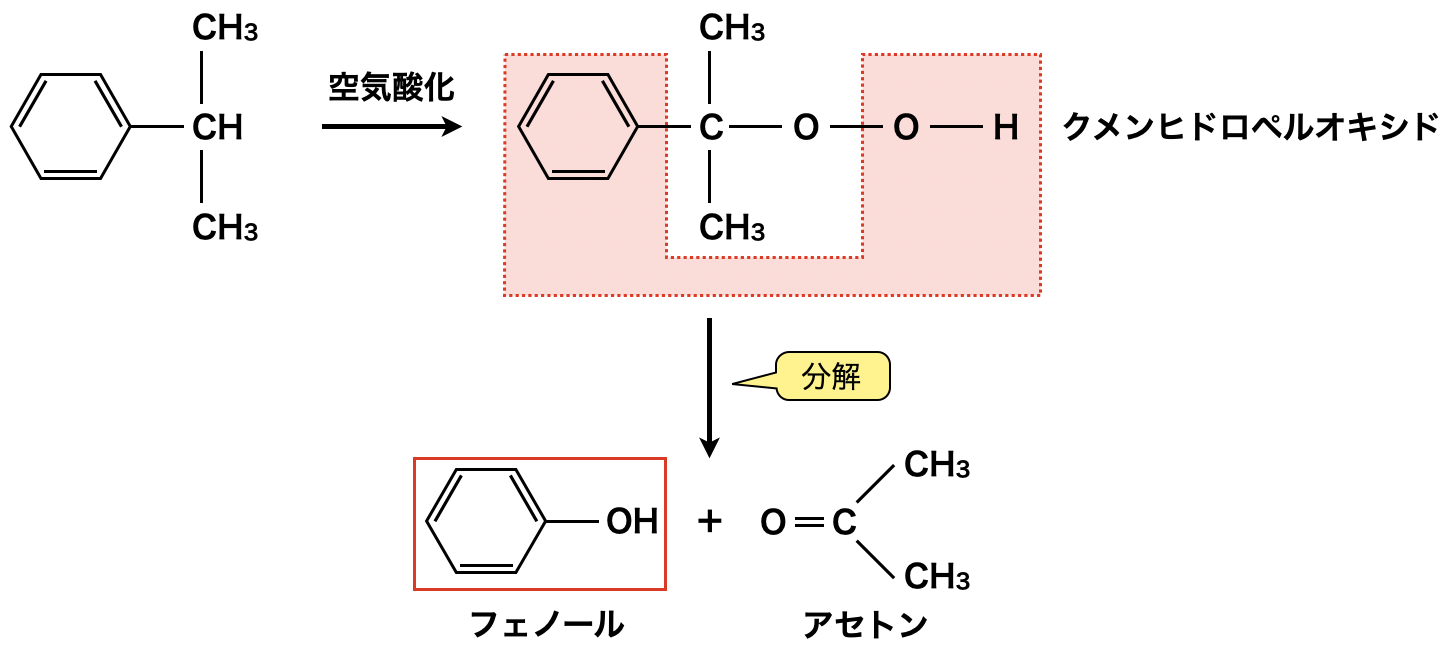
このクメンを\(\rm{100^\circ C}\),数百\(\rm{kPa}\)で空気酸化すると,クメンヒドロペルオキシドが生成します.ここで「ペル」とは,多いという意味です!このクメンヒドロペルオキシドを希\(\rm{H_2SO_4}\)で\(\rm{50^\circ C\ }\)〜\(\rm{\ 60^\circ C}\)で加熱すると,フェノールとアセトンに分解されます.
アニリンの生成法
芳香族の\(\rm{Big-3}\)のうちの\(1\)つであるアニリンも\(\rm{NH_2^+}\)イオンが生成できないので,\(\rm{SE}\)反応では生成されません.
アニリンについては,ベンゼン環とベンゼン環に結合する原子まで同じ化合物を「改造」して生成します!今回のキーポイントは「改造」です!!
それでは詳しく見ていきましょう!
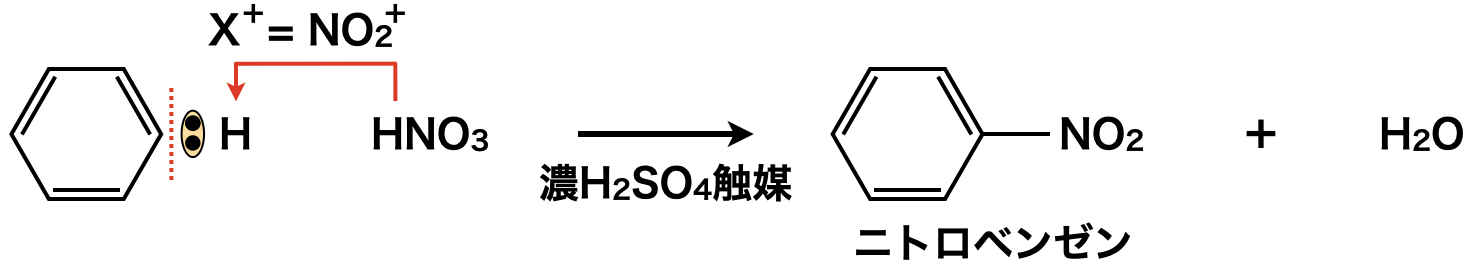
ベンゼン環に\(\rm{N}\)原子が結合している点でアニリンと似ているのはニトロベンゼンです.そのためベンゼンに混酸(濃\(\rm{H_2SO_4}\):濃\(\rm{HNO_3} = 3:1\)で混合したニトロ化の試薬)を作用させ,\(\rm{NO_2^+}\)イオンから\(\rm{SE1}\)反応によってニトロベンゼンを作ります.
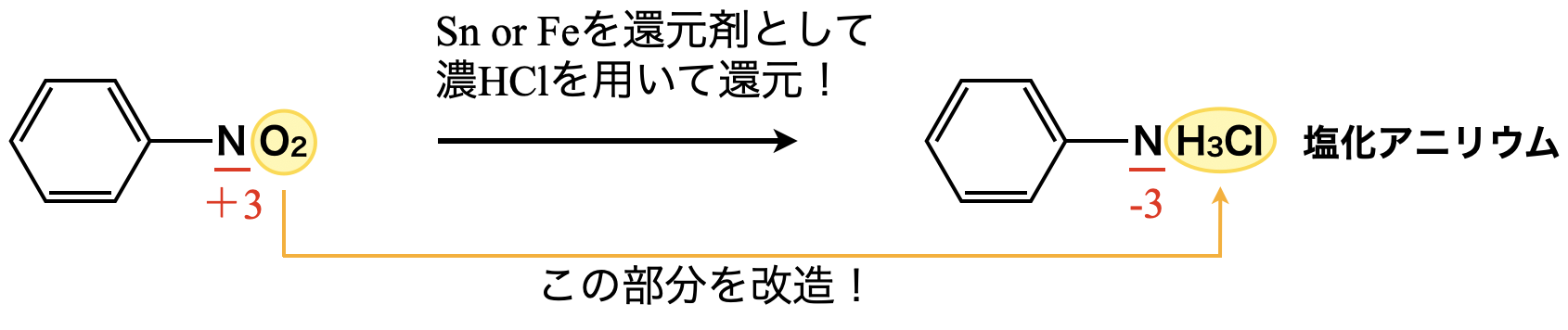
生成したニトロベンゼンを濃\(\rm{HCl}\)条件下で還元剤に\(\rm{Sn\ or\ Fe}\)を用いてアニリンに還元します.生成したアニリンは\(\rm{HCl}\)の\(\rm{H^+}\)イオンを\(\rm{N}\)のもつ非共有電子対が受け取り,塩化アニリウムに変化していることに注意していください!
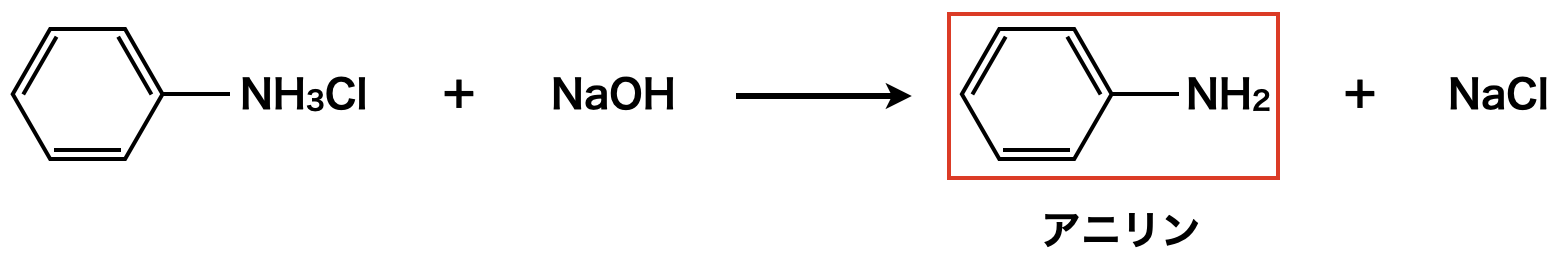
最後に生成した塩化アニリウムは\(\rm{NaOH}\)などの強塩基を加えることで,アニリンに変化させます.
ここでニトロベンゼンから塩化アニリウムを生成する反応式について考えてみましょう!
ニトロベンゼンを還元して塩化アニリウムを生成する反応式を考えるために,それぞれの半反応式を考えてみましょう!
\(\rm{Sn}\)を還元剤として反応させた場合,\(\rm{Sn}\)の安定酸化数は\(+4\)で,\(\rm{Cl^-}\)存在下では\(\rm{SnCl_4}\)になります.また\(\rm{Sn}\)は両性元素のため,錯イオンを形成して溶解します.これを考慮すると,以下のような半反応式が得られます.

(還元剤の半反応式)\(×3\),(酸化剤の半反応式)\(×2\)として,\(e^-\)の量を等しくさせます!

ここで,両辺に\(\rm{2Cl^-}\)を加えることで,塩酸と塩化アニリウムが生成します!

最後に塩化アニリウムは\(\rm{NaOH}\)などの強塩基を加えることで,アニリンに変化させます.
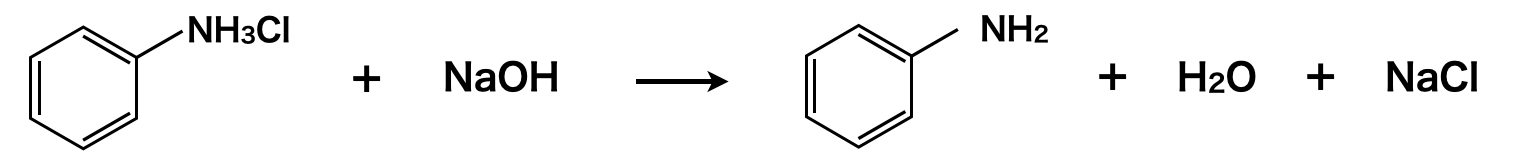
アニリウムイオンからアニリンへの反応について,反応前後の溶液に注目してみましょう!
反応前の溶液:\(\rm{HCl\ \cdot\ SnCl_4\ \cdot\ }\)塩化アニリウム
反応後の溶液:アニリン\(\rm{\ \cdot\ NaCl\ \cdot\ NaOH}\)(反応せずに残ったもの)\(\rm{\ \cdot\ Sn}\)の\(\rm{OH^-}\)による錯イオン
アニリンは電気的に中性なので水に溶けにくい上に,融点が\(\rm{-6^\circ C\ }\)で常温では液体で,アニリンは溶液に浮いています.
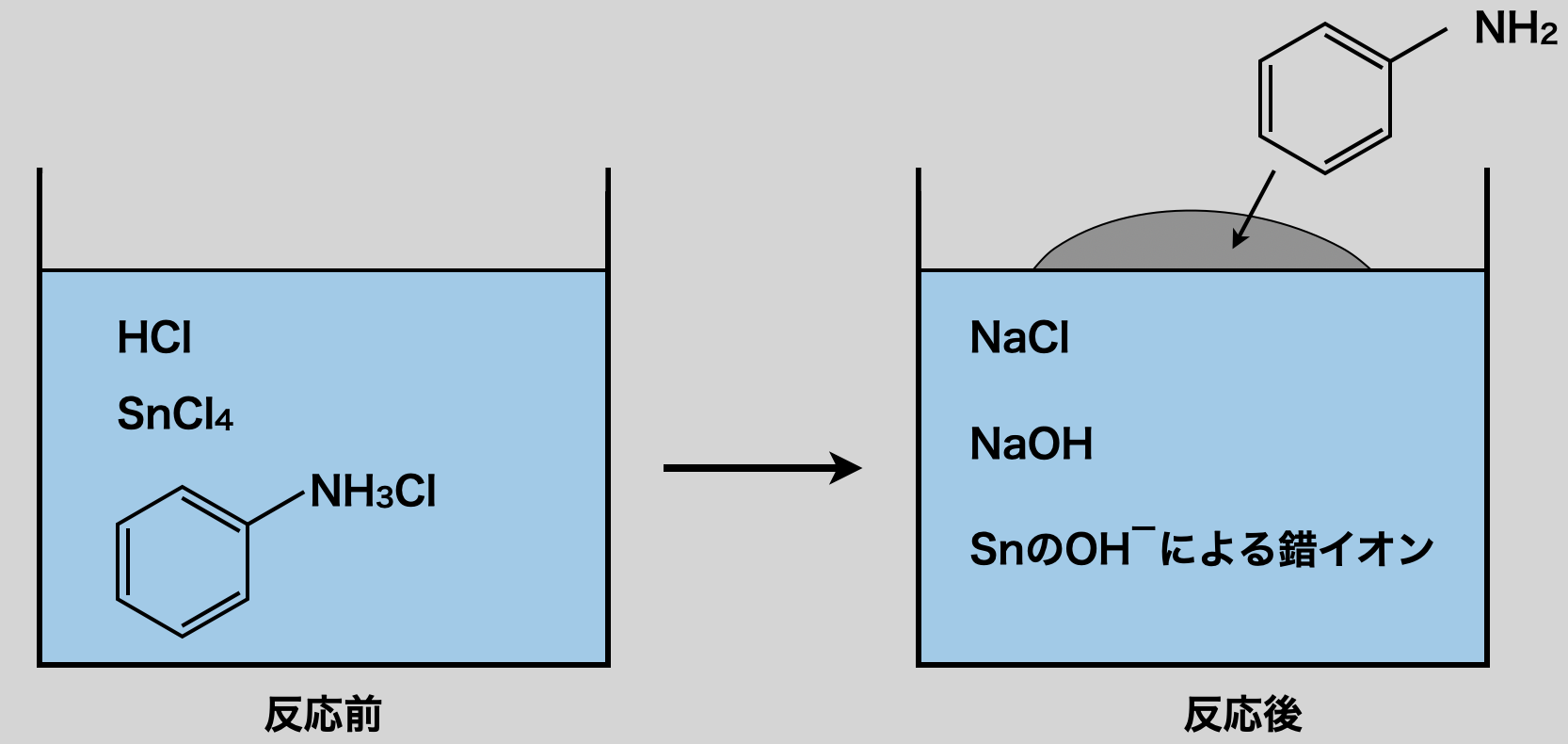
安息香酸の生成法
安息香酸についてもアニリンと同様に,「改造」という考え方を使って生成していきます.
安息香酸は炭素まで構造が同じアルキルベンゼンを,\(\rm{KMnO_4}\)を中性条件で酸化する官能基の改造で生成します.アルキルベンゼンについては,フリーデルクラフツ反応により下のような例があります.
・\(\rm{AlCl_3}\)触媒条件下で\(\rm{CH_3Cl}\)から\(\rm{CH_3^+}\)イオンを生成し,\(\rm{SE1}\)反応でトルエンを得る
・濃\(\rm{H_2SO_4}\)を触媒としてエチレン(\(\rm{CH_2=CH_2}\))から\(\rm{CH_2CH_3^+}\)イオンを生成し,\(\rm{SE1}\)反応でエチルベンゼンを得る
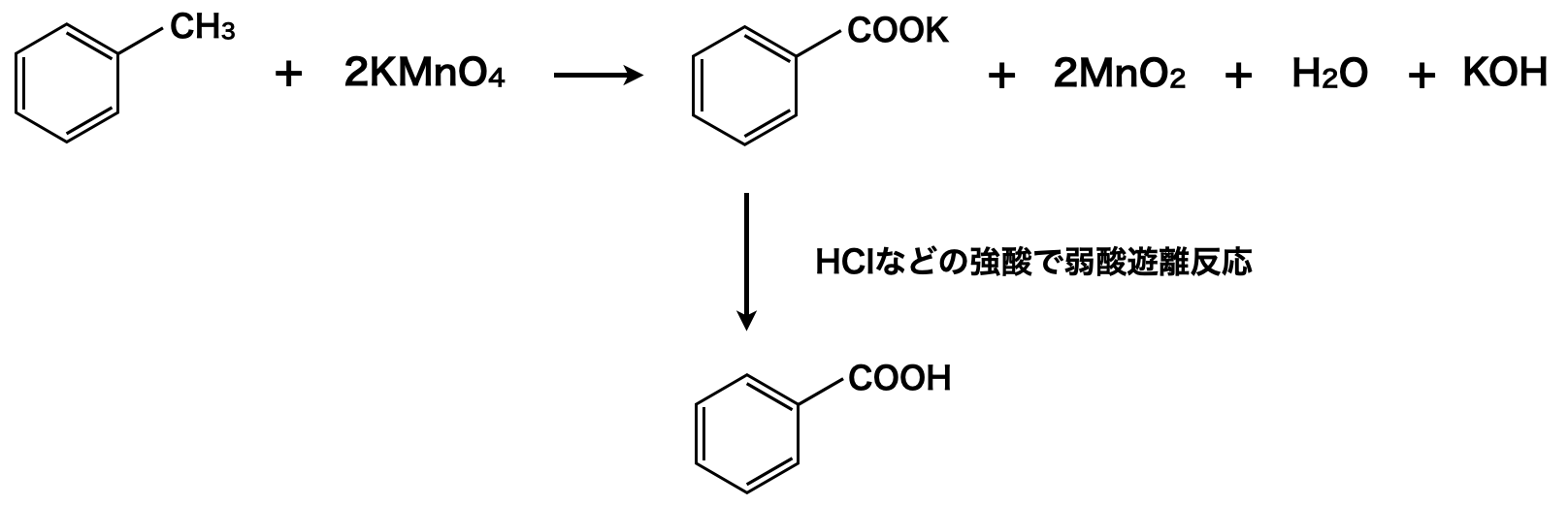
このようにして得られたアルキルベンゼンに対して\(\rm{KMnO_4}\)を中性条件で反応させると,ベンゼン環はそのままでアルキル基が酸化されてカルボキ基の陰イオンになります.最後に芳香族カルボン酸アニオンに\(\rm{HCl}\)などの強酸を加えることで,弱酸遊離反応させ,芳香族カルボン酸にします!
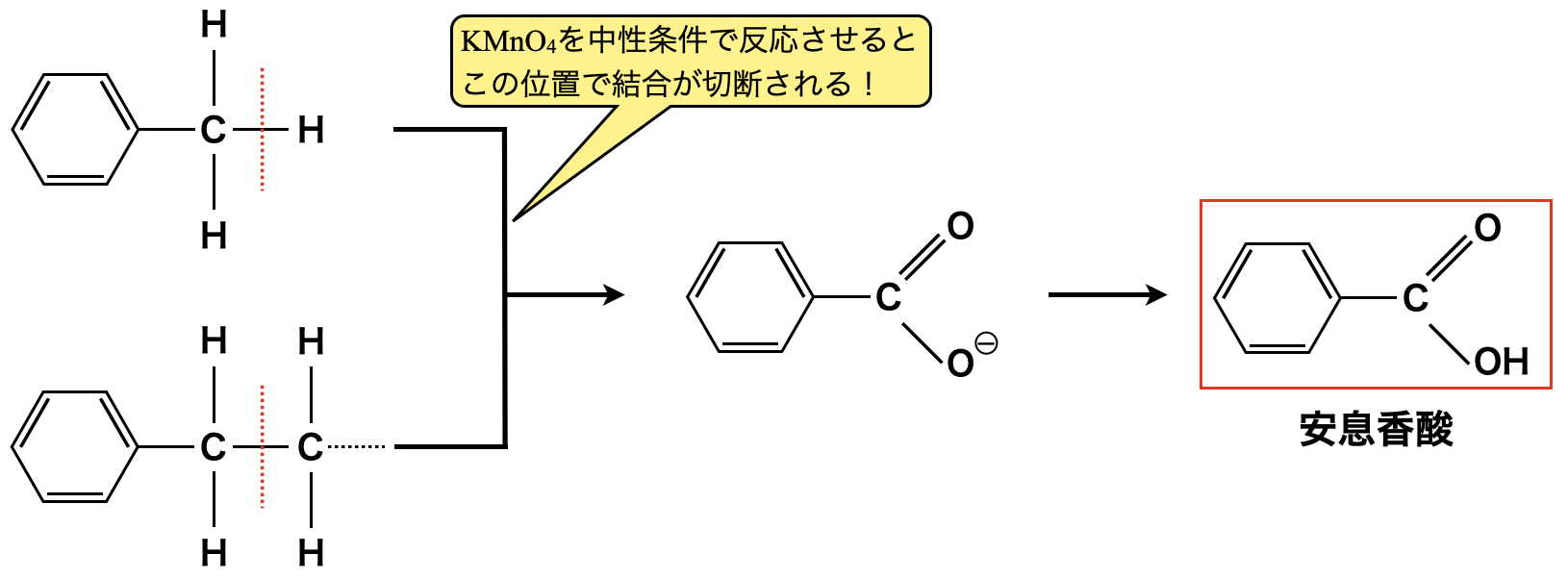
\(\rm{KMnO_4}\)は酸性条件と中性条件で半反応式が異なります.
酸性条件:\(\rm{MnO_4^-\ +\ }\)\(5e^-\ \rm{+\ 8H^+\ →\ 4H_2O\ +\ Mn^{2+}}\)
中性条件:\(\rm{MnO_4^-\ +\ 2H_2O\ +\ }\)\(3e^-\ →\ \rm{MnO_2\ +\ 4OH^-}\)
酸性条件と中性条件で電子を得る数が異なるということは,酸化剤としての能力が異なるということです.\(\rm{MnO_4^-\ 1\ mol}\)に対して,酸性条件では\(\rm{5\ mol}\),中性条件では\(\rm{3\ mol}\)であるため,中性条件の方が酸化剤としての能力は低くなります.
そして今回はベンゼン環があり,酸性条件では強く酸化され過ぎてしまうので,中性条件でマイルドに反応させています!
酸化されるアルキルベンゼンがトルエンである場合は,入試にも出題されることがあるので,覚えておきましょう!
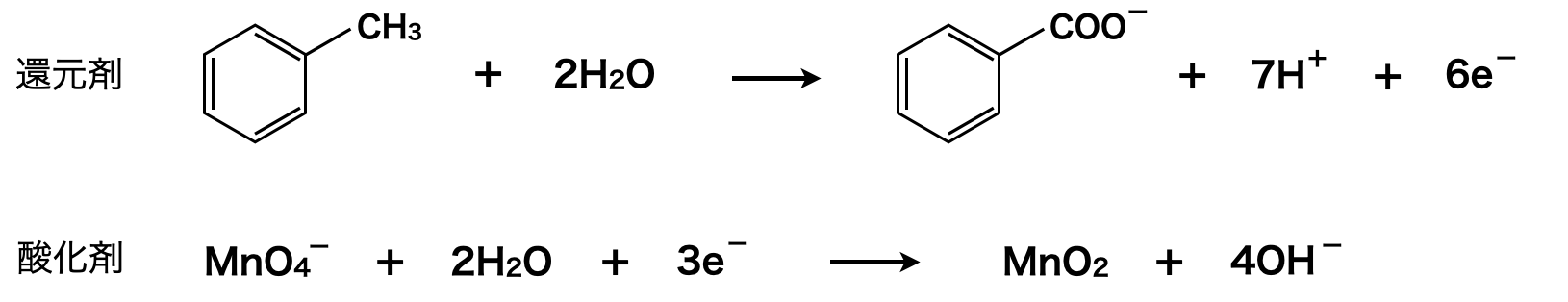
(酸化剤の半反応式)\(×2\)とすることで,還元剤・酸化剤の\(e^-\)が等しくなります.さらに右辺について,\(\rm{7H^+}\)と\(\rm{8OH^-}\)を反応させることで,\(\rm{7H_2O\ +\ OH^-}\)となります!
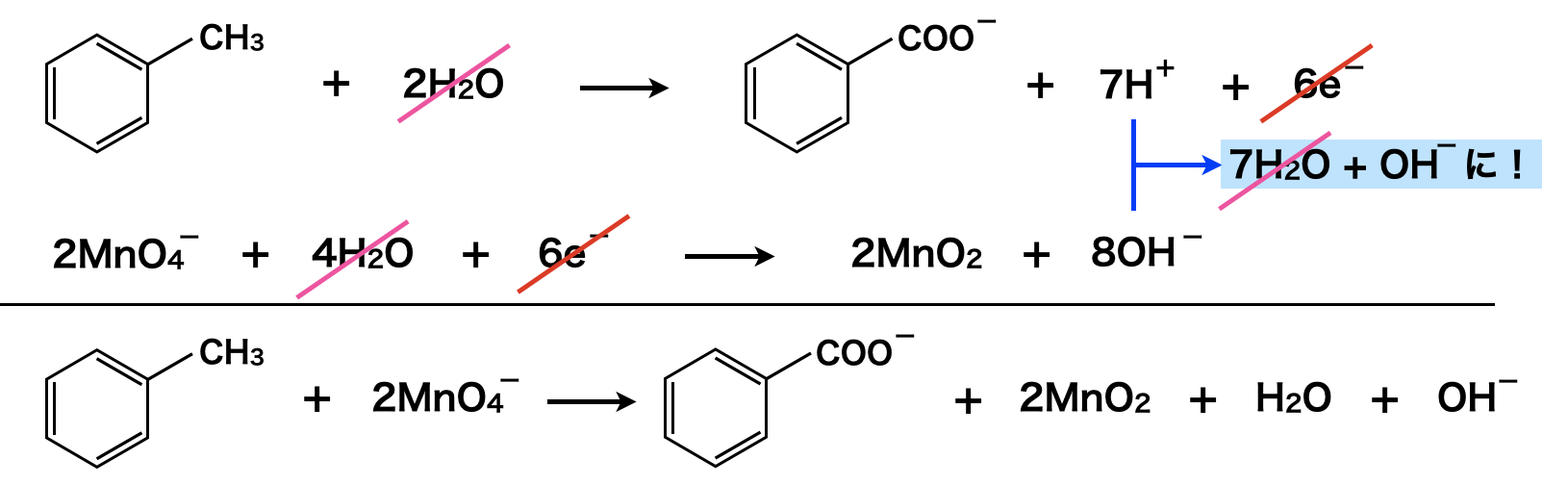
上式の左辺の\(\rm{2MnO_4^-}\)の相方が\(\rm{2K^+}\)であり,それが右辺では安息香酸イオンと\(\rm{OH^-}\)イオンになるので,それらをペアにしてあげると下のようになります.最後に弱酸遊離反応を行うことで,安息香酸が生成されます.
ジアゾ化
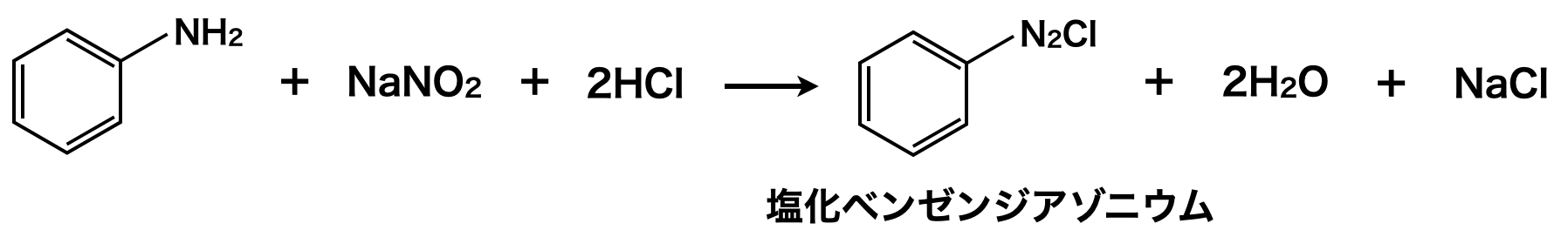
第1級アミン(\(\rm{R-NH_2}\))と亜硝酸(\(\rm{HNO_2}\))を反応させてジアゾニウム塩(\(\rm{R-N_2^+X^-}\))を得る反応をジアゾ化といいます.
大学入試では,アニリン(\(\rm{or}\) アニリンが\(\rm{HCl}\)で中和された塩化アニリウム)などの芳香族アミンと亜硝酸ナトリウム(\(\rm{NaNO_2}\))に\(\rm{HCl}\)を反応させ,塩化ベンゼンジアゾニウムのような芳香族ジアゾニウムイオンを生成させる反応が出題されます.
生成したジアゾニウム塩は\(\rm{5^\circ C\ }\)以上になると加水分解し,フェノール類と\(\rm{N_2}\)になるので,ジアゾ化反応は\(\rm{0^\circ C\ }\)の氷冷下で行います.
こちらの反応は\(\rm{SE2}\)反応の応用であるジアゾカップリング反応のところで書いています!
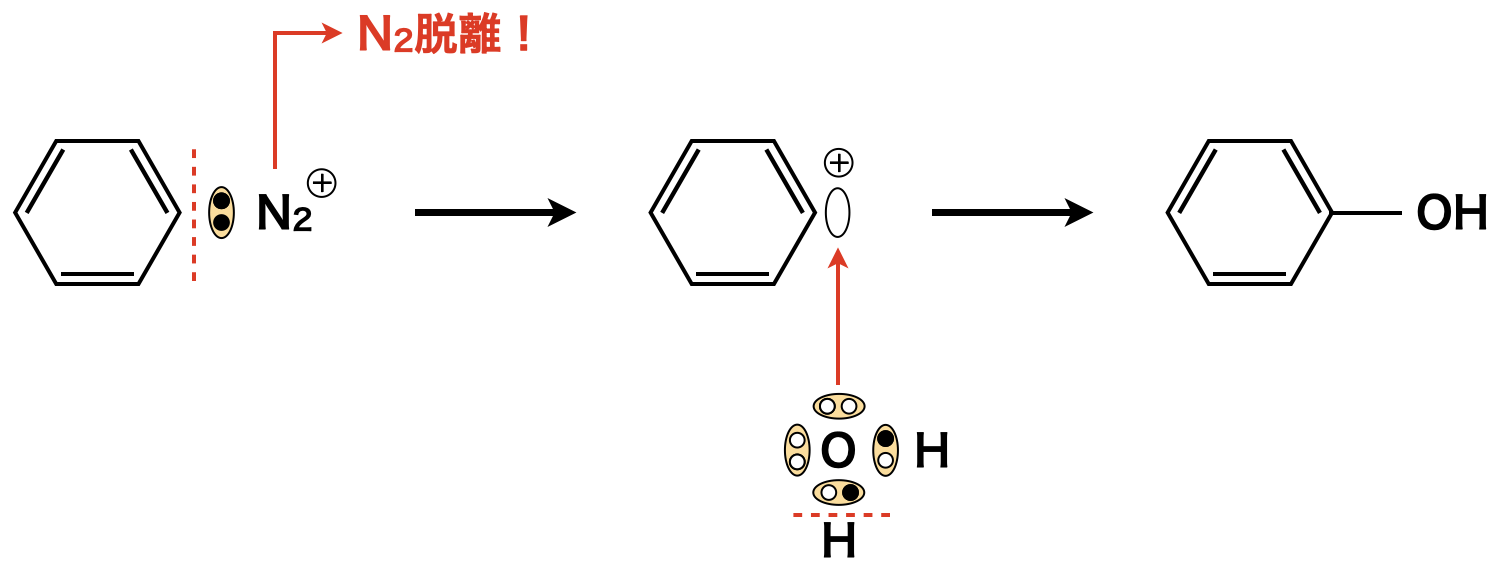
亜硝酸ナトリウム(\(\rm{NaNO_2}\))に\(\rm{HCl}\)を加えると,亜硝酸イオン(\(\rm{NO_2^-}\))に\(\rm{H^+}\)が攻撃してニトロ化において生成したのと同じように\(\rm{NO^+}\)が生成します.そして\(\rm{NO^+}\)イオンが毎度おなじみの「すきま」「うめます」反応で攻撃し,\(\rm{H_2O}\)が脱離することで,ベンゼンジアゾニウムイオンが生成します.
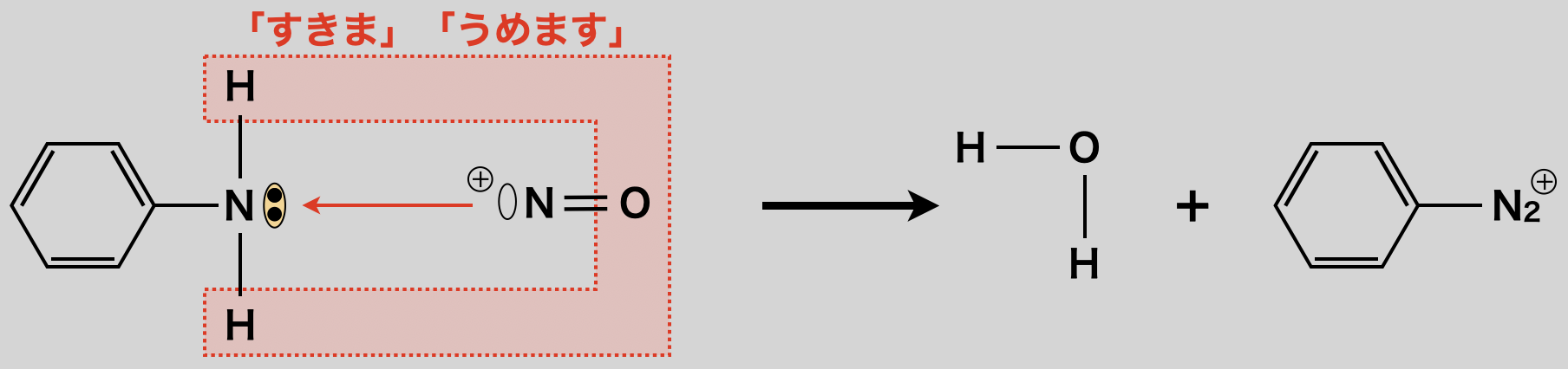

しっかりと頑張っていきましょう!!



コメント