
電離定数はいろいろなことを理解するのに非常に便利なツールなので,仲良くしておきましょう!笑
それでは今回はベンゼン環の反応についても解説しておきます!
ベンゼン環の反応の基礎
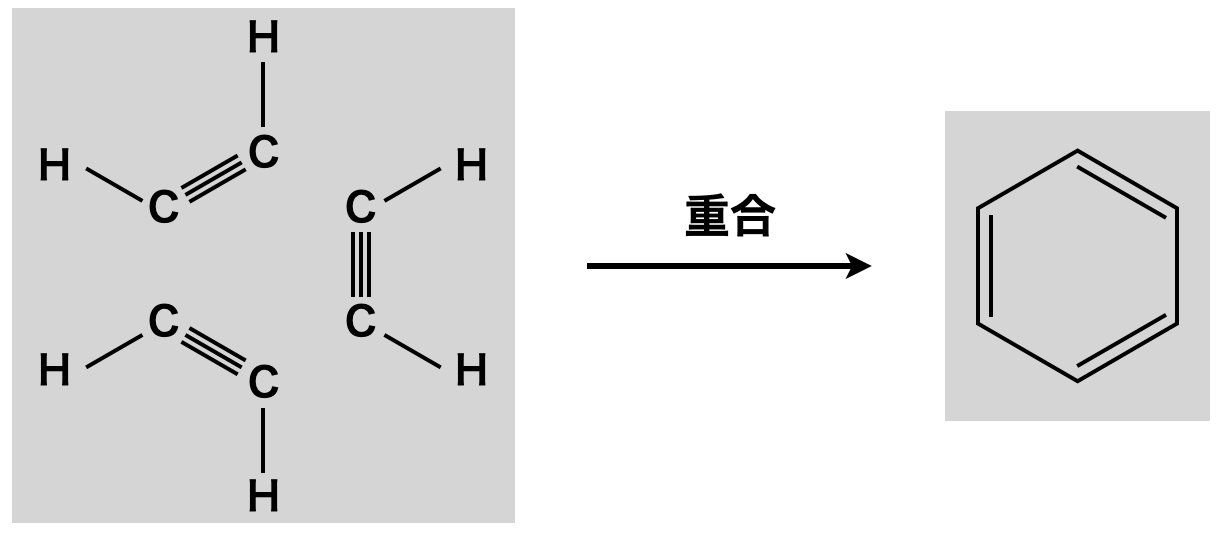
ベンゼン環はアセチレン\(3\)分子を加熱することで,重合して生成されます.
ベンゼン環の反応は非常にあり,教科書などを見ると覚えるのが大変と思うかもしれません.ただ,私たちは今までラジカル・陽イオン・陰イオンの攻撃で考えてきました.今回もこの考え方をふんだんに活用していきましょう!
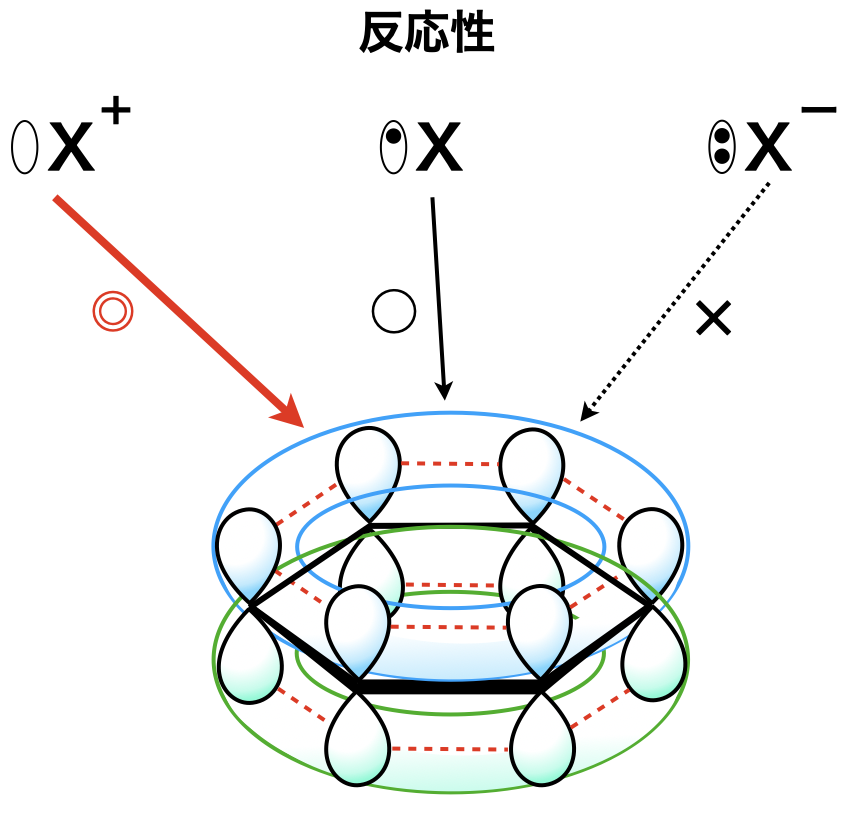
ベンゼン環の\(\pi\)電子は図のように広がり共鳴しています.(これを非局在化といいます)この中で陰イオンの攻撃については,\(\pi\)電子と反発するためベンゼン環と最も反応させにくく,フェノール生成反応を除いては攻撃しません.
そのためラジカル・陽イオンの攻撃を主として理解していきましょう!
ベンゼン環の反応は非常にあるため,以下にラインアップを載せておきます!今自分がどこにいるのかわからなくならないように,少しずつ確認しながら読み進めてくださいね!
① ラジカル付加反応
② 求電子置換反応\(-1\)
③ 求電子置換反応\(-2\)
④ 電子供与基の求電子置換反応の応用
________________________________(ここから下は次回!)
⑤ フェノキシドイオンの求電子置換反応の応用
⑥ フェノール生成法
⑦ アニリン・安息香酸の生成法
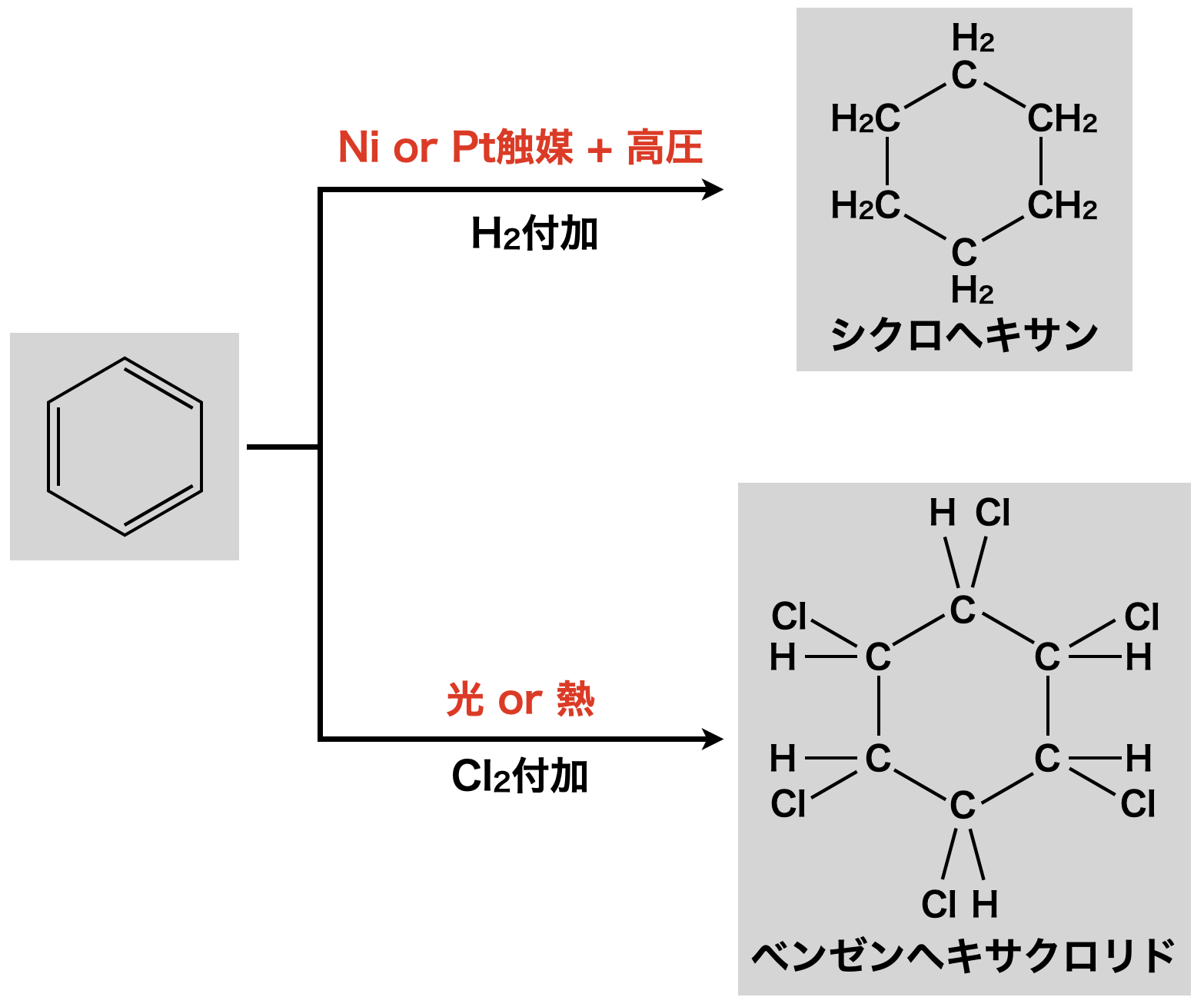
ラジカル付加反応
ベンゼンにラジカルを攻撃させると,下のようにベンゼンの共鳴が一時的に消えて不安定になります.
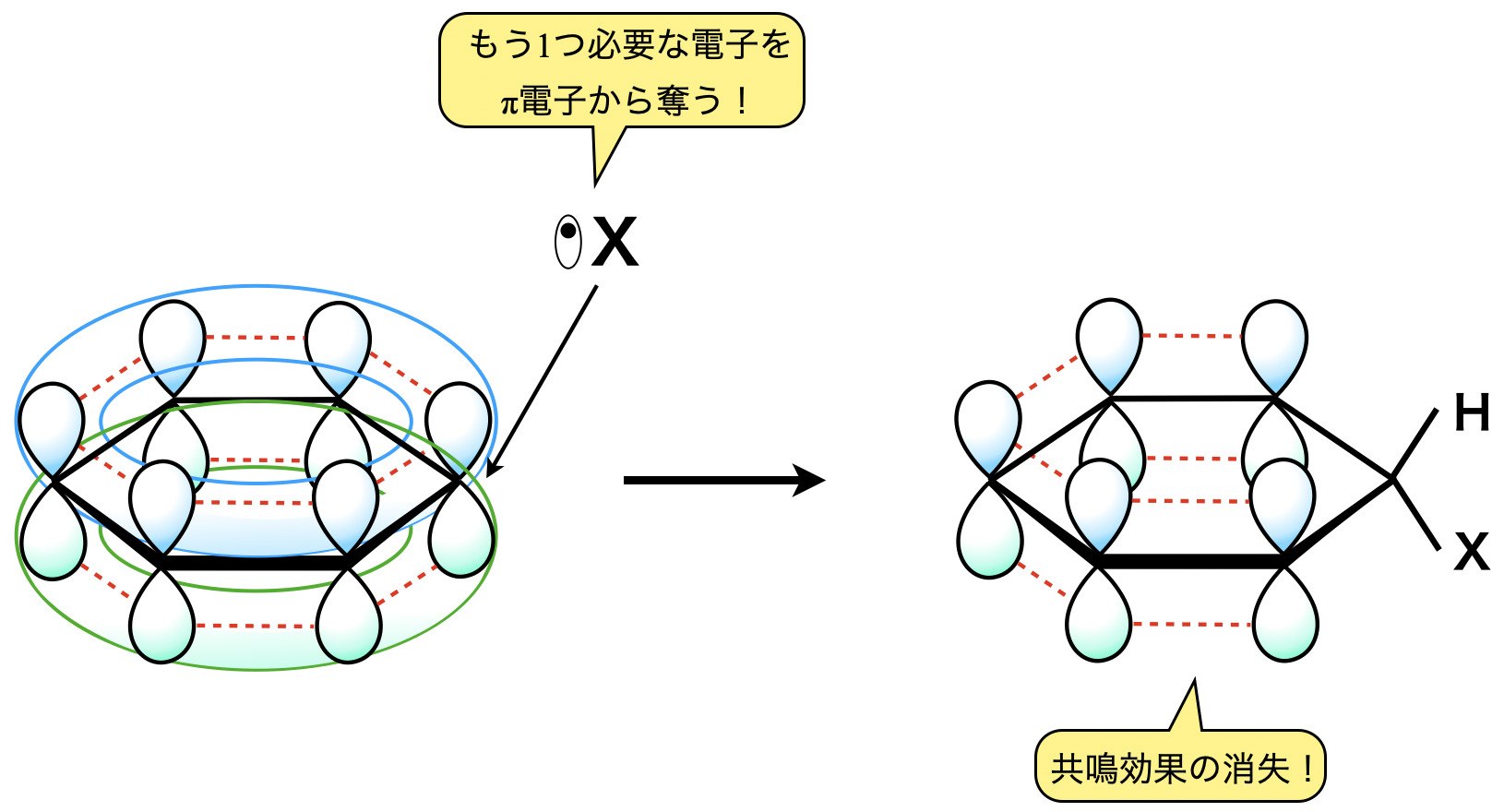
この不安定を避けるために,ラジカルを大量・一気に攻撃します.これにより共鳴が切れた状態を経由しないため,不安定な状態はなくなります.
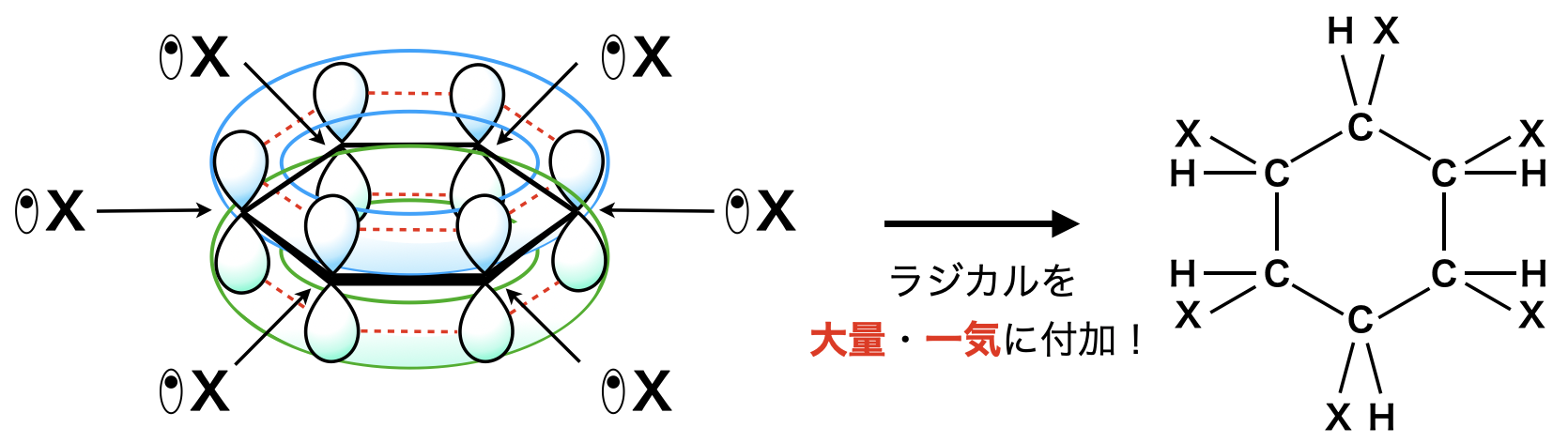
ただ,ラジカルを大量に作ることは大変なため,あまり例はありません.以下の\(2\)つをしっかりと覚えておきましょう!
① \(\rm{Ni\ or\ Pt}\)触媒を用いて\(\rm{H_2}\)を\(\rm{H}\)ラジカルに変化させ,高圧で付加させ,シクロヘキサンに!
② 光 \(\rm{or}\) 熱を加えて\(\rm{Cl_2}\)を\(\rm{Cl}\)ラジカルに変化させ,ベンゼンヘキサクロリドに!
求電子置換反応\(-1\)(\(\rm{SE1}\))
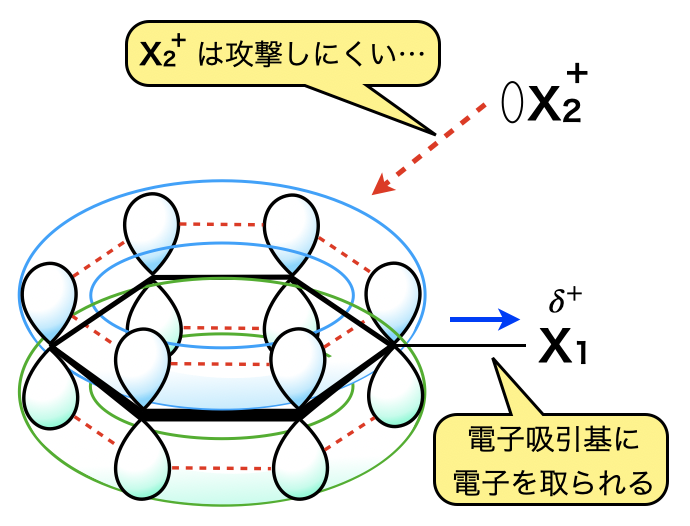
ベンゼン環の非局在化したπ電子に引き付けられる陽イオン(カチオン)を反応させる場合,カチオン同士が反発するため,先程のラジカル反応のように大量・一気に攻撃することはできません.そのため,\(1\)つのベンゼン環に対して\(1\)個のカチオンが攻撃する反応が起こります.
この反応は下のように理解しましょう!
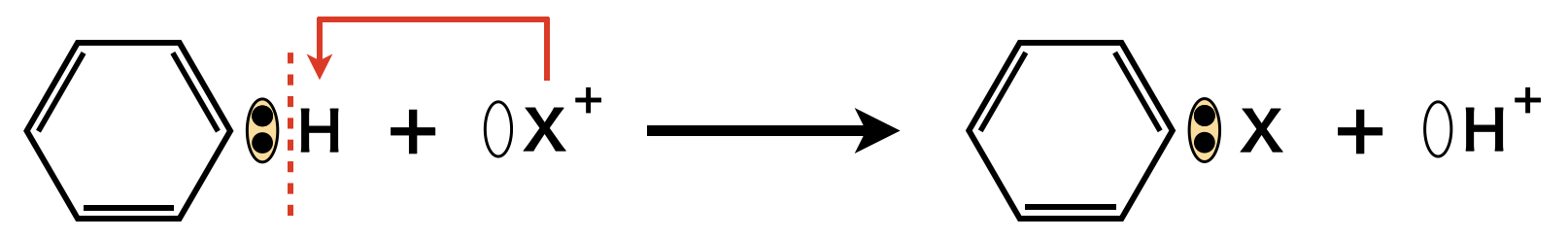
\(\rm{X^+}\)イオンが,ベンゼン環の\(\pi\)電子を求めて\(\rm{H^+}\)と置換する反応なので,求電子置換反応といいます.この求電子置換反応が芳香族の反応の基本スタイルとなります!しっかりおさえてくださいね!
\(\rm{S}\):\(\rm{Substitutional}\)(置換)
\(\rm{E}\):\(\rm{Electrophilic}\)(求電子)
\(1\):\(1\)分子目
これは,\(1\)分子目のカチオンがベンゼン環の\(\pi\)電子を目当てに置換する反応という意味です.
求電子置換反応のためのカチオン生成
\(\rm{SE}\)反応で目的の化合物を得るには,ベンゼン環の\(\rm{H}\)原子と置換して結合する部分のカチオンを生成する必要があります.ただ,ベンゼン環と反応させたい\(\rm{X^+}\)イオンはそんなに簡単には生成できません.そこで必ず触媒を用いて生成します!
以下で,\(3\)通りの方法について見ていきましょう!
\(\rm{FeCl_3 \cdot AlCl_3}\)
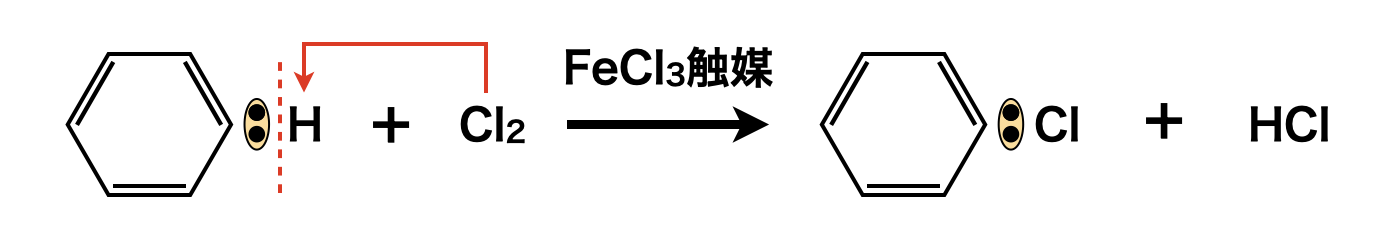
\(\rm{Cl_2}\)に触媒として\(\rm{FeCl_3}\)を作用させると,\(\rm{Cl^+}\)イオンが生成し,\(\rm{SE1}\)反応によりクロロベンゼンが生成します.
これをクロロ化といいます.このとき\(\rm{HCl}\)が生成することを忘れないようにしてくださいね!
また\(\rm{Cl_2}\)と同様に,\(\rm{Br_2}\)を用いることで,ブロモ化を行うこともできます.
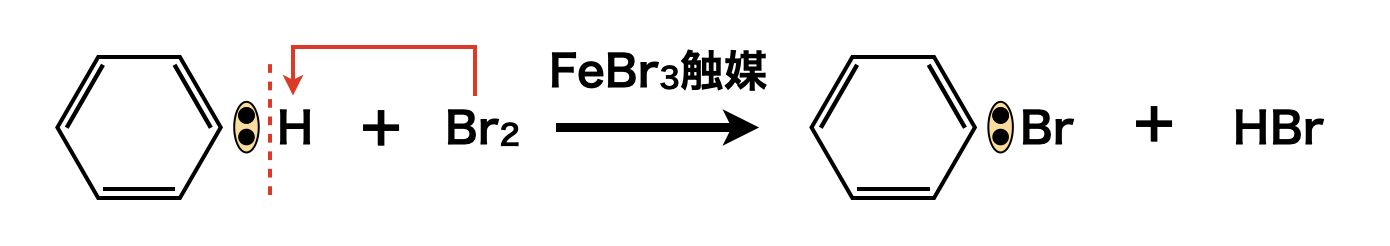
\(\rm{FeCl_3\ or\ FeBr_3}\)は,\(\rm{Cl_2\ or\ Br_2\ +\ }\)鉄粉でも下記のような反応が生じるので,触媒を鉄粉として使うことも\(\rm{OK}\)です!
\(\rm{2Fe\ +\ 3Cl_2\ →\ 2FeCl_3}\)
\(\rm{2Fe\ +\ 3Br_2\ →\ 2FeBr_3}\)
鉄ではなく鉄粉を用いるのは,表面積が大きくなり,よりスムーズに反応が起きるようになります.
クロロ化の詳細な反応機構を解説していきます!
\(\rm{Fe^{3+}}\)イオンは,\(4\)つの\(\rm{Cl^-}\)イオンと錯イオンを形成し,\(\rm{[FeCl_4]^-}\)となると安定する性質があります.\(\rm{Cl_2}\)に\(\rm{FeCl_3}\)を作用させると,\(\rm{[FeCl_4]^-}\)となるため,\(\rm{Cl_2}\)から:\(\rm{Cl^-}\)を奪い取り,結果として\(\rm{Cl^+}\)イオンが生成します.
\(\rm{Cl:Cl\ +\ FeCl_3\ →\ [FeCl_4]^-\ +\ Cl^+}\)
ここで生成した\(\rm{Cl^+}\)イオンがベンゼンと\(\rm{SE}\)反応して,\(\rm{H^+}\)イオンと置換します.
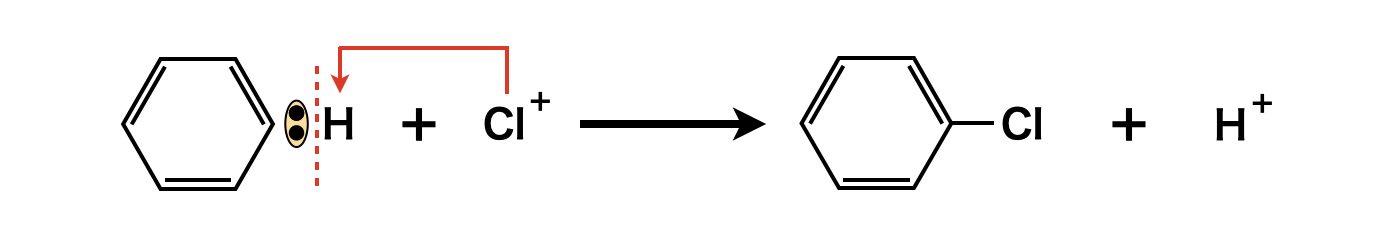
上の反応で生成した\(\rm{H^+}\)イオンが\(\rm{[FeCl_4]^-}\)から\(\rm{Cl^-}\)を奪い取り,\(\rm{HCl}\)になります.結果として,\(\rm{FeCl_3}\)が再生することになり,\(\rm{FeCl_3}\)はクロロ化の触媒として作用しています.
ブロモ化も全く同じプロセスで起こります.
\(\rm{Cl_2 \cdot Br_2}\)をハロゲン化アルキル・ハロゲン化アシルに置き換え,触媒を\(\rm{FeCl_3}\)より能力の高い\(\rm{AlCl_3}\)に変えると,アルキル化・アセチル化ができます.
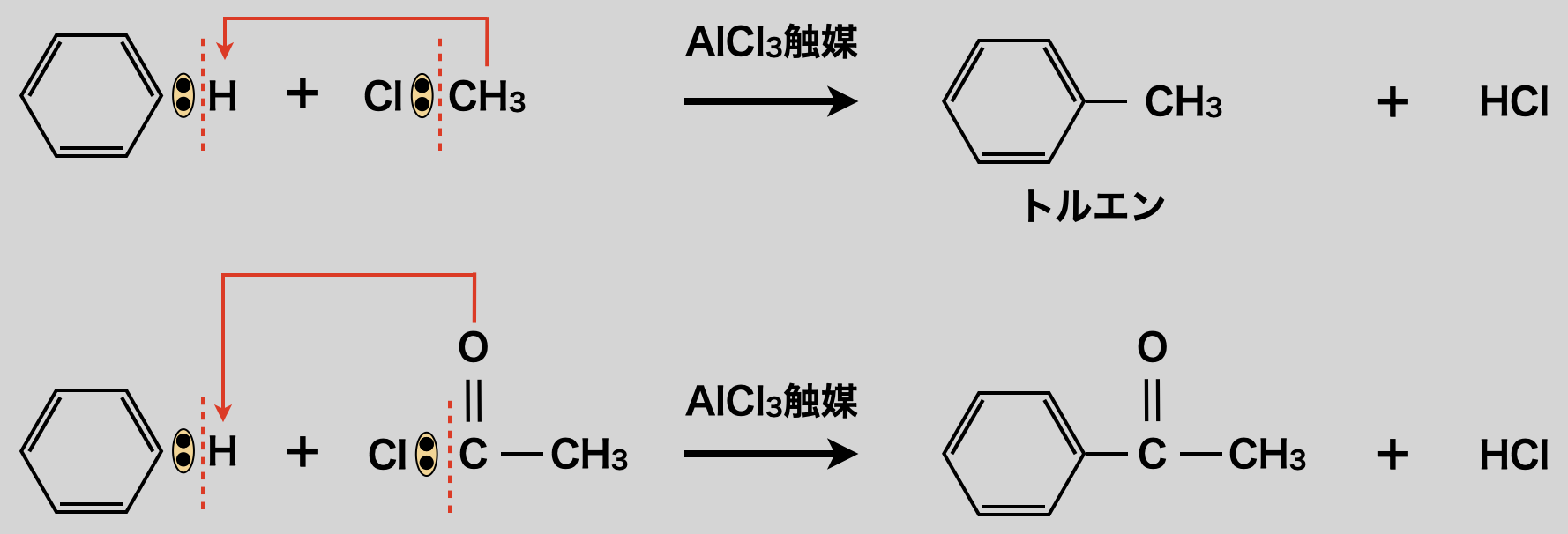
上記のアルキル化・アセチル化をフリーデルクラフツ反応(\(\rm{Friedel-Crafts\ reaction}\))といいます.
ニトロ化
濃\(\rm{H_2SO_4}\)を触媒として\(\rm{NO_2^+}\)イオンを作る反応をニトロ化といいます.濃\(\rm{H_2SO_4}\)を触媒として濃\(\rm{HNO_3}\)・濃\(\rm{H_2SO_4}\)を作用させ,\(\rm{NO_2^+}\)イオンが生成し,\(\rm{SE1}\)反応によりニトロベンゼンが生成します.

ニトロ化反応は,濃\(\rm{H_2SO_4}\)が触媒としてあった方が反応が起こりやすいですが,濃\(\rm{HNO_3}\)だけでも反応はできます.
それではニトロ化の詳細な反応機構を理解していきましょう!
まずニトロ化を理解する前に酸の強さを覚えておくことが大切です!電離定数\(K_{\rm{a}}\)の値が大きいほど酸としての能力が高いです.

下記のように電離反応の進んでいない濃\(\rm{H_2SO_4}\)と濃\(\rm{HNO_3}\)を混合すると,より強い酸である\(\rm{H_2SO_42}\)分子から,より弱い酸である\(\rm{HNO_31}\)分子の\(\rm{OH}\)の\(\rm{O}\)原子のもつ非共有電子対へ\(\rm{H^+}\)イオンが移動し\(\rm{NO_2^+}\)イオンが生成します.
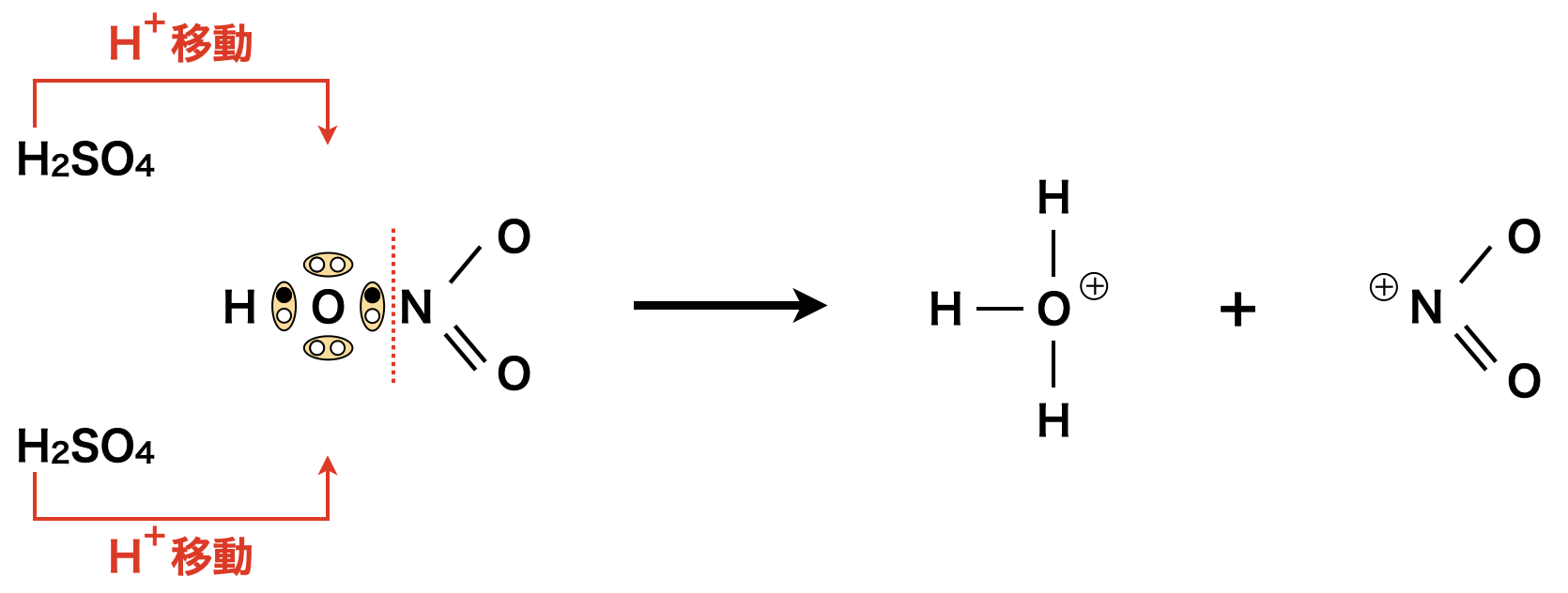
上の反応を反応式で表すと,以下のようになります.
\(\rm{2H_2SO_4\ +\ HNO_3\ →\ 2HSO_4^-\ +\ H_3O^+\ +\ NO_2^+}\)
そしてここで生じた\(\rm{NO_2^+}\)がベンゼンの\(\rm{H}\)原子と置換してニトロベンゼンが生成します.
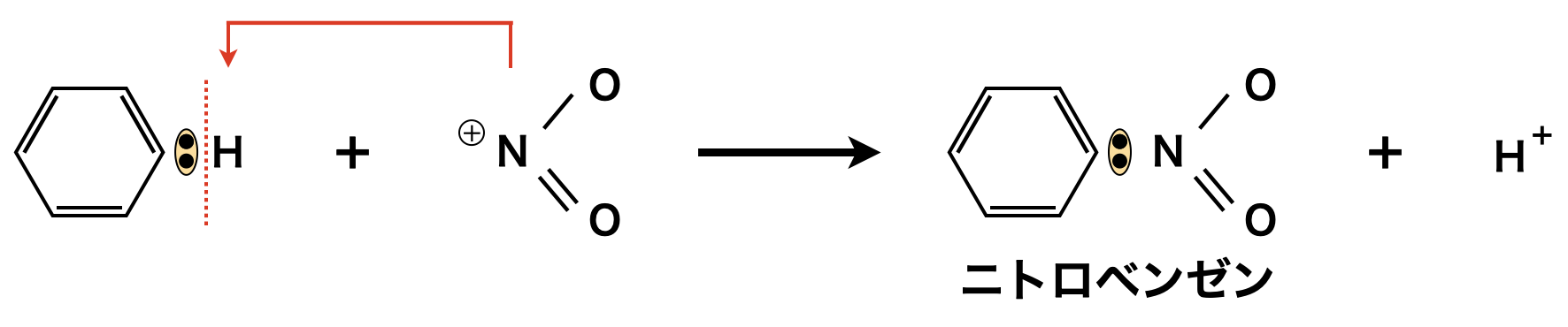
濃\(\rm{H_2SO_4}\)と濃\(\rm{HNO_3}\)を\(3:1\)の体積比で混合した液体を混酸といいます.濃\(\rm{HNO_3}\)のみでもニトロ化は可能ですが,濃\(\rm{H_2SO_4}\)の方が\(\rm{H^+}\)イオンを投げつけるパワーが濃\(\rm{HNO_3}\)よりも大きいので,混酸の方がニトロ化が起きやすいです.
(\(\rm{H^+}\)イオンを投げつけるパワーの強さは,電離定数\(K_{\rm{a}}\)の値を確認してくださいね!)
スルホン化
濃\(\rm{H_2SO_4}\)を触媒として\(\rm{SO_3H^+}\)イオンを作る反応をスルホン化といいます.濃\(\rm{H_2SO_4}\)を触媒として濃\(\rm{HNO_3}\)・濃\(\rm{H_2SO_4}\)を作用させ,\(\rm{SO_3H^+}\)イオンが生成し,\(\rm{SE1}\)反応によりベンゼンスルホン酸が生成します.
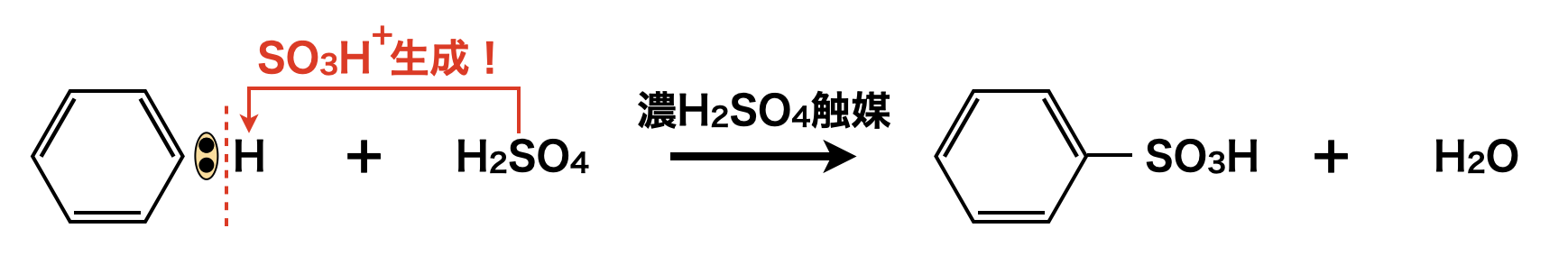
スルホン化の詳細な反応機構を理解していきましょう!
\(\rm{H_2SO_4}\)よりより強い酸は,不安定で特殊なものしかないので,濃\(\rm{H_2SO_4}\)のみで下記のように反応させます.ニトロ化と同じように,電離反応が進んでいない濃\(\rm{H_2SO_4}\)から,別の\(\rm{H_2SO_4}\)分子の\(\rm{OH}\)の\(\rm{O}\)原子の非共有電子対へ\(\rm{H^+}\)イオンが移動して\(\rm{SO_3H^+}\)を生成します.

上の反応を反応式で表すと,以下のようになります.
\(\rm{3H_2SO_4\ →\ 2HSO_4^-\ +\ H_3O^+\ +\ SO_3H^+}\)
そしてここで生じた\(\rm{SO_3H^+}\)がベンゼンの\(\rm{H}\)原子と置換してベンゼンスルホン酸が生成します.
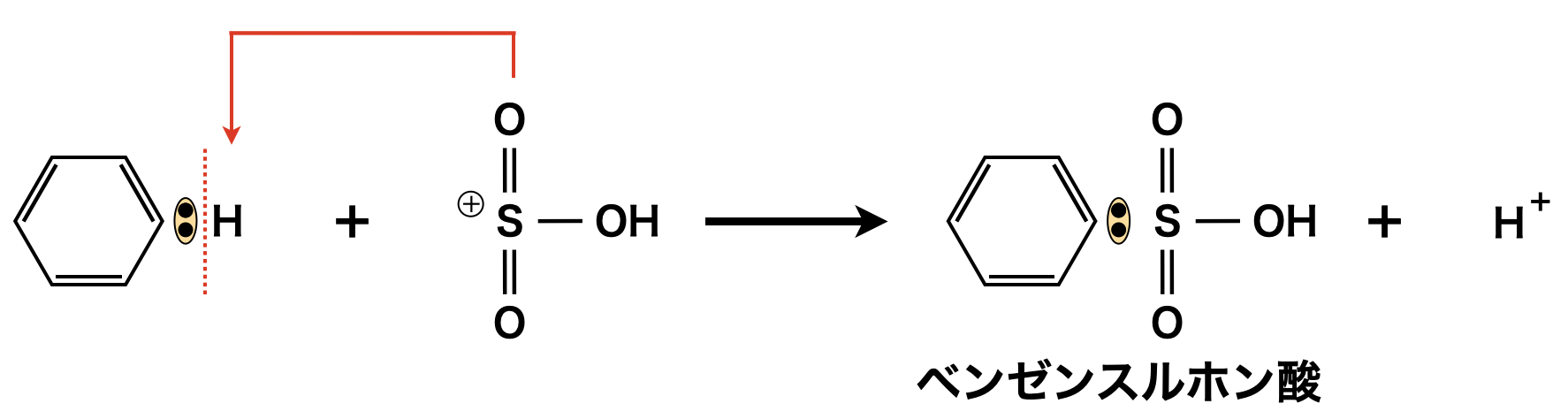
アルケン+濃\(\rm{H_2SO_4}\)
濃\(\rm{H_2SO_4}\)を触媒として\(\rm{CH_2=CH_2}\)(エチレン)・\(\rm{CH_2=CHCH_3}\)(プロペン)を作用すると,\(\rm{CH_2CH_3^+ \cdot CH_3CH_2CH_3}\)イオンが生成し,\(\rm{SE1}\)反応によってエチルベンゼン・クメンが生成します.これらをそれぞれエチル化・イソプロピル化といいます.
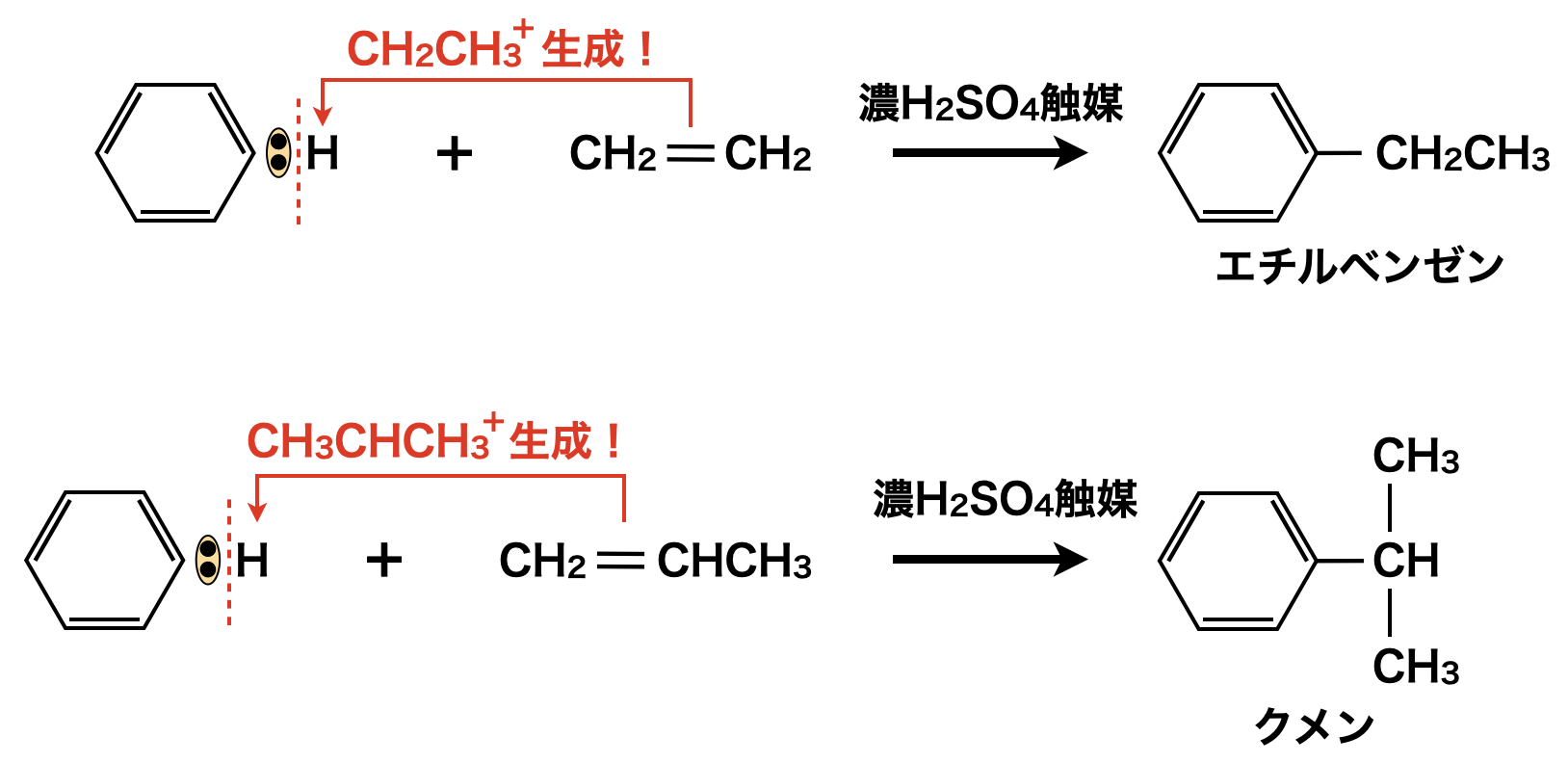
エチル化・イソプロピル化の詳細を見ていきましょう!
濃\(\rm{H_2SO_4}\)を用いて,アルケンに\(\rm{H^+}\)イオンを付加させると,カルボカチオンが生成します.なお,プロペンに\(\rm{H^+}\)を付加させる場合は,マルコフニコフ則が重要になります!
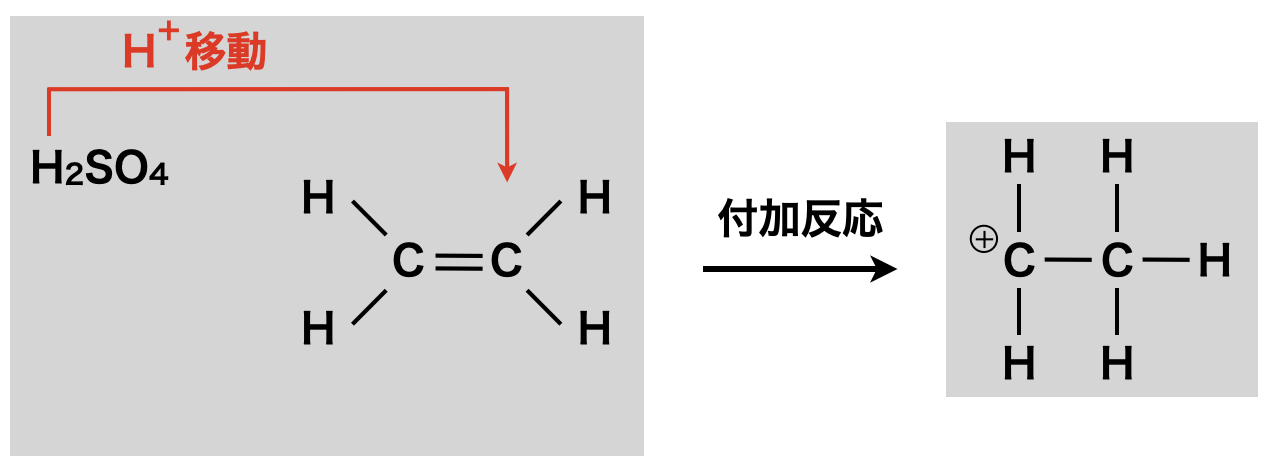

上記の反応で生じたカルボカチオンがSE反応して,ベンゼン環のH原子と置換します.
マルコフニコフ則について不安な方はこちらの記事をご覧ください!https://chemistrystory.com/alkene/
芳香族\(\rm{Big-3}\)であるフェノール・アニリン・安息香酸は,カチオン(陽イオン)が生成できないため,\(\rm{SE}\)反応で生成することはできません.これらの物質は反応経路がより複雑になります.
求電子置換反応\(-2\)(\(\rm{SE2}\))
\(2\)分子目のカチオンがベンゼン環のπ電子を求め\(\rm{H^+}\)イオンと置換する求電子置換反応は,\(1\)分子目にベンゼン環の\(\rm{H}\)原子と置換した置換基の影響を受けます.\(1\)分子目に置換した官能基が電子供与基 \(\rm{\ or\ }\) 電子吸引基かによって反応性が異なります.
それぞれの場合について詳しくみていきましょう!
電子供与基
まず,電子供与基について考えていきましょう!
電子供与基とは,電子をベンゼン環に与える(供与する)置換基のことです!電子供与基にはどのようなものがあるのでしょうか?
① 非共有電子対をもつ原子
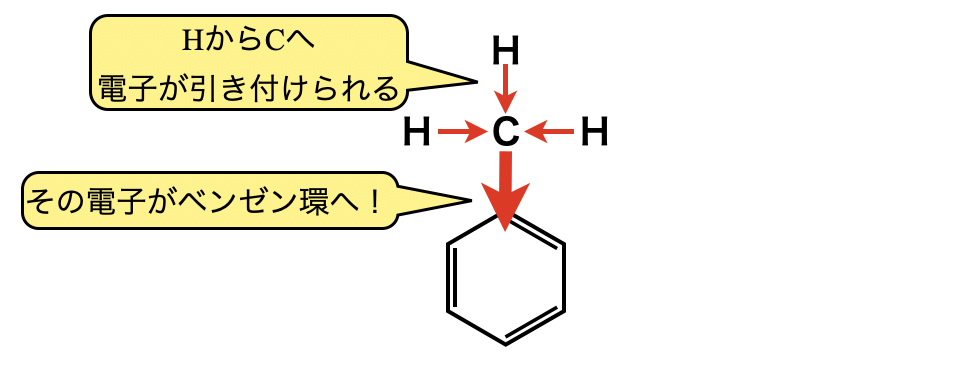
② \(\rm{C \cdot H}\)で構成されるアルキル基
①の場合は非共有電子対が,②の場合はアルキル基の\(\rm{C}\)が\(\rm{H}\)から引きつけた電子がベンゼン環中の\(\pi\)電子とともに共鳴するため,ベンゼン環の中へ流入し,ベンゼン環中の電子が増加します.\(2\)分子目(\(\rm{X_2}\))にベンゼン環に攻撃するカチオンはさらに引き付けられやすくなり,\(\rm{SE}\)反応は起こりやすくなります.\(2\)分子目にベンゼン環に攻撃するカチオンは\(o-\)(オルト位),\(p-\)(パラ位)に置換するので,これを\(o, p\)配向性といいます.電子供与基は「反応を促進させるお助けマン」と考えてください!

電子供与性の官能基の例を見ておきましょう!
この中で最強の電子供与基は,フェノール性ヒドロキシ基です!これは必ず覚えるようにしてください!今後の反応でこの最強のフェノール性ヒドロキシ基を使うことがよく出てきます!
クロロベンゼン・ブロモベンゼン・フェノールは,\(\rm{C}\)原子より電気陰性度の大きい元素が結合していますが,電気陰性度の大きい元素が結合中の電子対を引き付ける力より共鳴効果の方が大きくなり,安定すると考えられます.
またアルキル基は非共有電子対をもちませんが,\(\rm{C}\)の電気陰性度 \(>\ \rm{H}\)の電気陰性度となるため,\(\rm{C}\)原子が\(\rm{H}\)原子から電子を引き付け,その引き付けた電子をベンゼン環に共鳴のため流入できるため,アルキル基は電子供与基として働きます.
電子吸引基
ベンゼン環に先に\(\delta^+\)をもつ電子吸引基が置換していると,\(\delta^+\)がベンゼン環中のπ電子を引き付けるので,ベンゼン環中の電子が減少します.そのため\(2\)分子目にベンゼン環に攻撃するカチオンは引き付けられにくくなり,\(\rm{SE}\)反応は起こりにくくなります.\(m-\)(メタ位)に置換するのがやっととなります.
電子吸引性の官能基の例を見ておきましょう!
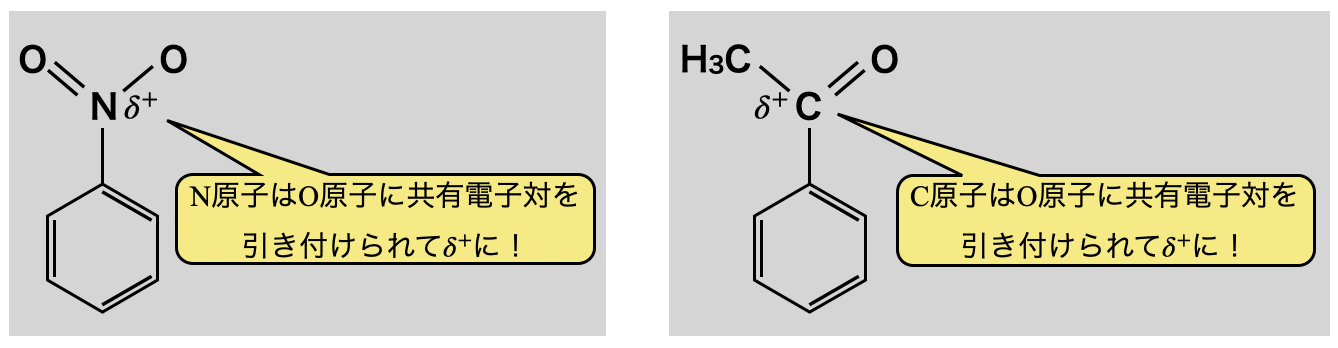
ニトロ基において,\(\rm{O}\)原子の電気陰性度 \(>\ \rm{N}\)原子の電気陰性度であるため,\(\rm{N}\)原子は\(\rm{O}\)原子に共有電子対が引き付けられて,\(\delta^+\)になります.
アセチル基中のカルボニル基もニトロ基と同様に,\(\rm{C}\)原子は\(\rm{O}\)原子に共有電子対が引き付けられて\(\delta^+\)になります.
電子供与基の\(\rm{SE2}\)反応の応用
カチオンがベンゼン環に攻撃し,\(\rm{H}\)原子と置換反応が起こりやすくなる反応です.トリニトロトルエン・ピクリン酸について見ていきましょう!
\(\rm{T.N.T}\)の生成
電子供与性かつ\(\rm{SE2}\)反応を起こりやすくする官能基であるメチル基をもつトルエンに混酸を加えると,\(o,p\)配向性であるため,オルト位・パラ位にニトロ基が置換します.これで生成される物質が\(2, 4, 6\)トリニトロトルエン(\(\rm{T.N.T}\))です.

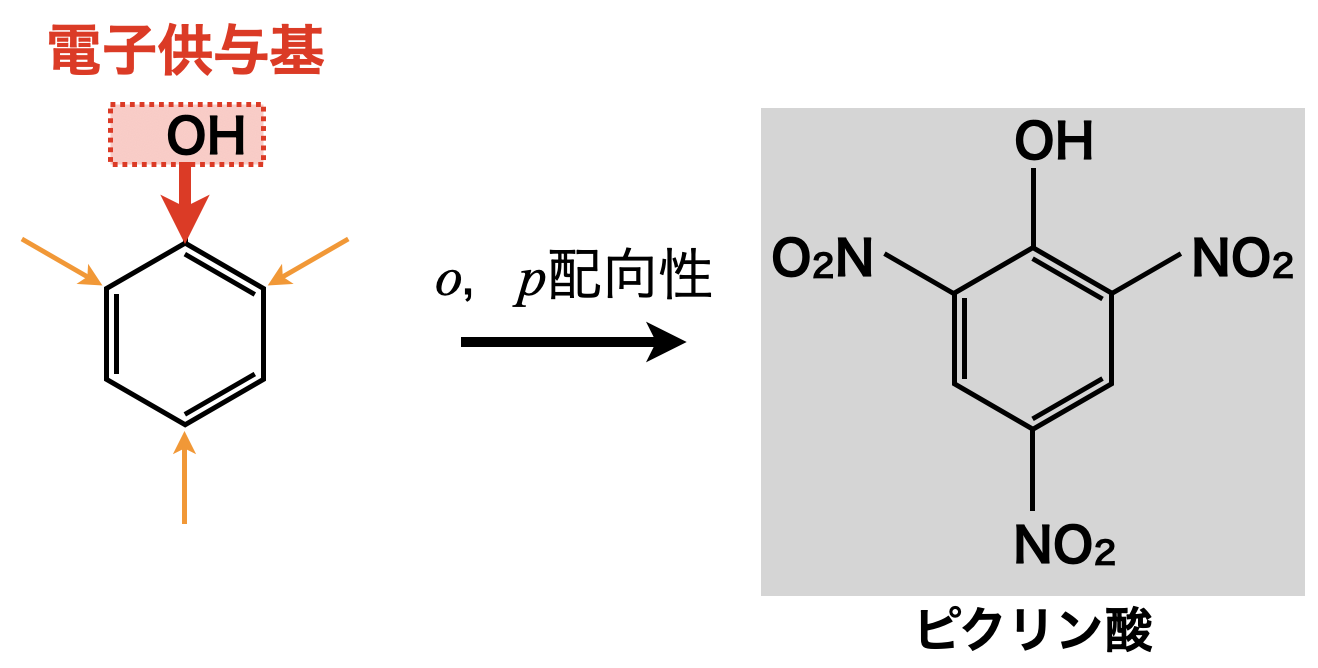
ピクリン酸の生成
電子供与性かつ\(\rm{SE2}\)反応を起こりやすくするフェノールに混酸を加えると,\(o,p\)配向性であるため,オルト位・パラ位にニトロ基が置換します.これで生成される物質がピクリン酸です.
ピクリン酸は,ニトロ基の\(\rm{N}\)原子が電子不足になって\(\delta^+\)を帯びるようになります.
すると,ベンゼン環中の\(\pi\)電子が\(\rm{N}\)原子に引き付けられ,その結果ベンゼン環自体が電子不足になり,ヒドロキシ基中の\(\rm{O}\)原子と\(\rm{H}\)原子の間の共有電子対をベンゼン環が引き付けるようになります.
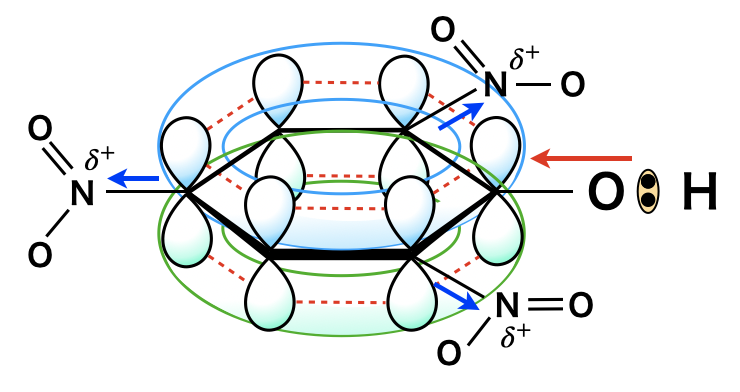
そのため\(\rm{OH}\)基の\(\rm{H}\)原子は\(\rm{H^+}\)イオンに電離しやすくなり,ピクリン酸は強酸となります.
ベンゼン環に流入した\(\rm{OH}\)基の非共有電子対は,電子不足のニトロ基の\(\rm{N}\)原子の\(\delta^+\)に引き付けられています.そのため\(\pi\)電子の密度が低下してしまうため,\(\rm{FeCl_3}\)で呈色反応しなくなります.
フェノールの検出
電子供与性かつ\(\rm{SE2}\)反応を起こりやすくするフェノールに\(\rm{Br_2}\)水を加えると,触媒がなくても反応が起こります.\(o,p\)配向性であるため,オルト位・パラ位に\(\rm{Br^+}\)が置換します.生成される物質は\(2, 4, 6\)トリブロモフェノールで,白色沈殿が生じます.
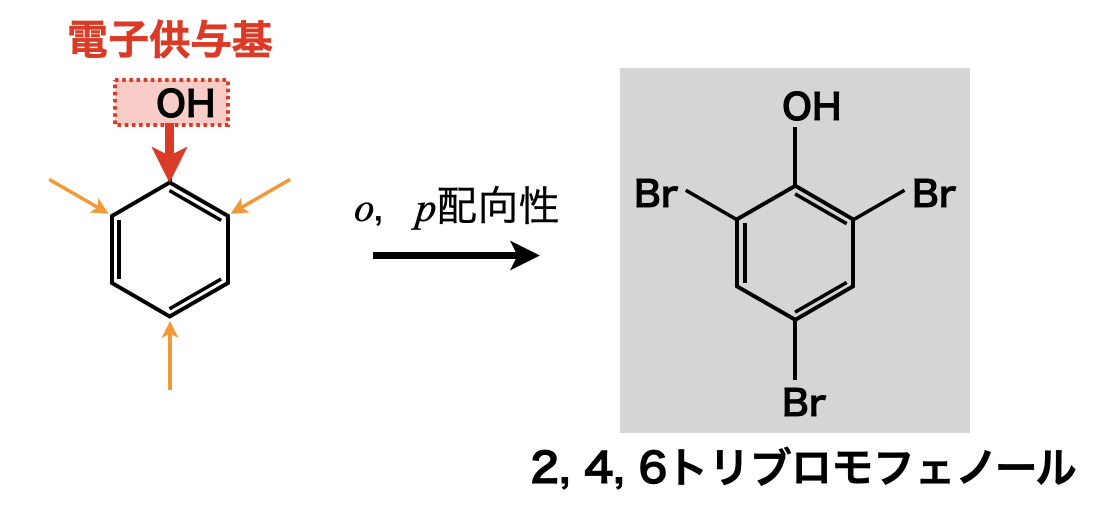
触媒が不要であるということは,つまり,\(\rm{SE2}\)反応が非常に起こりやすいということです!先程説明したように,フェノール性\(\rm{OH}\)基は最強の電子供与基でしたね!
「芳香族化合物で\(\rm{Br_2}\)水に通して白色沈殿が生じたら,フェノールであると判断してください!」
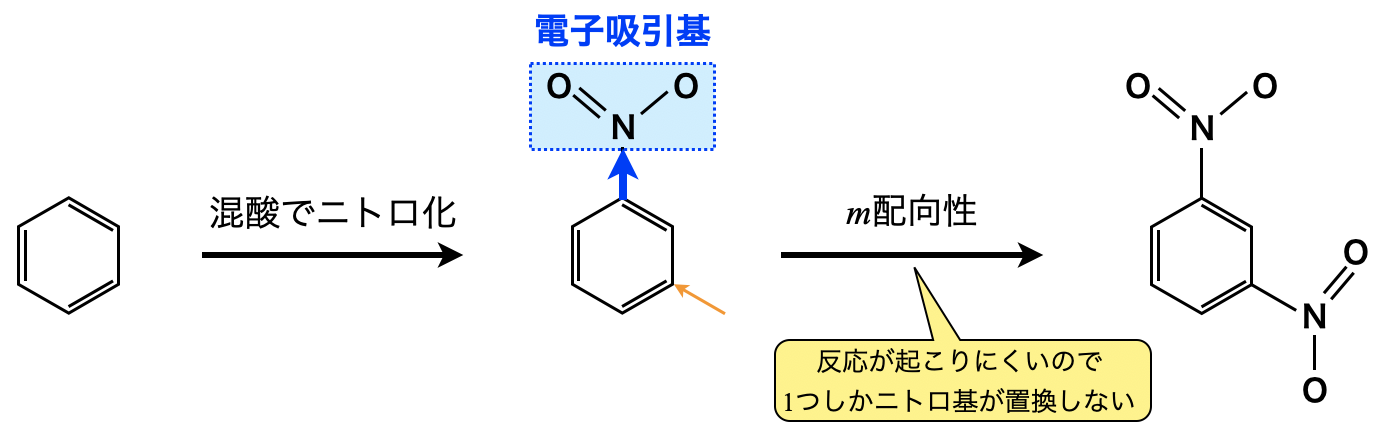
電子供与基をもたないベンゼンの\(\rm{H}\)原子を混酸でニトロ基に置換すると,ニトロ基は電子吸引基であるため,\(\rm{SE2}\)反応が起こりにくくなります.電子吸引基は\(m\)配向性ですが,メタ位にニトロ基が\(1\)つ結合して\(m-\)ジニトロベンゼンが少し生成されますが,ここまでが限界でもう\(1\)つニトロ基が置換されることはありません.



コメント