

アルケンってどんな物質?
まずはアルケンという名前について考えてみましょう.
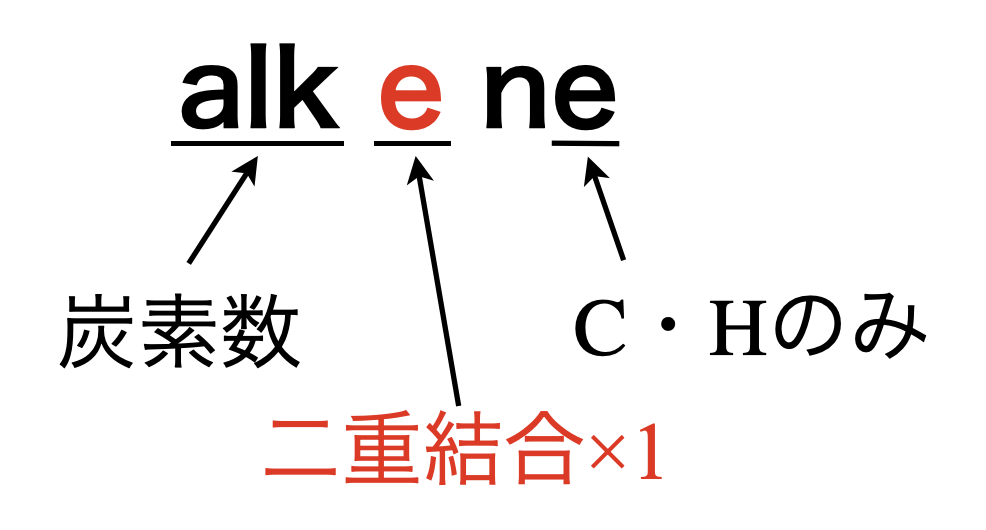
アルケンは構成元素が\(\rm{C}\)と\(\rm{H}\)のみからなり,二重結合(\(\rm{C=C}\))が\(1\)つあります.
\(\rm{alkene}\)の「\(\rm{alk}\)」は炭素数を,「\(\rm{e}\)」は\(\rm{C=C×1}\),語尾の「\(\rm{e}\)」は構成元素が\(\rm{C \cdot H}\)のみであることを表しています.
アルカンと同様に,分子量が大きくなるとファンデルワールス力が大きくなり,沸点も高くなります.
アルケンは
\(\rm{C1}\)〜\(\rm{C4}\):気体
\(\rm{C5}\)〜\(\rm{C18}\):液体
\(\rm{C19}\)〜:固体
と炭素数によって状態変化することをおさえてくださいね!
アルケンの反応
アルケンには反応性の高い\(π\)結合が存在します.その\(π\)結合を攻撃するのは,ラジカル・陽イオンのいずれかとなります.陰イオンについては,\(π\)結合の電子と陰イオンがマイナス同士で反発するため,アルケンとは反応しにくいです.
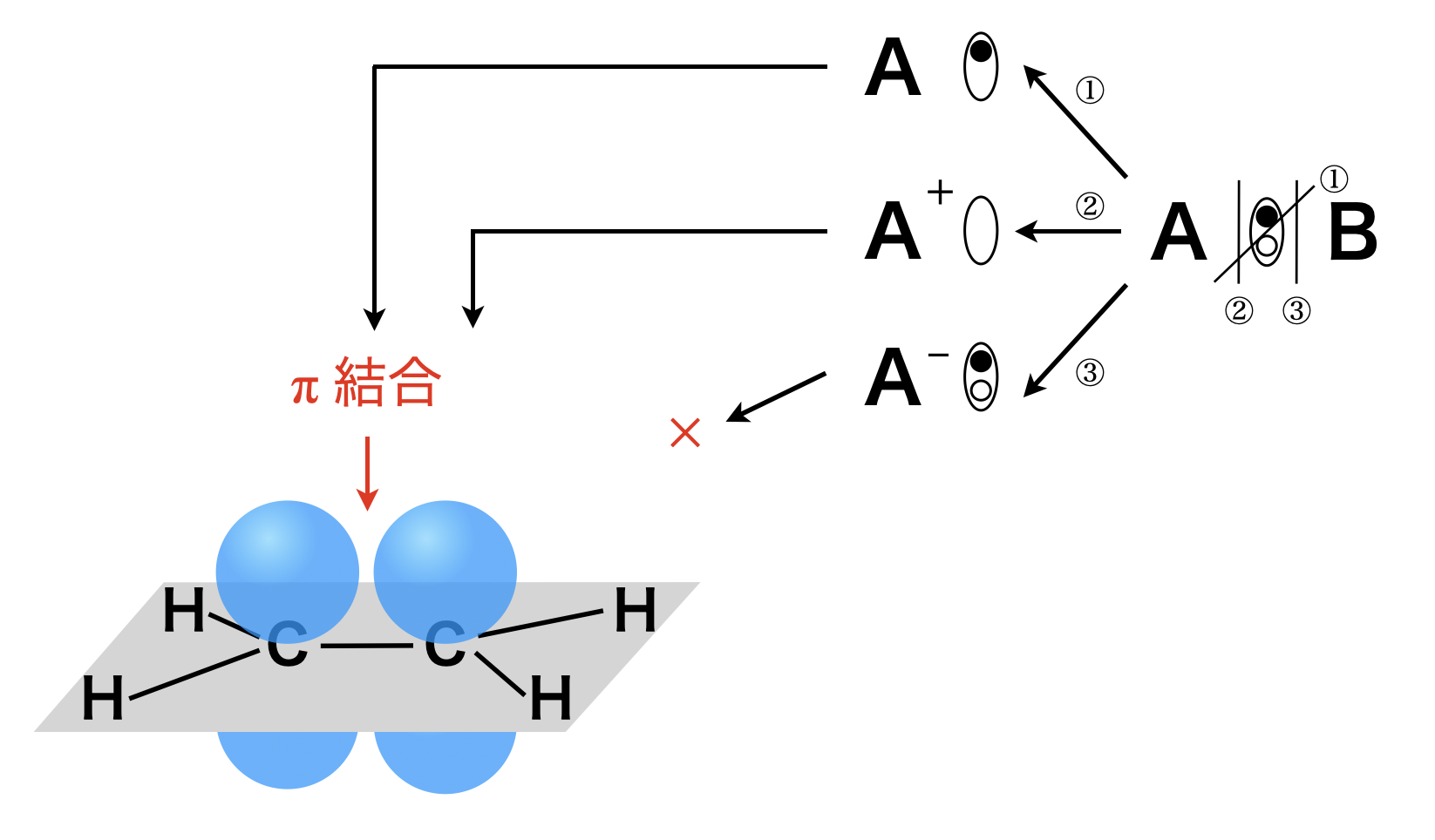
またアルケンは\(σ\)結合より反応性の高い\(π\)結合が存在するため,付加重合についても考える必要があります.
そのため,基本的には求電子付加反応(陽イオン)・ラジカル付加反応(ラジカル)・付加重合を覚える必要があります.そして最後に,酸化開裂反応についても解説していきます.
それでは各反応を詳しくみていきましょう!
求電子付加反応
まずは求電子付加反応です.これはアルケンに陽イオンが攻撃する反応です.
では,詳細に見ていきましょう!
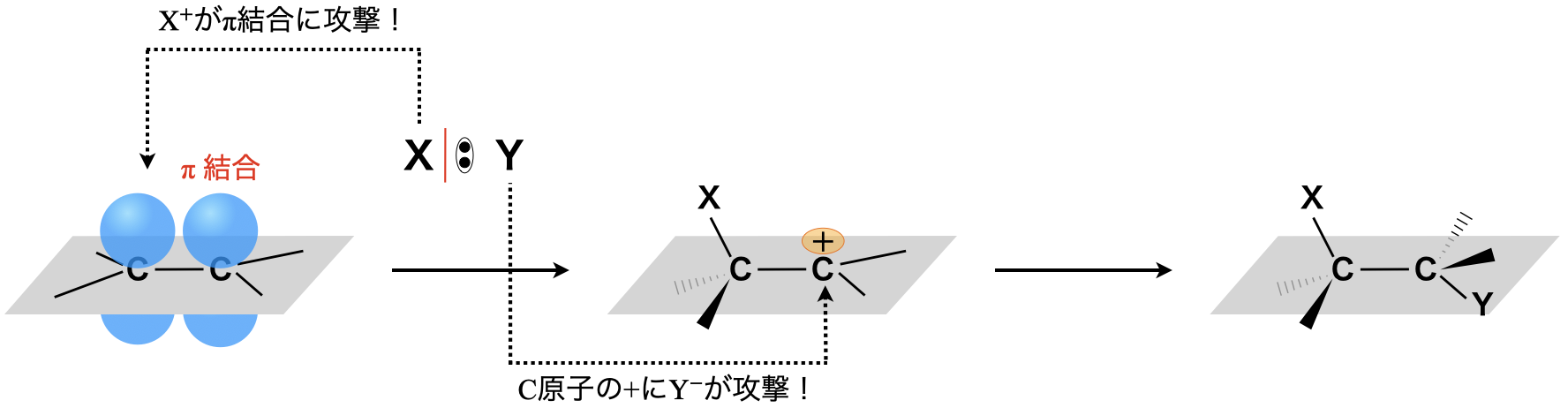
アルケンの\(π\)結合にまず陽イオン\(\rm{X^+}\)が引き寄せられ,攻撃します.生成した陽イオン中間体に陰イオン\(\rm{Y^-}\)が攻撃して,付加が完了します.
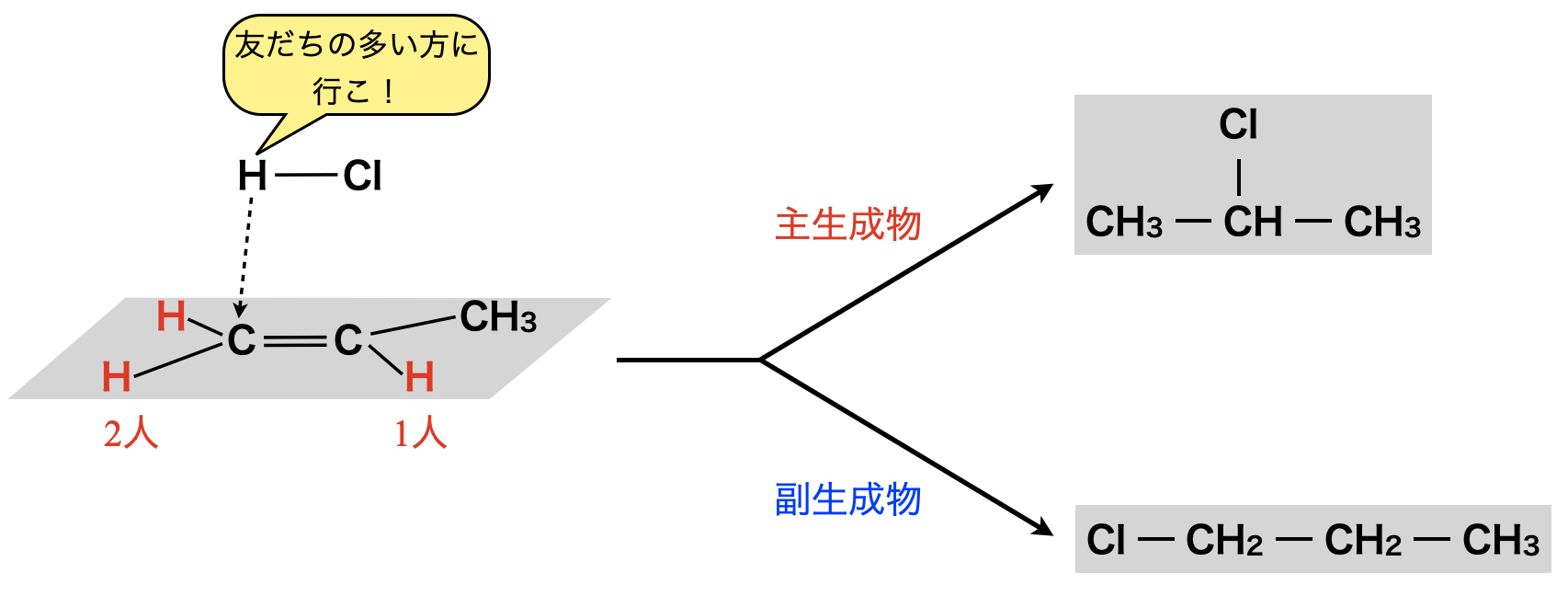
ここで,非対称アルケンへの水素化物(\(\rm{HX}\))の求電子付加反応においては,第\(1\)攻撃をする\(\rm{H^+}\)はより\(\rm{H}\)原子が多く結合した\(\rm{C}\)原子へ優先的に攻撃します.この法則をマルコフニコフ則といいいます.この法則については,あとから説明しますね!
このプロセスで反応する物質\(\rm{XY}\)には,\(\rm{HX}\)(水素化物)や\(\rm{Br_2}\)があてはまります.特に,\(\rm{Br_2}\)水(赤褐色)にアルケンを通すと,\(\rm{Br_2}\)が付加反応して\(\rm{Br_2}\)由来の赤褐色が消えます.これらの反応をまとめると下のようになります.
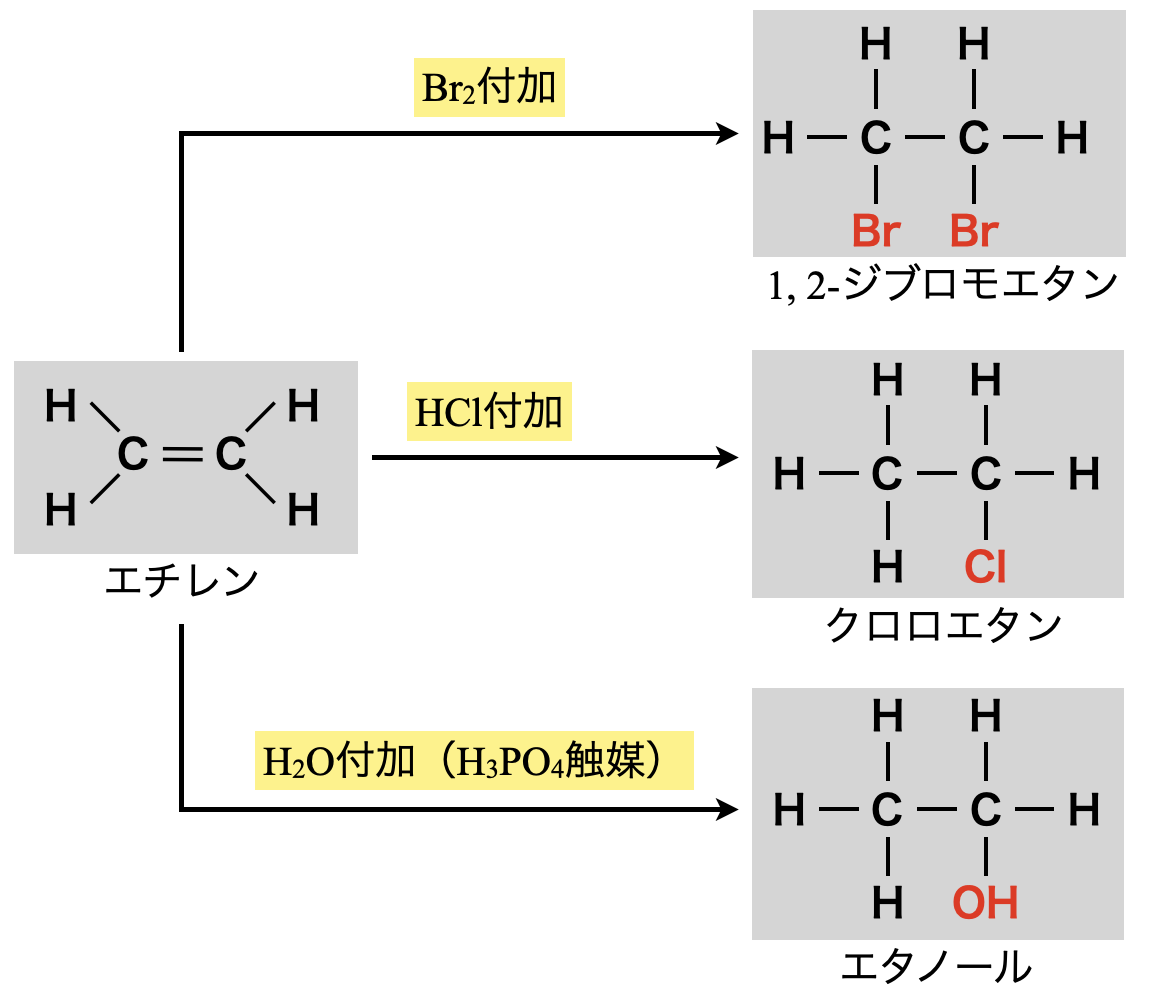
有機化学ではこのように各物質の流れをおさえていくと覚えやすくなりますよ!
マルコフニコフ則は二重結合をもつ炭化水素の付加反応に関する規則です.
非対称アルケンに\(\rm{HX}\)(水素化物)が付加するとき,\(\rm{H}\)原子が多く結合している\(\rm{C}\)原子に\(\rm{HX}\)の\(\rm{H}\)が付加したものが主生成物になるというものです!
「\(\rm{H^+}\)は仲間の多い方に行く!」と覚えましょう!!
しかし,この収率は\(100\%\)ではないため,副生成物もあることに注意です!
ラジカル付加反応
\(\rm{H_2}\)は
\(\rm{H_2\ →\ H^+\ +\ H^-}\)
という反応をしません.
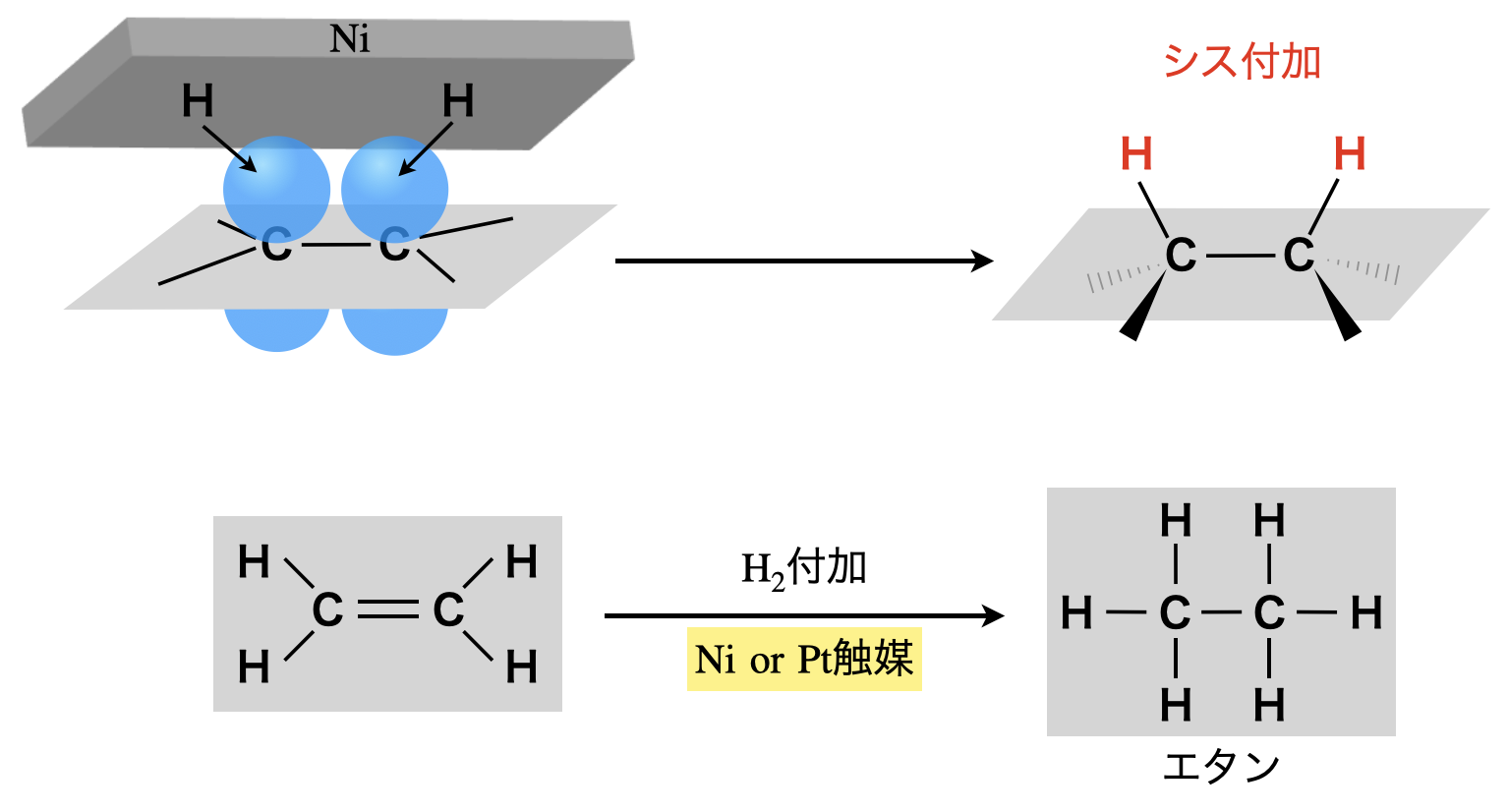
そのため\(\rm{C=C}\)に\(\rm{H_2}\)を付加させるために,ラジカル反応が起こります.しかしながら\(\rm{H_2}\)はそのままではラジカル反応することはありません.
\(\rm{Ni\ or\ Pt}\)触媒を用いると,\(\rm{H_2}\)はまずこれに吸着し,原子状(\(\rm{H}\)ラジカル)に解離した状態になって\(\rm{Ni\ or\ Pt}\)に付着しています.そして\(\rm{H}\)ラジカルは,\(π\)結合に対して同じ方向から付加します.これをシス付加といいます!
付加重合
ビニル化合物に触媒を用いて反応させると,分子間で次々と付加反応が起こり合成高分子が生成します.この反応を付加重合といいます.
[Fig. ]
まずは,ビニル基という名前を覚えましょう!
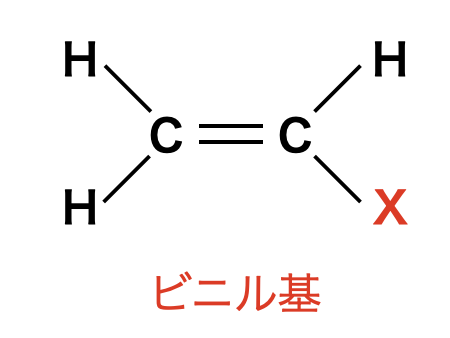
そして,その中で\(\rm{X}\)に当てはまる原子によって名前が変わるため,頻出のものを覚えておきましょう!
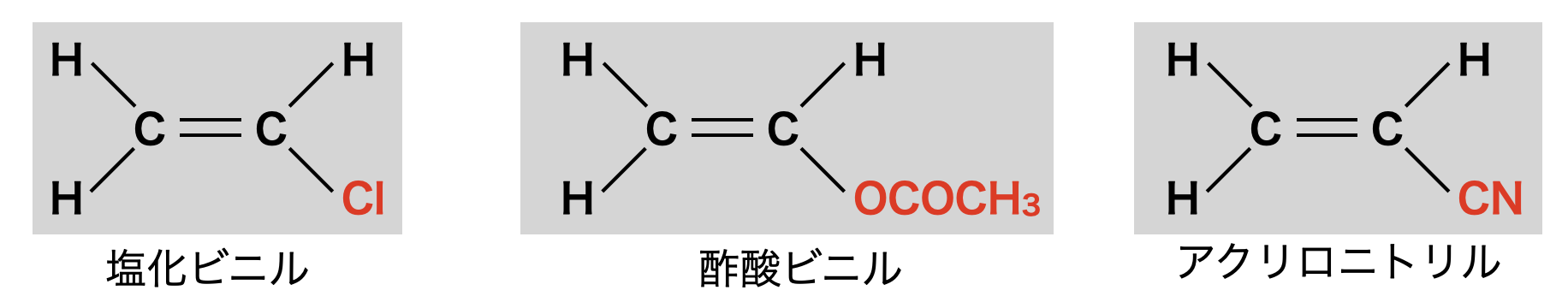
\(\rm{X = Cl}\):塩化ビニル.付加重合とするとポリ塩化ビニルになります.
\(\rm{X = OCOCH_3}\):酢酸ビニル.付加重合とするとポリ酢酸ビニルになります.
\(\rm{X = CN}\):アクリロニトリル.付加重合とするとポリアクリロニトリルになります.
それぞれの名前について少しずつ覚えていってくださいね!
この積み重ねが点数につながっていきますよ!
では,付加重合のノウハウについてみていきましょう!
二重結合の\(π\)結合に少量の開始剤が攻撃することで,付加重合が起こります.この開始剤がラジカル・カチオン・アニオンによって,\(3\)種類あります.
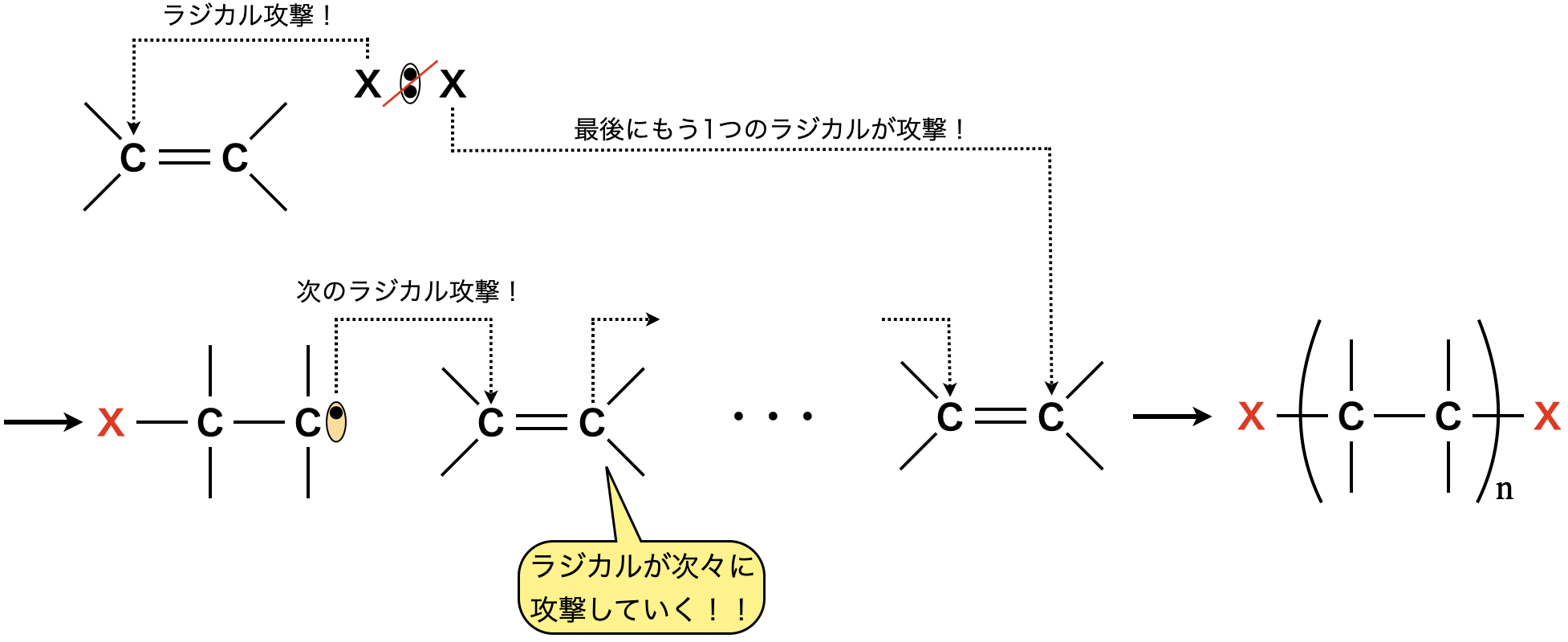
①ラジカル重合
開始剤にラジカルを使うことで,ラジカル重合反応が起こります.
②カチオン重合
開始剤にカチオン(陽イオン)を使うことで,カチオン重合が起こります.

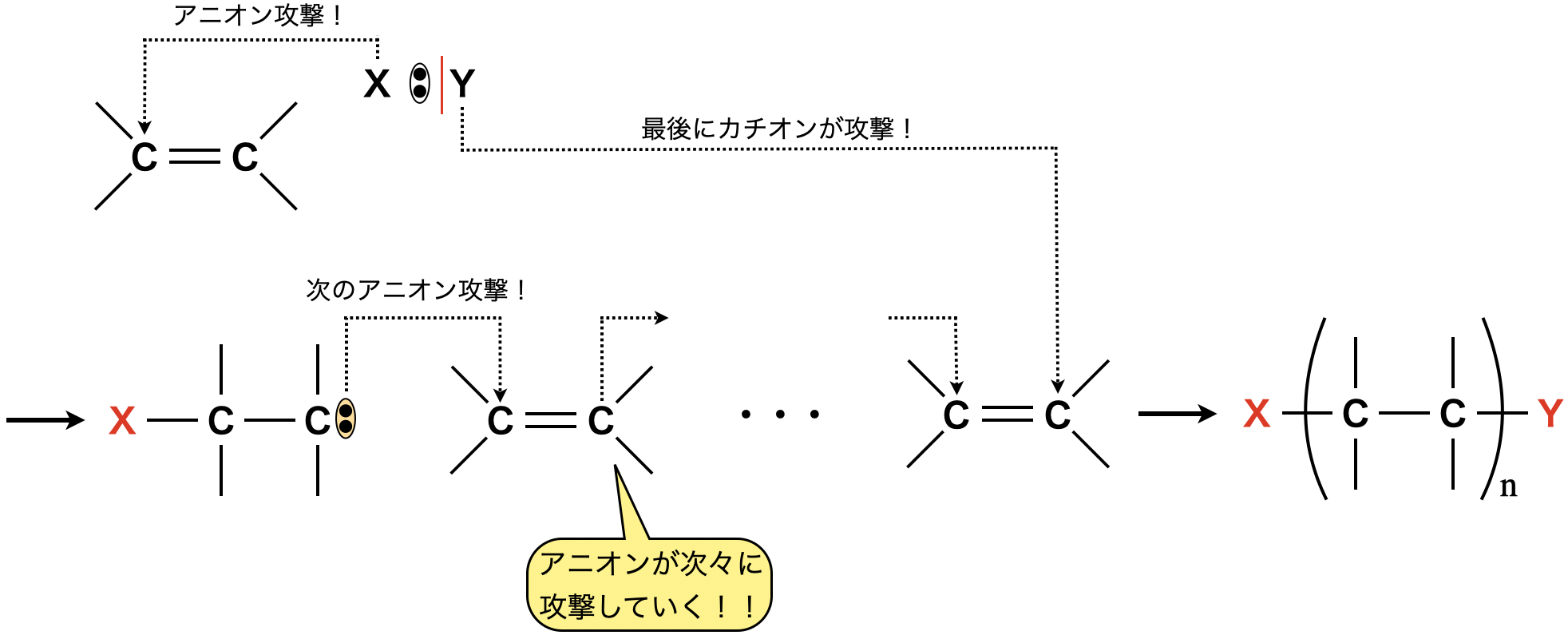
③アニオン重合
開始剤にアニオン(陰イオン)を使うことで,アニオン重合が起こります.
アルケンの酸化開裂反応
アルケンに\(\rm{O_2}\),\(\rm{O_3}\),\(\rm{KMnO_4}\)などを反応させると,以下のようにカルボニル化合物に酸化開裂されます.

このノウハウをみていきましょう!
ただしこの詳細は難しいため,読み流す程度で大丈夫です!
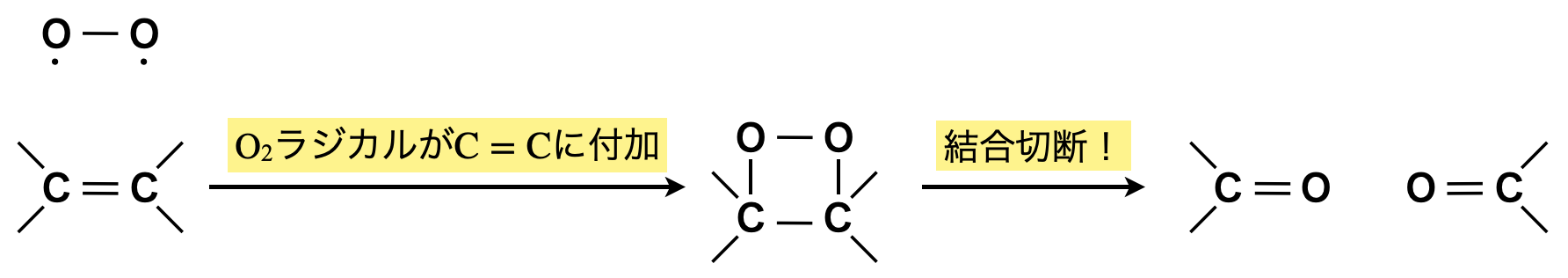
\(\rm{O_2}\),\(\rm{O_3}\),\(\rm{KMnO_4}\)などの\(\rm{O}\)原子はラジカル状態として\(2\)個の不対電子をもった状態になっています.
これらは\(\rm{C=C}\)の\(π\)結合にブリッジ状に付加し,環状分子を作ります.
ところが,\(\rm{O-O}\)結合は不安定であるためすぐに切れ,最終的には\(\rm{C-C}\)結合の切断まで進行します.
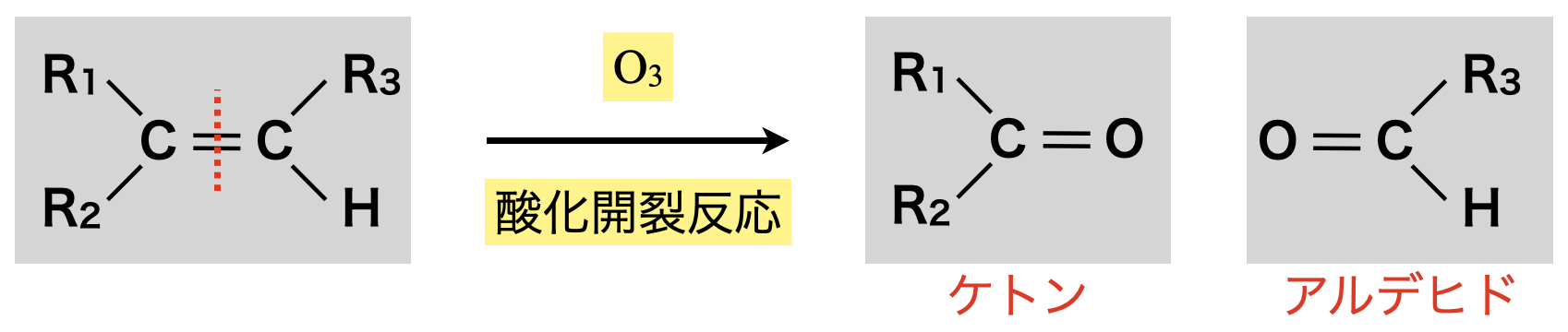
\(\rm{O_3}\)による酸化開裂反応
\(\rm{O_3}\)による酸化開裂反応後には,ケトン \(\rm{or}\) アルデヒドが生成します.
\(\rm{KMnO_4}\)による酸化開裂反応
\(\rm{KMnO_4}\)による酸化開裂反応の場合は,酸・塩基条件によって生成される物質が変わってきます.
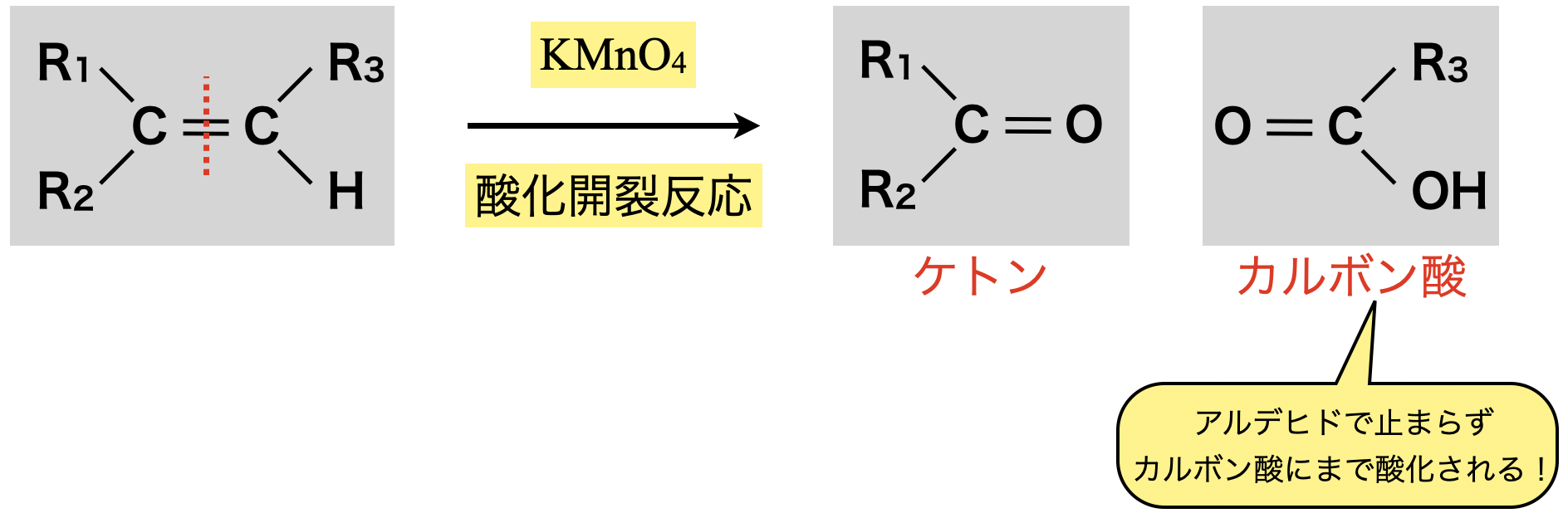
①酸性条件
酸性条件にするとより激しく酸化し,先程\(\rm{O_3}\)の酸化開裂で生成されたアルデヒドがさらに酸化され,カルボン酸になります.
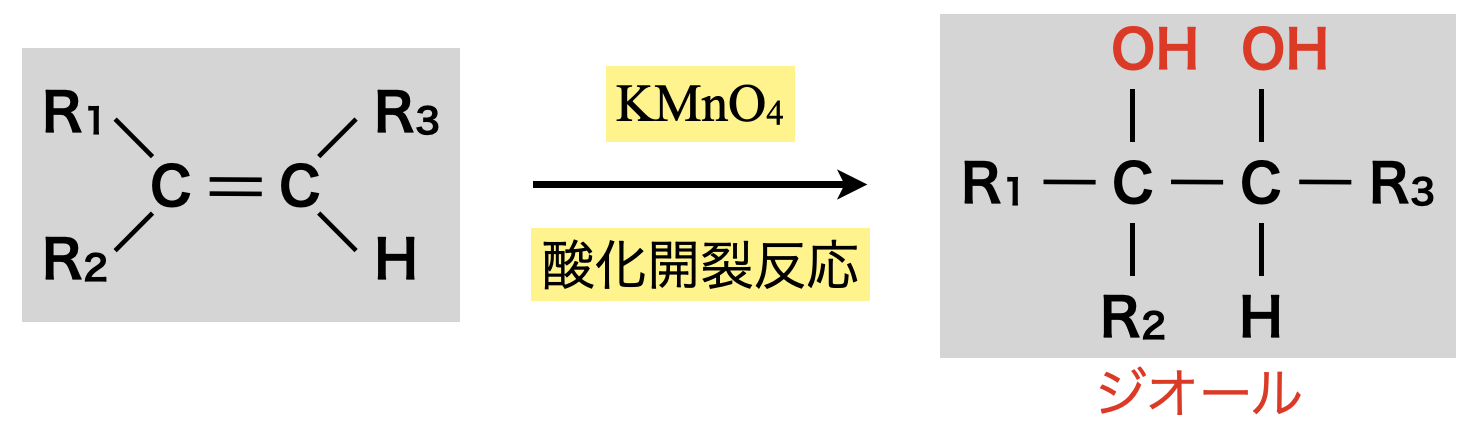
②中性・塩基性条件
このとき穏やかに酸化されるため,アルケンは酸化開裂せず,加水分解によりジオールが生成されます.
このノウハウについて簡単にみておきましょう!
\(\rm{O_3}\)と同様に\(\rm{KMnO_4}\)についても\(\rm{O}\)原子のラジカルが下のように付加反応します.ただし,酸性条件では強い酸化が起こるため二重結合が切断されますが,中性・塩基性条件では加水分解によりジオールが生成されます.





コメント