
今回のポイントは,
- \(\rm{Ca}\)系列の全体像とその性質
- \(\rm{Ca}\)系列の物質の別名
です.これら以外の性質についても詳しく解説していくので,少しでも自分のものにしてくださいね!
\(\rm{Ca}\)系列の全体像
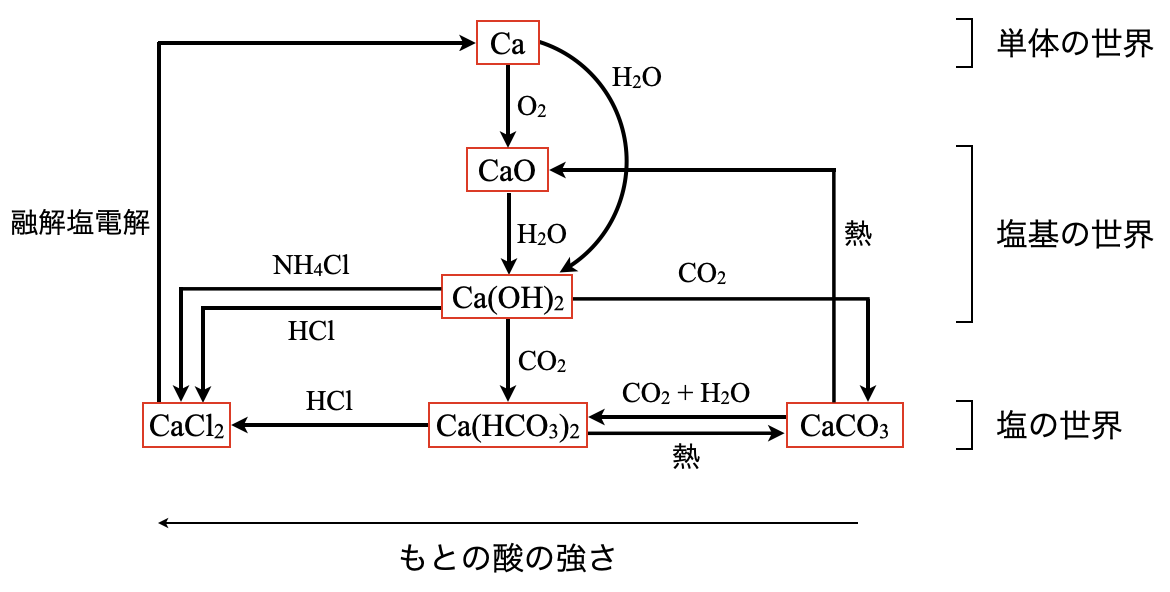
この図の\(1\)段目が単体の世界,\(2\)段目・\(3\)段目が塩基の世界,\(4\)段目が塩の世界となっています.これらの物質は,上より下,右より左の方がエネルギー的に安定しています.そのため,自発的に下や左側に反応が進んでいきます.
\(\rm{Ca}\):カルシウム
\(\rm{Ca}\)元素は\(\rm{Na}\)元素と基本的に同じ反応になります.
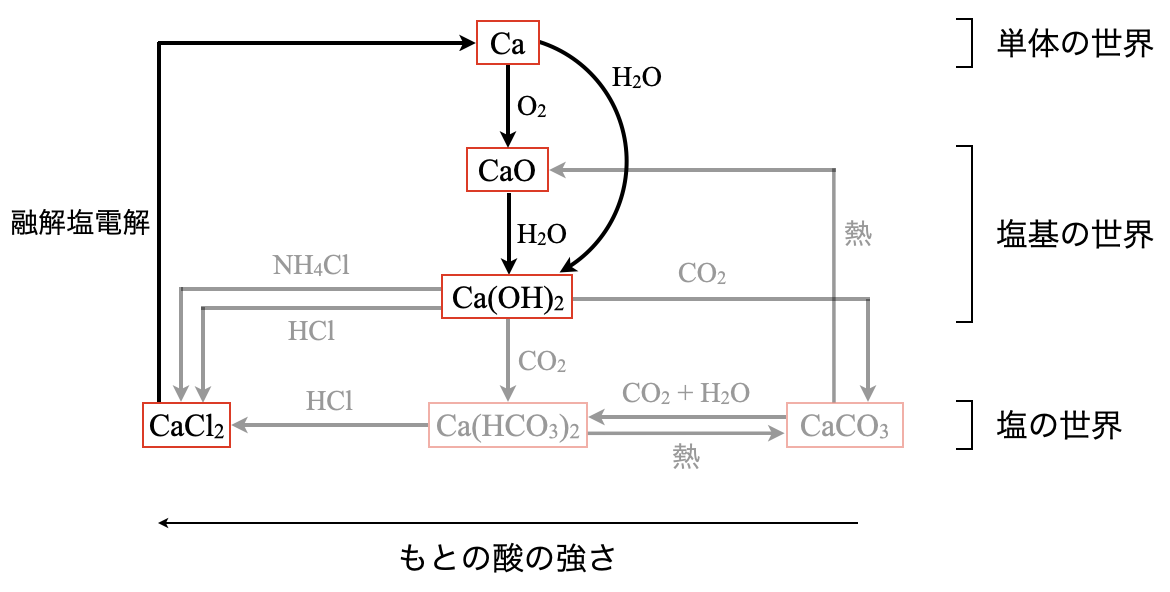
\(\rm{Ca}\)は空気中で酸化されて,以下の反応が起こります.
\(\rm{2Ca\ +\ O_2\ →\ 2CaO}\)
そしてこの\(\rm{CaO}\)(酸化カルシウム)が水と反応することで,
\(\rm{CaO\ +\ H_2O\ →\ Ca(OH)_2}\)
となります.
またアルカリ土類金属は,どの物質も冷水と反応して水素が発生します.図で考えると,\(1\)段目→\(3\)段目に一気にジャンプします.
\(\rm{Ca\ +\ 2H_2O\ →\ Ca(OH)_2\ +\ H_2↑}\)
\(\rm{Ca}\)の単体を得るには,\(\rm{CaCl_2}\)の融解塩電解によって合成できます.これも\(\rm{Na}\)元素と同じですね!あまりテストで出ることはないかもしれませんが,もし出たときのために\(\rm{Na}\)元素と同じ!と覚えておきましょう!
陰極:\(\rm{Ca^{2+}\ +\ }\)\(2e^-\ \rm{→\ Ca}\)
陽極:\(\rm{2Cl^-\ →\ Cl_2\ +\ }\)\(2e^-\)
炎色反応
アルカリ土類金属の炎色反応についても書いておきます!
\(\rm{Mg}\):無,\(\rm{Ca}\):橙,\(\rm{Sr}\):紅,\(\rm{Ba}\):(黄)緑
となります.系統分析で役に立ちますよ!
\(\rm{CaCO_3}\):炭酸カルシウム
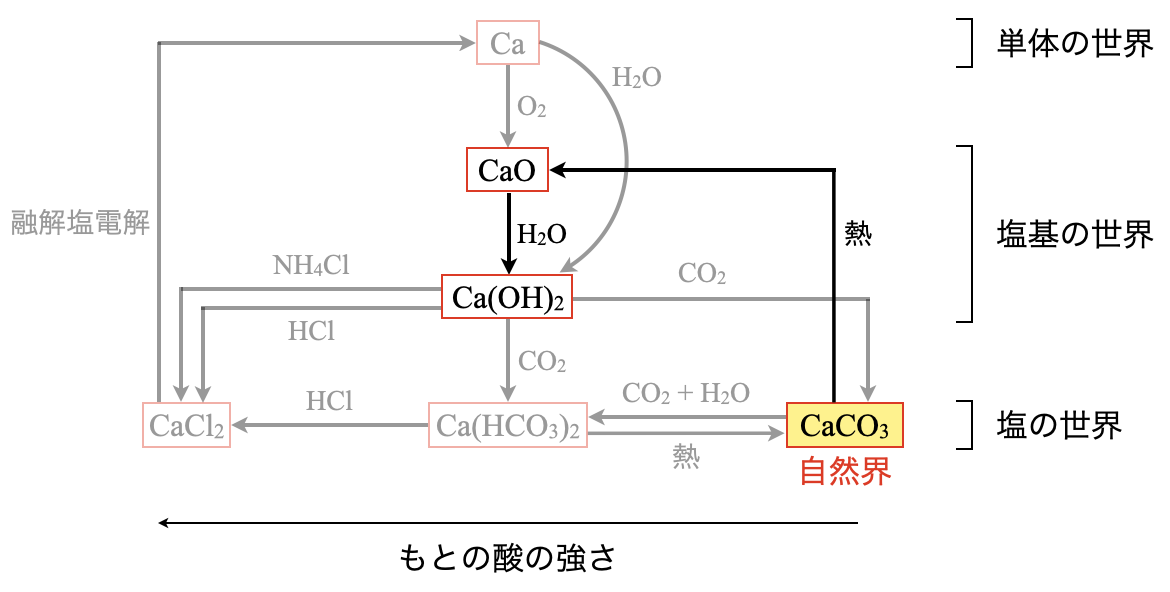
自然界では,\(\rm{Ca}\)元素は主に\(\rm{CaCO_3}\)(石灰岩)として存在しています.\(\rm{Na}\)元素が,\(\rm{NaCl}\)として存在しているので,ここが\(\rm{Na}\)元素と\(\rm{Ca}\)元素の大きな違いですね.
\(\rm{CaCO_3}\)を加熱するだけで,\(\rm{CO_2}\)と\(\rm{CaO}\)に分解することができます.
\(\rm{CaCO_3\ →\ CaO\ +\ CO_2↑}\)
そして先ほど解説した\(\rm{CaO\ →\ Ca(OH)_2}\)というふうに移動していきます.
\(\rm{Ca(OH)_2}\):水酸化カルシウム
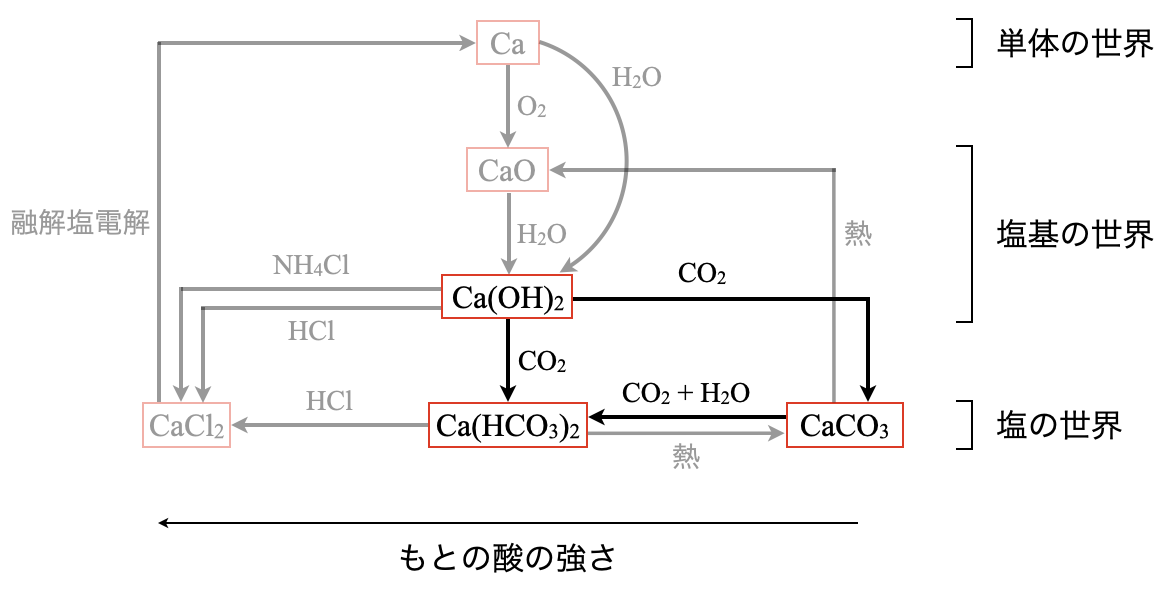
\(\rm{Ca(OH)_2}\)を石灰水と呼びます.この石灰水に\(\rm{CO_2}\)を通じると,炭酸カルシウムの白色沈殿が生じます.これは\(\rm{CO_2}\)の検出反応なので,テストに頻出です!
\(\rm{Ca(OH)_2\ +\ CO_2\ →\ CaCO_3↓\ +\ H_2O}\)
この白色沈殿に,さらに\(\rm{CO_2}\)を通じると沈殿が溶けて透明になります.これは炭酸水素カルシウムが生じたためです.
\(\rm{CaCO_3\ +\ CO_2\ +\ H_2O\ ⇄\ Ca(HCO_3)_2}\)
私が受験生の頃は,\(\rm{CaCO_3→Ca(OH)_2}\)のような反応がなぜ起こらないのか?と疑問に思っていました.
\(\rm{CaCO_3\ +\ H_2O\ →\ Ca(OH)_2\ +\ CO_2}\)
ただ今回のような\(\rm{Ca}\)系列の図に出会ったことで,このような反応経路がないことを理解することができました.この図を覚えることで,みなさんが今まで疑問に思っていたことを解消できればと思います!
この反応式を眺めると,石灰岩の多い地方では\(\rm{CO_2}\)を含んだ雨水によって右向きに反応が進みます.その雨水が地下の洞窟の中で蒸発すると,\(\rm{H_2O}\)がなくなるので左向きに反応が進みます.これによって\(\rm{CaCO_3}\)が析出します.これが長い年月をかけると鍾乳洞になります.
\(\rm{CaSO_4}\):硫酸カルシウム
硫酸カルシウムは,天然には\(\rm{CaSO_4 \cdot 2H_2O}\)(セッコウ)として析出します.これを焼くと,結晶水の一部が取れて,粉状の\(\rm{CaSO_4 \cdot \large \frac{1}{2} \small H_2O}\)(焼きセッコウ)になります.この焼きセッコウに水を加えて放置すると,再び焼きセッコウとなって固化します.焼くと結晶水の一部が取れて,\(\rm{\large \frac{1}{2} \small H_2O}\)になる!と覚えておきましょう.
\(\rm{CaSO_4 \cdot \large \frac{1}{2} \small H_2O\ +\ \large \frac{3}{2} \small H_2O\ →\ CaSO_4 \cdot 2H_2O}\)
\(\rm{Ca}\)系列で頻出の別名
\(\rm{Ca}\)系列には,消石灰や生石灰,セッコウなど様々な別名が出てきます.これらの名前を聞いただけで,組成式がわかるようにしてほしいです.ただ丸暗記はすぐに忘れてしまうので,このサイトのモットーである「流れ」を大切にしていきながら覚えていきましょう.
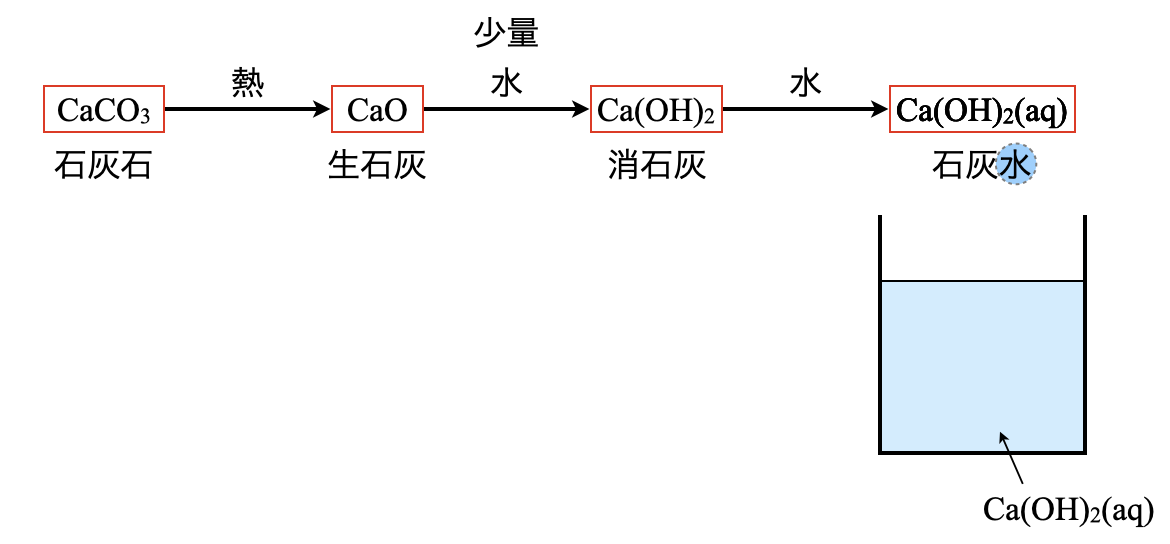
まずは自然界に多く存在する\(\rm{CaCO_3}\)を石灰石と呼びます.そしてこれに熱を加えることで,生石灰(\(\rm{CaO}\))になります.さらに生石灰に少量の水を加えることで,消石灰(\(\rm{Ca(OH)_2}\))となります.ここまではすべて固体です.
そして最後に消石灰に水を十分に加えることで,液体の石灰水(\(\rm{Ca(OH)_2(aq)}\))が得られます.
ここで出てきた消石灰に低温で塩素を吸収させると,さらし粉が作られます.
\(\rm{Ca(OH)_2\ +\ Cl_2\ →\ CaCl(ClO) \cdot H_2O}\)
さらし粉などに関する詳しい解説はこちらの記事で解説しています.どうぞご覧ください!




コメント