
物質の状態について整理したい方や状態図の特徴をまとめたい方はぜひ最後まで読んで下さいね!
それでは,今日も頑張っていきましょう!!
物質の三態
皆さんもご存知のように,物質は原子や分子といった微粒子の集合体であり,固体・液体・気体のいずれかの状態で存在しています.
では,それぞれの状態になるためには,どのような力が働いているのでしょうか?
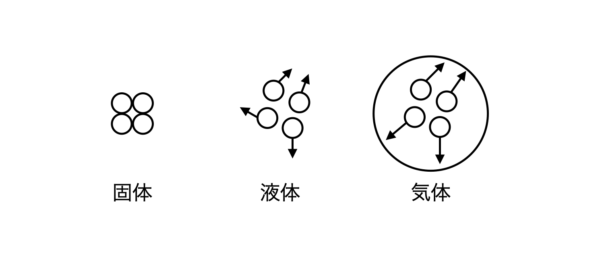
物質を形成するときに重要となるのが,熱運動と凝集力です.
微粒子は熱運動している一方で,微粒子間には凝集力が働いています.
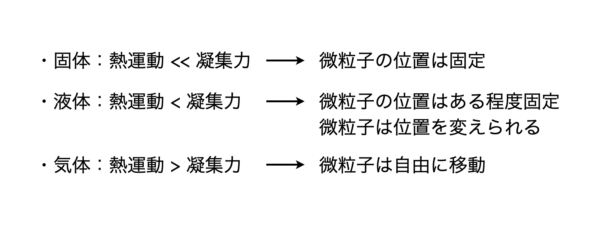
状態の支配因子
先程の節で,物質の状態は熱運動と凝集力の大小関係で決まると言いました.
熱運動は絶対温度\(T\ [\rm{K}]\)に比例し,凝集力は微粒子間の引力\(f\)に比例します.
また絶対温度\(T\)と微粒子間引力\(f\)以外に,物質の状態に影響を与える大きな因子があります.
それが外圧\(P\)です.
粒子の集合体に外から圧力を加えることで粒子間の距離が縮められ,液体や固体に変化しやすくなります.
今まで見てきたように,物質を状態変化させるためには,\(T,\ f,\ P\)を変化させることが重要であることがわかります.
またその中で,\(f\)は物質固有の値であり変化させることはできないため,\(T,P\)に着目する必要があります.
\(T,P\)を変化させたとき,物質は固体・液体・気体のいずれかの状態にあることがわかります.
これをよりわかりやすく図示したものが状態図です.
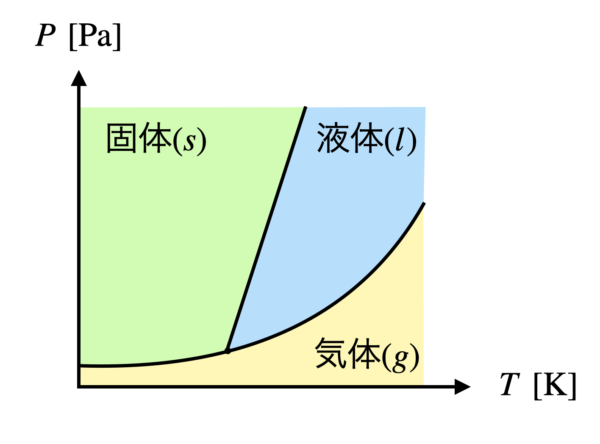
状態図の特徴
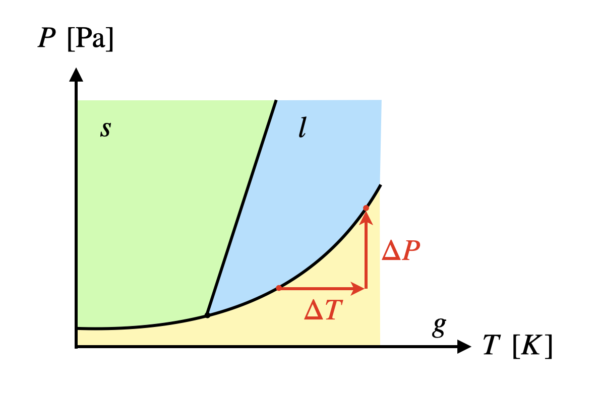
状態図とは,気体・液体・固体の領域の境界線が描かれたものです.
境界線上では\(2\)つの状態が共存しており,平衡状態となっています.
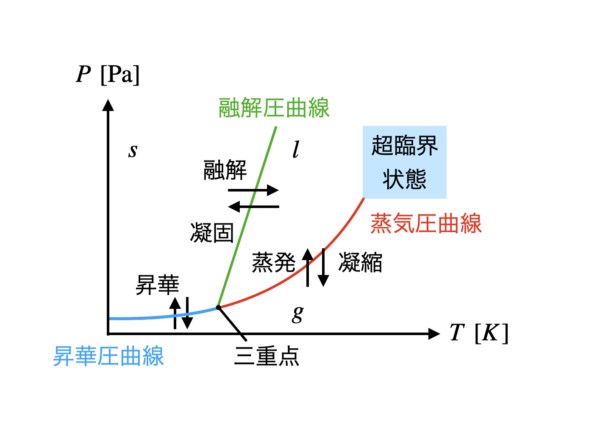
一般に温度を上げると,微粒子の運動は激しくなり,固体→液体→気体へと変化していきます.
このとき,温度を上げると,粒子の集団はよりバラつき具合がより大きくなる方向へと向かい,広がっていきます.
そのため最終的には,平衡状態ではなくなり,一方の状態へと変化します.
これをエンタルピーが増大する方向に移動するといいます.
エンタルピーという言葉は大学で習うため,今は覚えなくて大丈夫ですよ!
また圧力を上げると,粒子の集団はより密接に集まろうとし,気体→液体→固体へと変化していきます.
つまり,温度上昇と圧力増加は逆の効果を果たしていることがわかります.
そのため,平衡状態から温度を\(\Delta T\)上昇させ,圧力\(\Delta P\)を増加させると,再び同じ平衡状態になります.
これは状態図で確認するとよりわかりやすいですよ!
またこの分野では,それぞれの状態変化の名前を覚えることも重要です.
固体→液体は融解,固体←液体は凝固,液体→気体は蒸発,液体←気体は凝縮となります.
しかしこのまま覚えるのは大変なので,しっかりと状態図に書き加えて覚えてくださいね!
上の図を参考にして,自分なりに覚えてくださいね!
超臨界状態についても軽く説明しておきます.
温度,圧力を上げていくと,液体とも気体とも判断できない状態となります.
この状態が超臨界状態です.
また三重点とは,固体・液体・気体の\(3\)つの状態が共存する点のことをいいます.
最後に\(1\)つ注意点があります.
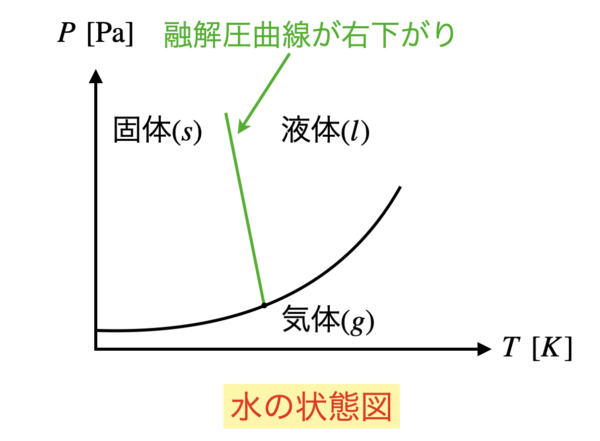
それは水の状態図です.
水だけは融解圧曲線が右下がりになっているので,注意してくださいね!
この分野は物質の変化の名前を覚えるだけで得点することができるので,必ず覚えてくださいね!



コメント