
今回の記事では,その悩みをスッキリと解決していきます.
アンモニアソーダ法を解決するポイントは,
- メインの反応とサブの反応を区別する
- \(\rm{Na}\)系列と\(\rm{Ca}\)系列を合体させる
- 各操作の意味を考える
です.またこれら以外にも自分が受験生時代のときの疑問なども書いているので,ぜひ読んでみてください!それでは今日も頑張っていきましょう.
アンモニアソーダ法の目的
アンモニアソーダ法(ソルベー法)の目的は自然界に多く存在する\(\rm{NaCl}\)と\(\rm{CaCO_3}\)から\(\rm{Na_2CO_3}\)を工業的に製造する!ということです.
ここでのポイントは,工業的に製造する,つまり大量に安価に製造する必要があるということです.\(\rm{NaCl}\)や\(\rm{CaCO_3}\)は自然界に多く存在するので,ほぼコストをかけずに手に入れることができます.そのため,この合成法を確立できれば,安価に\(\rm{Na_2CO_3}\)を作れるというわけです.\(\rm{Na_2CO_3}\)はガラス製造の原料として重要な物質です.
アンモニアソーダ法の解説をするにあたって,\(\rm{Na}\)と\(\rm{Ca}\)についての基礎知識が重要となります.忘れている方や自信がない方は,以下の記事で復習をしてから読み進めることをオススメします!


それでは準備が整ったところで,早速解説していきましょう.
アンモニアソーダ法の全体像
まずは全体像をとらえていきましょう.

この中で\(\rm{Na}\)元素に着目すると,\(\rm{NaCl → NaHCO_3 → Na_2CO_3}\)へ移動していけば,\(\rm{Na_2CO_3}\)が得られることがわかります. そして\(\rm{Ca}\)元素については,\(\rm{Na}\)元素の反応を補助する役割として使っています.
まず,\(\rm{Na}\)元素がメイン,\(\rm{Ca}\)元素がサブということを頭に入れてくださいね!
そして\(\rm{N}\)元素と\(\rm{C}\)元素が\(\rm{Na}\)元素と\(\rm{Ca}\)元素のつなぎの役割をしてくれていることがわかります.以下では,主反応である「\(\rm{NaCl → NaHCO_3 → Na_2CO_3}\)」という\(2\)つの反応を中心に見ていきましょう.
\(\rm{NaCl → NaHCO_3}\)
まずは,\(\rm{NaCl → NaHCO_3}\)に関する反応です.
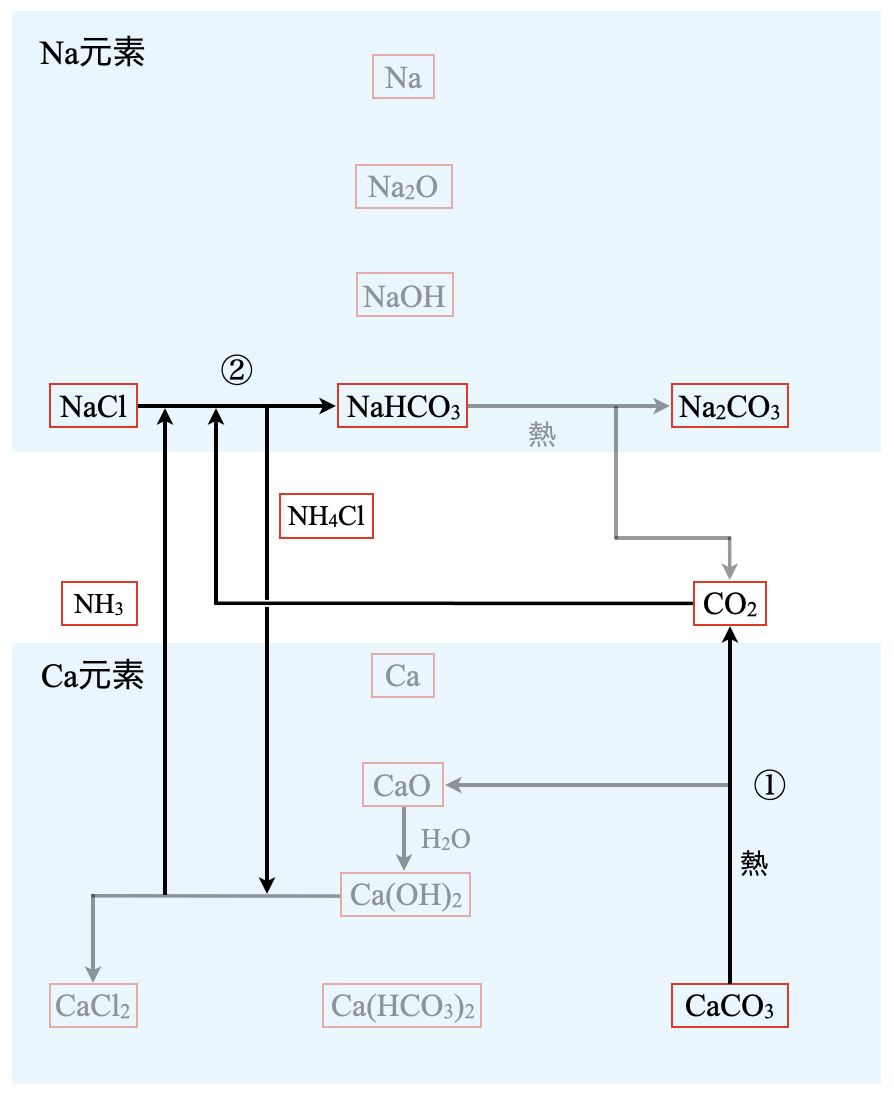
\(\rm{NaCl → NaHCO_3}\)へ移動するには,\(\rm{CaCO_3}\)を加熱して\(\rm{CO_2}\)を発生させ,これを\(\rm{NaCl}\)に吸収させることを考えます.
①:\(\rm{CaCO_3\ →\ CaO\ +\ CO_2}\)
次に,この\(\rm{CO_2}\)を\(\rm{NaCl}\)に吸収させる必要があるのですが,単に\(\rm{NaCl}\)に\(\rm{CO_2}\)を吸収させただけでは,溶解量があまり多くありません.そこで,\(\rm{NaCl}\)に\(\rm{CO_2}\)を加える際に,\(\rm{NH_3}\)を使って中和するという画期的な方法を考えました.この方法が画期的だったため,この方法の名前にも「アンモニア」という名前が入っているわけです.
\(\rm{NH_3\ +\ H_2O\ +\ CO_2\ →\ NH_4HCO_3}\)
この\(\rm{NH_4HCO_3}\)を使って\(\rm{NaCl}\)と反応を起こし,\(\rm{NaHCO_3}\)を沈殿させることができたわけです.
②:\(\rm{NaCl\ +\ NH_3\ +\ H_2O\ +\ CO_2\ →\ NaHCO_3↓\ +\ NH_4Cl}\)
\(\rm{NaHCO_3 → Na_2CO_3}\)
次に,\(\rm{NaHCO_3 → Na_2CO_3}\)の反応をみていきましょう.
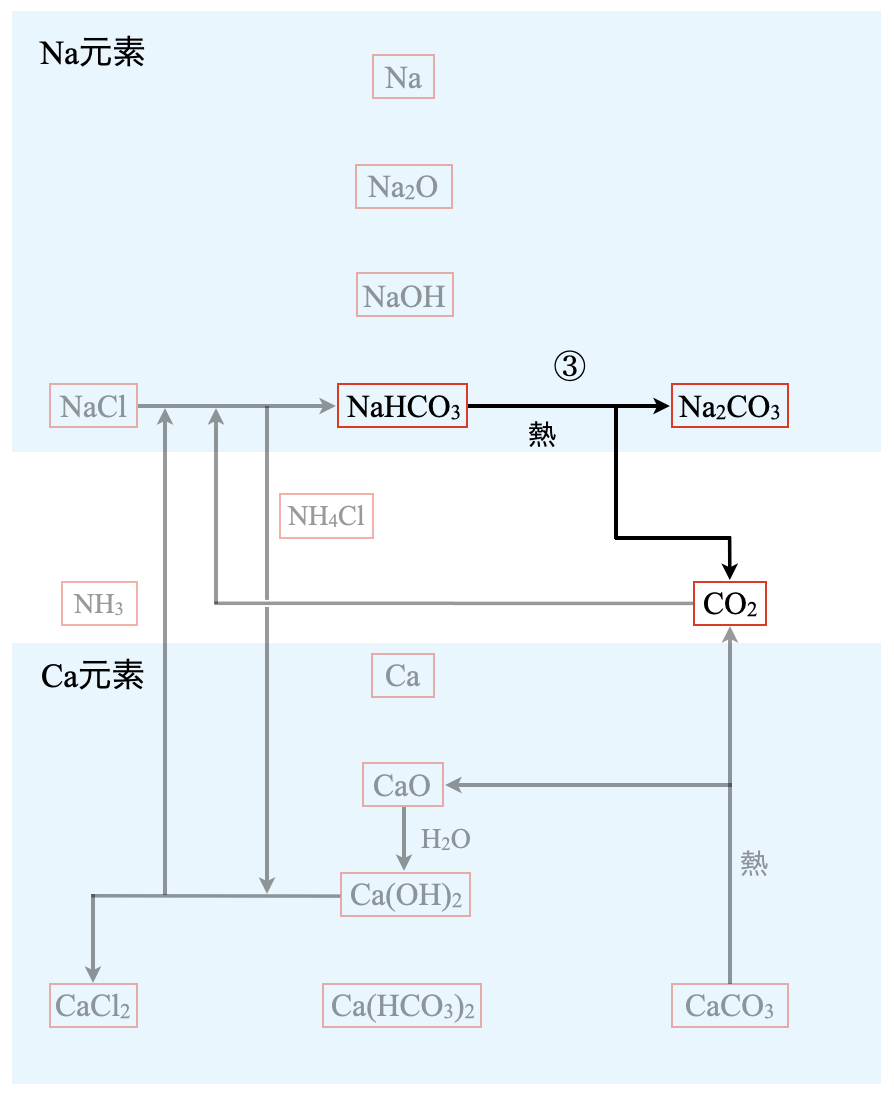
ここまでくれば,\(\rm{NaHCO_3 → Na_2CO_3}\)へと移動させることで目的の炭酸ナトリウムを得ることができます.これは\(\rm{Na}\)元素のところでも取り上げたのですが,\(\rm{NaHCO_3}\)を少し加熱するだけで,\(\rm{Na_2CO_3}\)にたどりつくことができます.
③:\(\rm{2NaHCO_3\ →\ Na_2CO_3\ +\ H_2O\ +\ CO_2}\)
\(\rm{NH_3}\)はどうやって手に入れるの?
今までの説明で目的物質である\(\rm{Na_2CO_3}\)を手に入れることができました.今回のアンモニアソーダ法のポイントを思い出してほしいのですが,それはアンモニアを使用することでした.
では,このアンモニアはどうやって入手すれば良いでしょうか?
先ほどの図をもう一度見てみましょう.
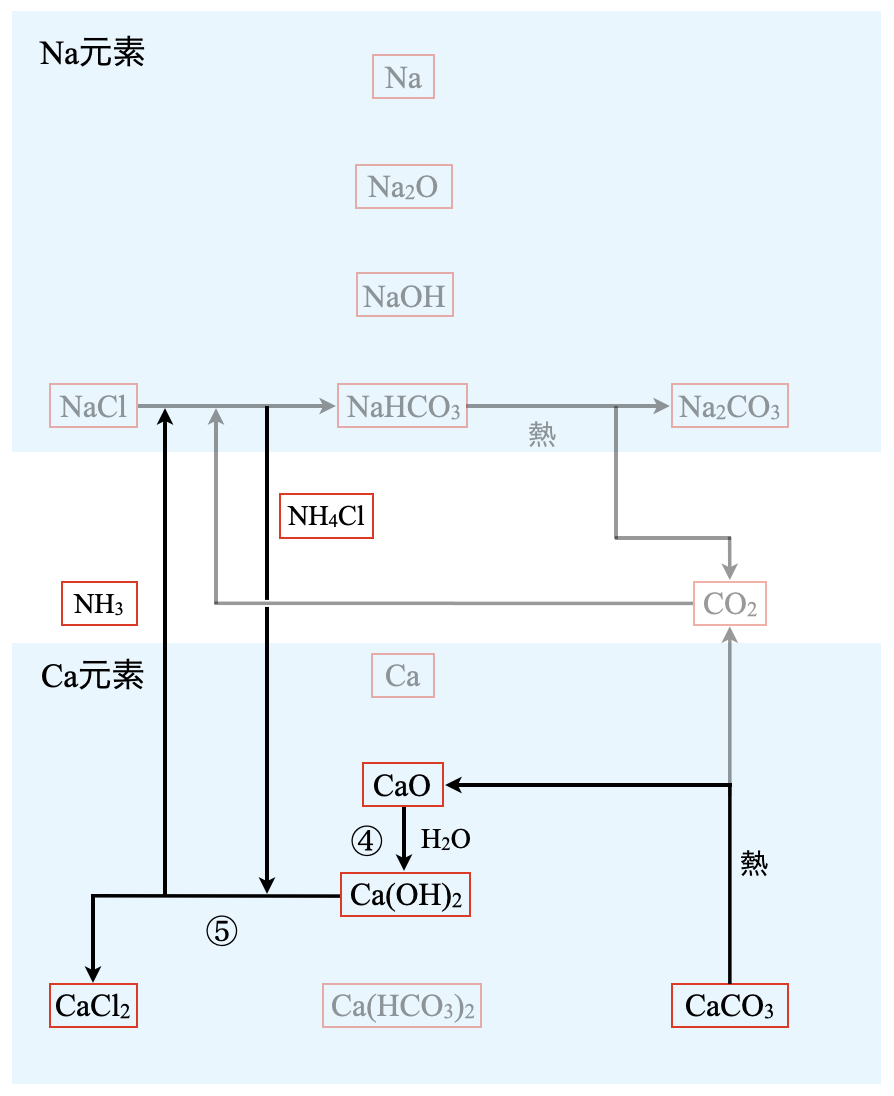
すると,アンモニアの\(\rm{N}\)元素は,この反応系の中で循環していることがわかります.\(\rm{CaCO_3}\)を加熱して生じた\(\rm{CaO}\)を水と反応させることで,\(\rm{Ca(OH)_2}\)が得られます.これに\(\rm{NH_4Cl}\)を加えると,再び\(\rm{NH_3}\)に戻すことができます.
④:\(\rm{CaO\ +\ H_2O\ →\ Ca(OH)_2}\)
⑤:\(\rm{Ca(OH)_2\ +\ 2NH_4Cl\ →\ CaCl_2\ +\ 2NH_3\ +\ 2H_2O}\)
反応全体
①から⑤を整理することで,全体の反応式を導いていきましょう.
整理するときのポイントは,各元素の流れを意識することです.
\(\rm{Na}\)元素の流れ
②,③から中間生成物である\(\rm{NaHCO_3}\)を消去します.
\(\rm{2NaCl\ +\ 2NH_3\ +\ H_2O\ +\ CO_2\ →\ Na_2CO_3\ +\ 2NH_4Cl}\)
\(\rm{Ca}\)元素の流れ
①,④,⑤から中間生成物である\(\rm{CaO}\),\(\rm{Ca(OH)_2}\)を消去します.
\(\rm{CaCO_3\ +\ 2NH_4Cl\ →\ CaCl_2\ +\ 2NH_3\ +\ H_2O\ +\ CO_2}\)
最後にこの\(2\)式を足し合わせることで,
\(\rm{2NaCl\ +\ CaCO_3\ →\ Na_2CO_3\ +\ CaCl_2}\)
と全体の反応式を求めることができます.各反応式をしっかりとおさえることができていば,簡単に求めることができますね!
全体の反応式を見ると,最初からこの反応式で\(\rm{Na_2CO_3}\)が得られるんじゃないか?と思うかもしれません.
\(\rm{2NaCl\ +\ CaCO_3\ →\ Na_2CO_3\ +\ CaCl_2}\)
ただ,ここで注意点があります.それは\(\rm{CaCO_3}\)は沈殿しやすいです.そのため,この反応は右側にはあまり進まず,逆反応が起こりやすくなります.ほしい物質が素直に手に入らないため,このアンモニアソーダ法で\(\rm{Na_2CO_3}\)を合成しているわけです.
全体のおさらいをしておこう
今回の反応系をおさらいしておきましょう.
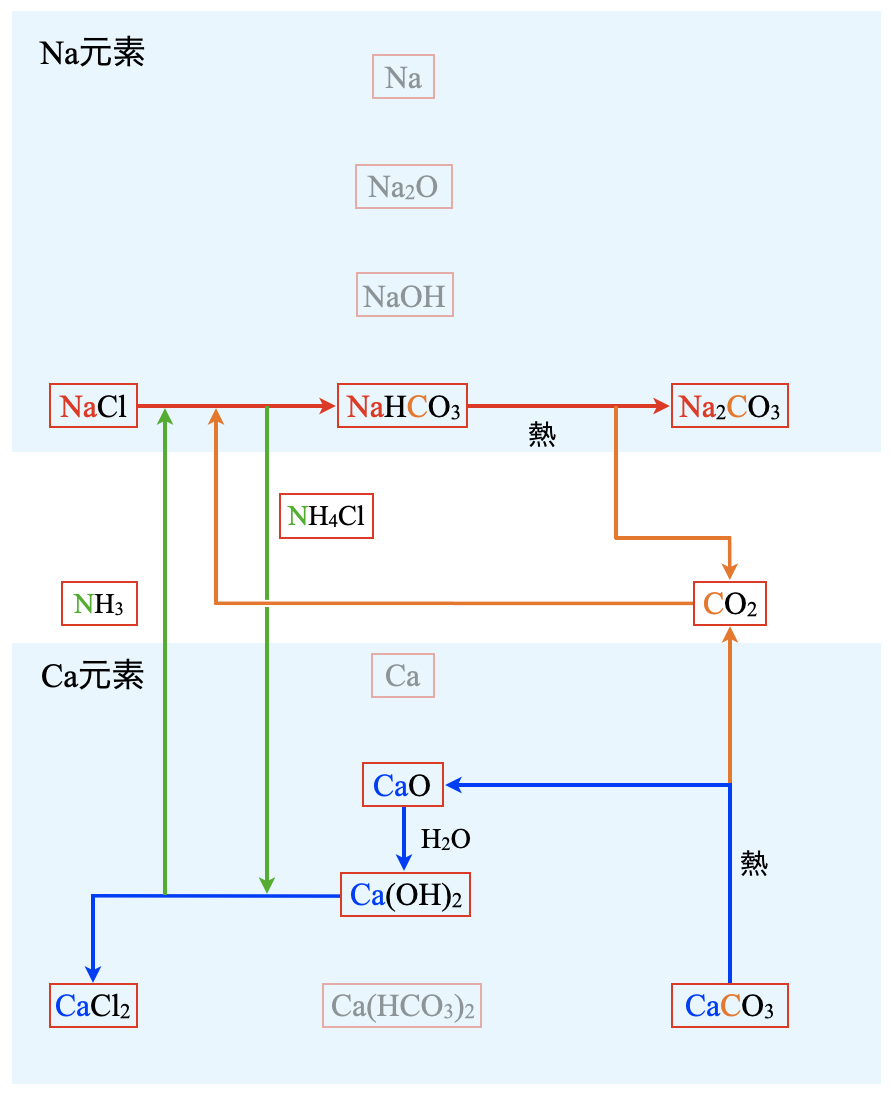
各元素の流れは以下のようになります.
\(\rm{Na}\)元素の流れ
\(\rm{Na}\)元素の流れを見ると,
\(\rm{NaCl → NaHCO_3 → Na_2CO_3}\)
と塩の世界だけで移動していることがわかります.
\(\rm{Ca}\)元素の流れ
\(\rm{Ca}\)元素の流れを見ると,
\(\rm{CaCO_3 → CaO → Ca(OH)_2 →CaCl_2}\)
と移動しています.塩の世界から一度塩基の世界にいき,塩の世界に戻ってきていることがわかります.
\(\rm{N}\)元素の流れ
\(\rm{N}\)元素の流れを見ると,
\(\rm{NH_3 ⇄ NH_4Cl}\)
塩基の世界と塩の世界を循環していることがわかります.
\(\rm{C}\)元素の流れ
\(\rm{C}\)元素の流れを見ると,
\(\rm{CaCO_3 → CO_2 → NaHCO_3 → CO_2 or Na_2CO_3}\)
\(\rm{C}\)元素の場合には,一部が\(\rm{CO_2}\)として循環していることがわかります.
各元素の流れを意識しながら覚えることで,全体を俯瞰的に見る力を養うことができますよ!
練習問題
塩化ナトリウム水溶液(\(26.5\%\))\(\rm{1.0\ t}\)から,アンモニアソーダ法により何\(\rm{t}\)の炭酸ナトリウムが得られるか?
式量は,\(\rm{NaCl = 58.5}\),\(\rm{Na_2CO_3 = 106}\)とする.
このような計算問題を解くときの私のフォーマットをご紹介しましょう!これさえ自分で作ることができれば,あとは機械的に答えを求めることができます.
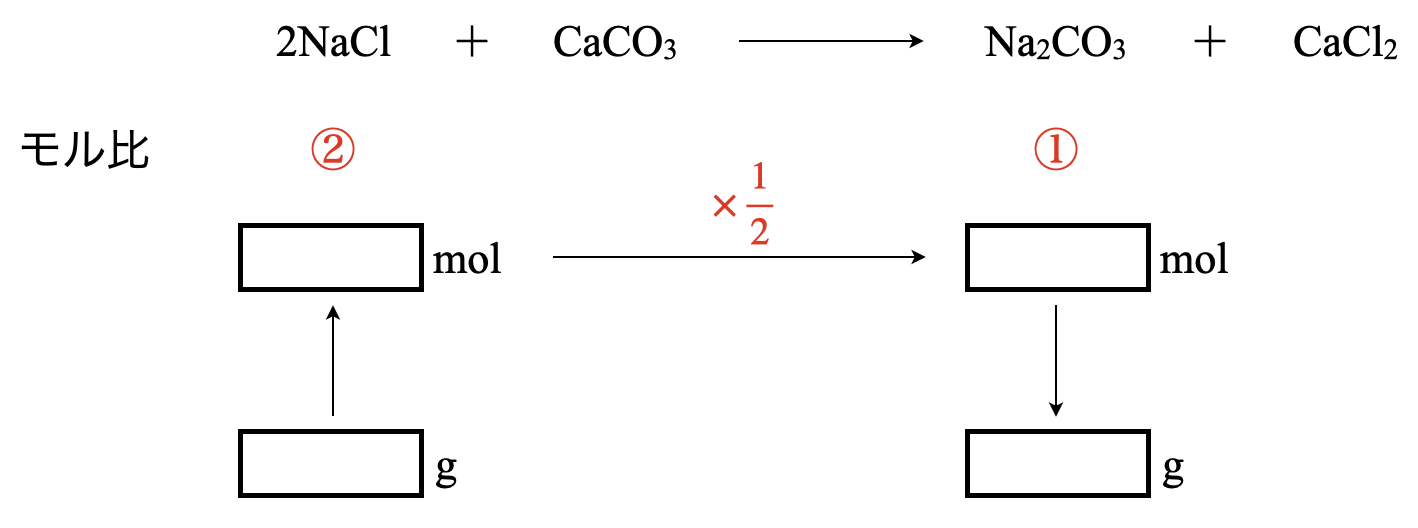
問題の流れを図にすると,上のようになります.それぞれの四角を埋めていけば,答えにたどりつけるというわけです.
まず,\(\rm{NaCl}\)水溶液の濃度は\(26.5\%\)なので,\(\rm{1.0\ t}\)に含まれる\(\rm{NaCl}\)が次のようにわかります.
\(\rm{1.0 × \large \frac{26.5}{100}\ \small t = 2.65 × 10^5\ g}\)
そして\(\rm{g→mol}\)にするには,式量で割ります.\(\rm{mol}\)にしたい\(\rm{=}\)分子量(式量)で割ると覚えておきましょう.
反応式から\(\rm{NaCl:Na_2CO_3 = 2:1}\)なので,\(\rm{NaCl}\)の物質量(モル)を\(\large \frac{1}{2}\)倍すればい良いことがわかります.
最後に\(\rm{mol→g}\)にするので,式量をかけていきます.すると,全部の四角がうまり,下のようになります.
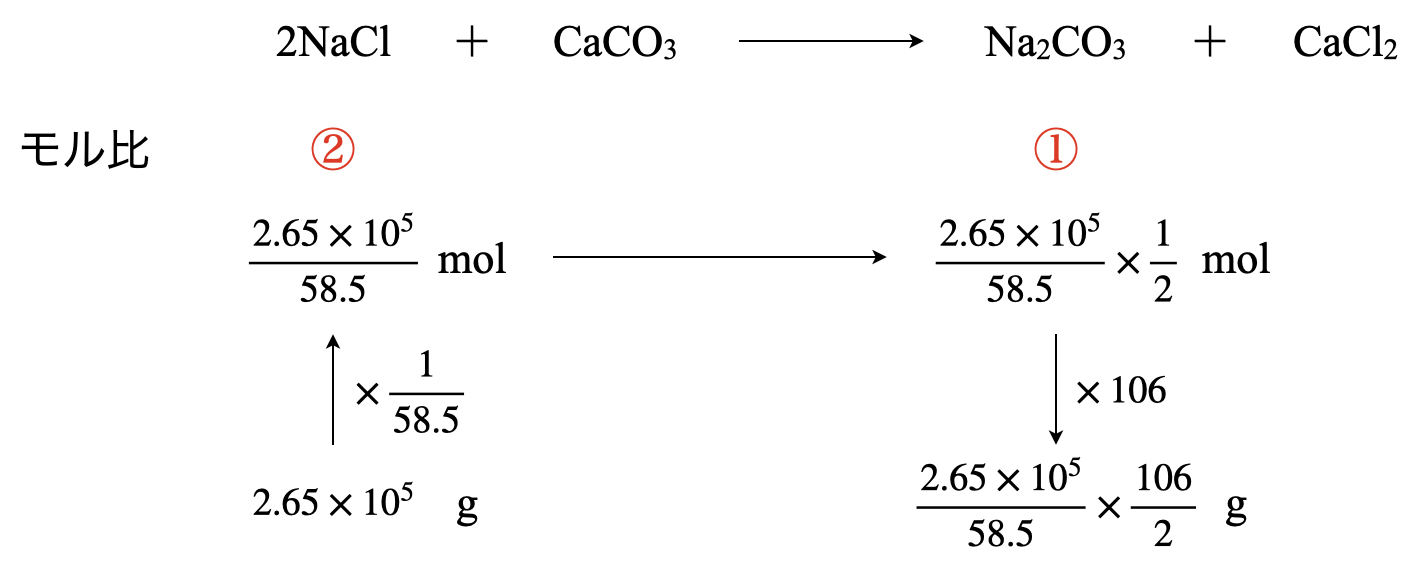
最後の式を計算すれば答えが求まります.
ここでのポイントを下にまとめておきます.
今回のような問題では計算が少しだけ煩雑なので,途中で計算していくと時間がかかってしまいます….式をどんどん書いていって,最後に一気に計算すると計算時間を短縮することができます!
\(\rm{Na_2CO_3}\)の質量:\(\rm{\large \frac{2.65\ ×\ 10^5}{58.5} \small × \large \frac{106}{2} \small = 0.24 × 10^6\ g = 0.24\ t}\)




コメント
それぞれの元素に着目してアンモニアソーダ法(ソルベイ法)を説明しているのが素晴らしいと思いました。しかし細かいことで申し訳ないのですが、練習問題の答えについて、解説に乗っている計算式を電卓に打ち込むと、
2.65*10^5/58.5*106/2=0.251477171…となり有効数字2桁で四捨五入すると0.25tとなるのですが、これは何が違うのでしょうか。
良ければ解説お願いします。
ご質問いただき、ありがとうございます。
2.65*10^5/58.5*106/2=0.2400…となるのですが、電卓の入れ間違いなどございませんでしょうか?
(2.65×100000÷58.5×106÷2)をしてもらうと、上の結果になると思います。
ならなければ、またコメントいただければと思います。