
今日も一緒に頑張っていきましょう!
前回のアルコールの記事はこちらになります!

カルボニル基の反応
\(\rm{C}\)と\(\rm{O}\)が二重結合している官能基をカルボニル基といいます.この中で,\(\rm{A}\)あるいは\(\rm{B}\)が\(\rm{H}\)原子に置換されたものをアルデヒド基といいます.

カルボニル化合物の構造の中で,最も反応生が高いのは\(\rm{C=O}\)結合中の\(\pi\)結合です.ただ,\(\rm{C=O}\)の\(\pi\)結合では電気陰性度の差によって\(\rm{C=O}\)の\(\pi\)結合中の電子が\(\rm{O}\)原子に引き付けられ,\(\rm{O}\)原子が\(\delta^-\),\(\rm{C}\)原子が\(\delta^+\)を帯びています.
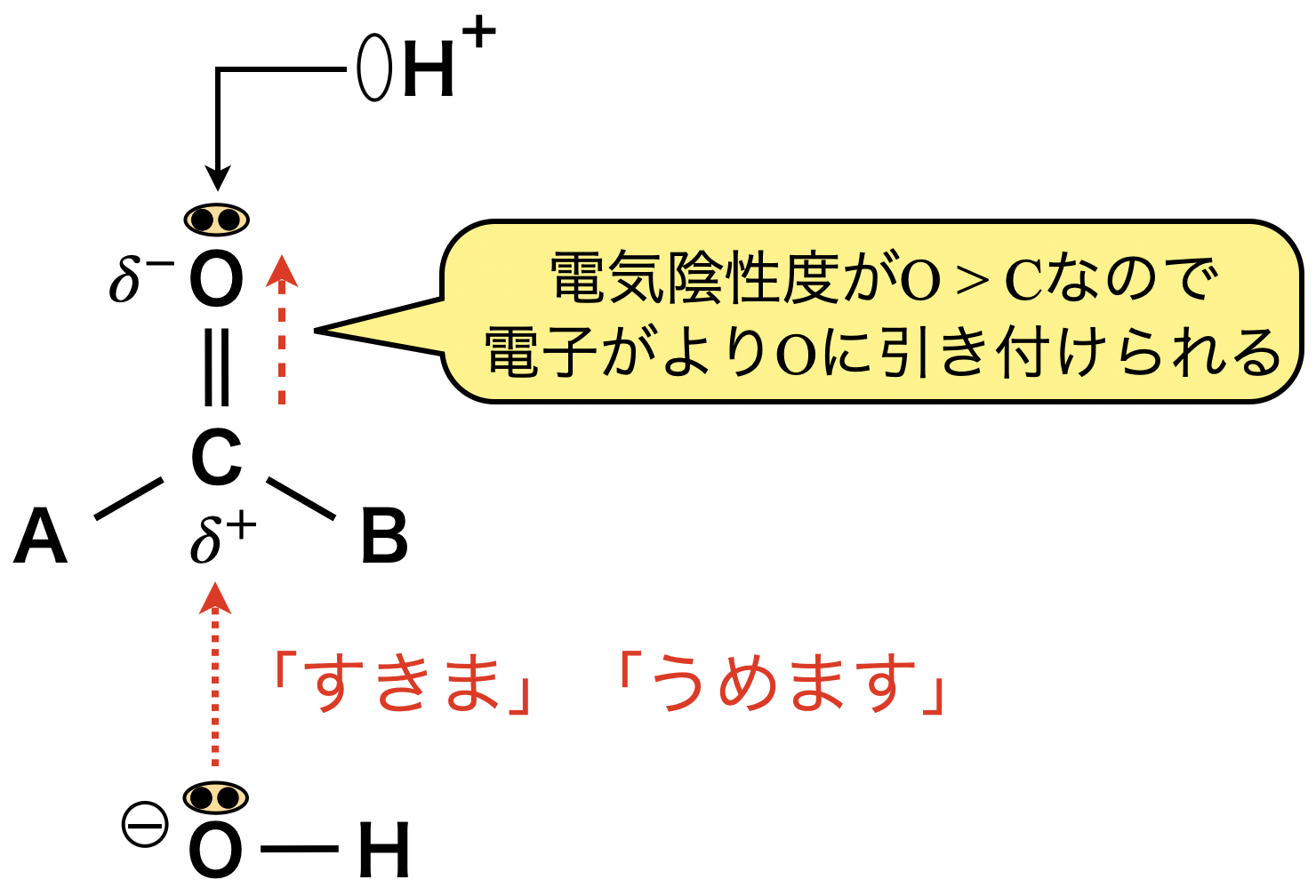
その結果,カルボニル基は以下の\(2\)つの重要な性質をもちます.
\(2\). \(\delta^+\)をもつカルボニル炭素に\(\rm{O-H}\)の非共有電子対が攻撃!「すきま」「うめます」反応が進行!
カルボニル基の隣にある\(\rm{H}\)原子はカルボニル炭素が\(\delta^+\)となるため,電離されやすくなります.アルコールの電離と比較すると,下のようになります.

カルボン酸
カルボキシ基をもつ化合物をカルボン酸といいます.ここで,有機化学に出てくる酸の強さを覚えておきましょう!私は「スカタンフェノール」として覚えました!

炭酸水素ナトリウム水溶液を加えて\(\rm{CO_2}\)が出てくる有機物は、\(\rm{C \cdot H \cdot O}\)が構成元素の場合、カルボン酸と考えて大丈夫です!
\(\rm{RCOOH\ +\ NaHCO_3\ →\ RCOONa\ +\ H_2O\ +\ CO_2}\)
カルボン酸の分類
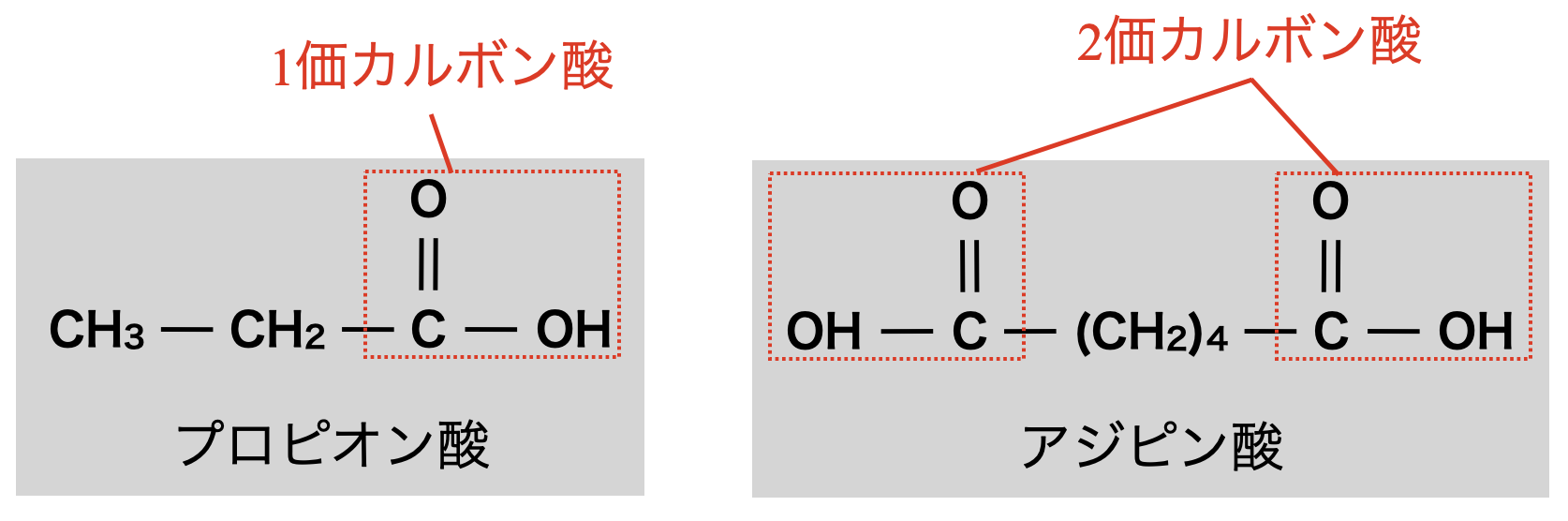
カルボン酸は,カルボキシ基の数で分類することがあります.
カルボキシ基が\(1\)個であるものをモノカルボン酸(\(1\)価カルボン酸)
カルボキシ基が\(2\)個であるものをジカルボン酸(\(2\)価カルボン酸)
といいます.
またカルボキシ基と他の官能基を組み合わせることもあります.
\(1\)分子中にカルボキシ基\(1\)個とアミノ基をもつものをアミノ酸
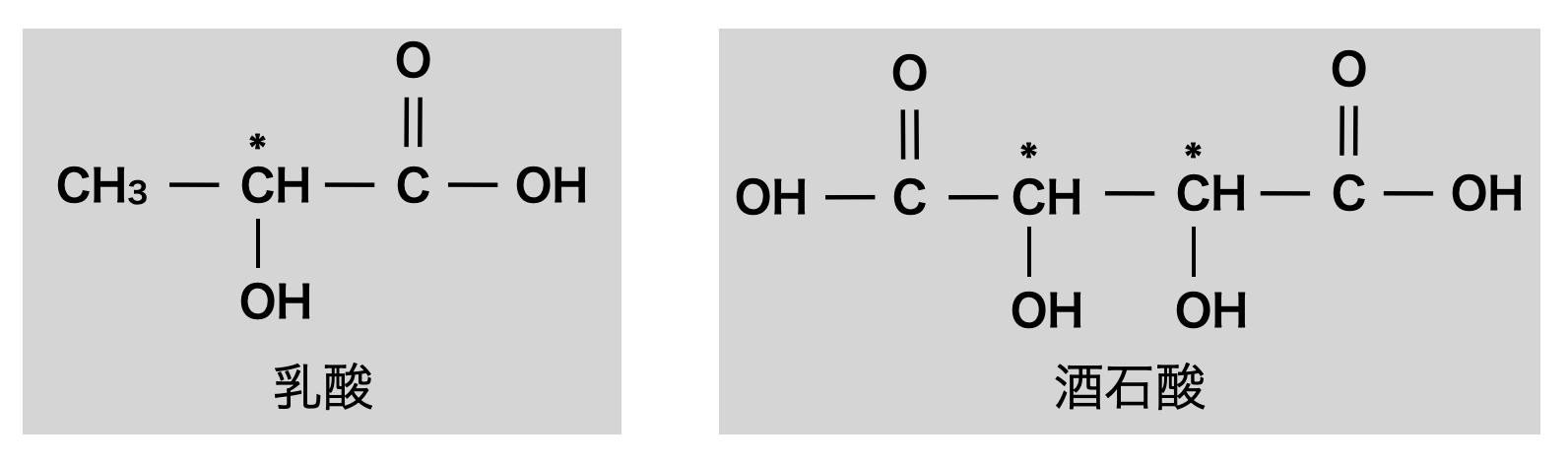
\(1\)分子中にカルボキシ基\(1\)個とヒドロキシ基をもつものをヒドロキシ酸
といいます.
有名なヒドロキシ酸に乳酸と酒石酸があります.特に不斉炭素原子をもつことも含めて覚えてほしいです!
カルボン酸の名前
カルボン酸は慣用名で呼ばれることが多いため,有名なものは覚えておきましょう!
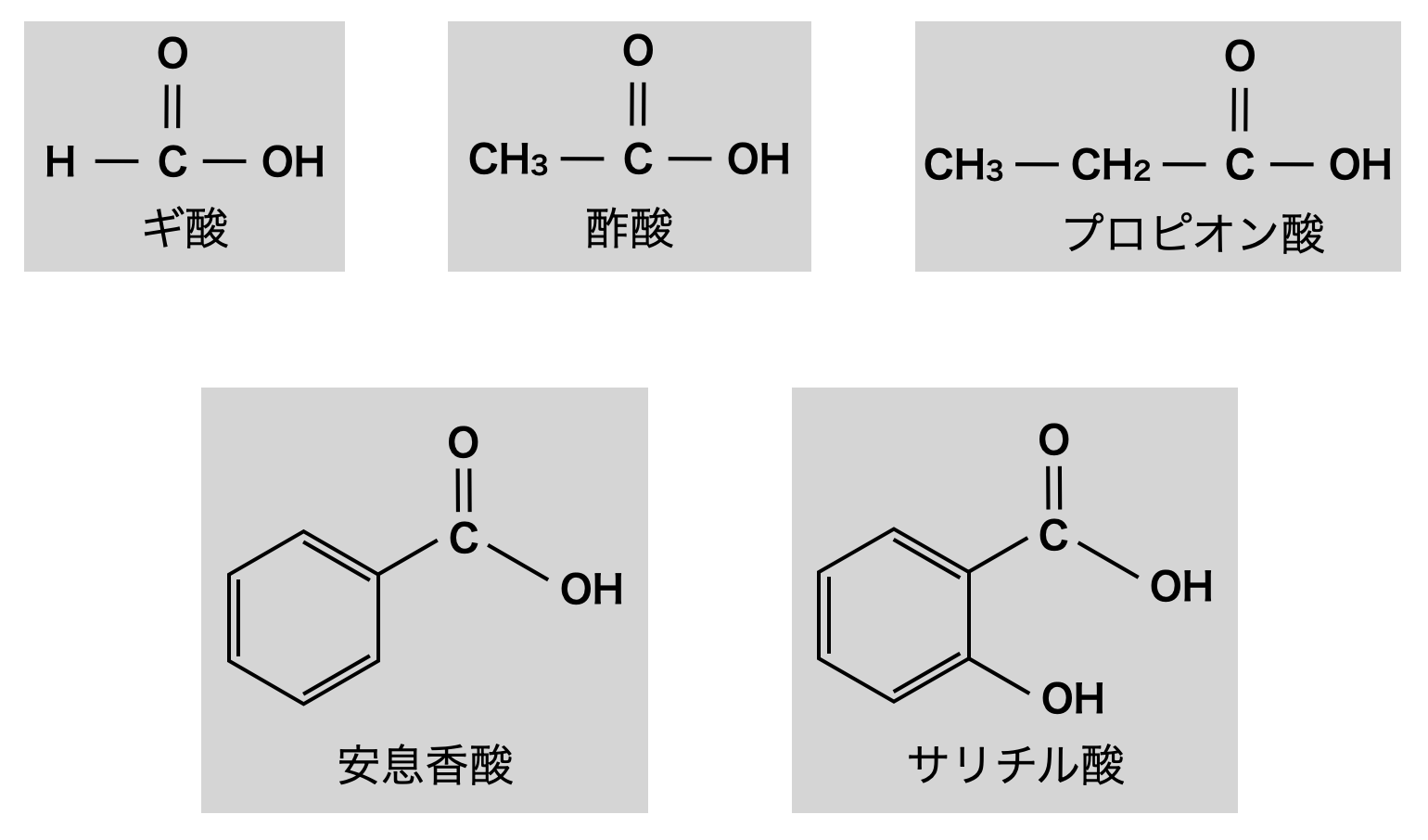
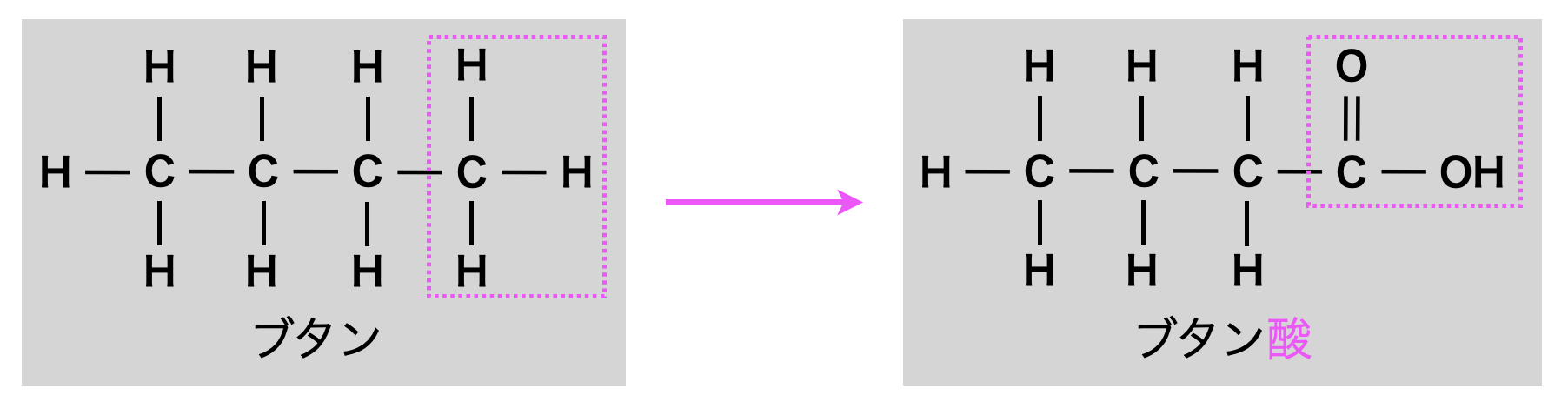
また,ブタンの端をカルボン酸(\(\rm{COOH}\))に置換したものはブタン酸といいます.語尾を「酸」に変えるだけでOKです!
物理的性質
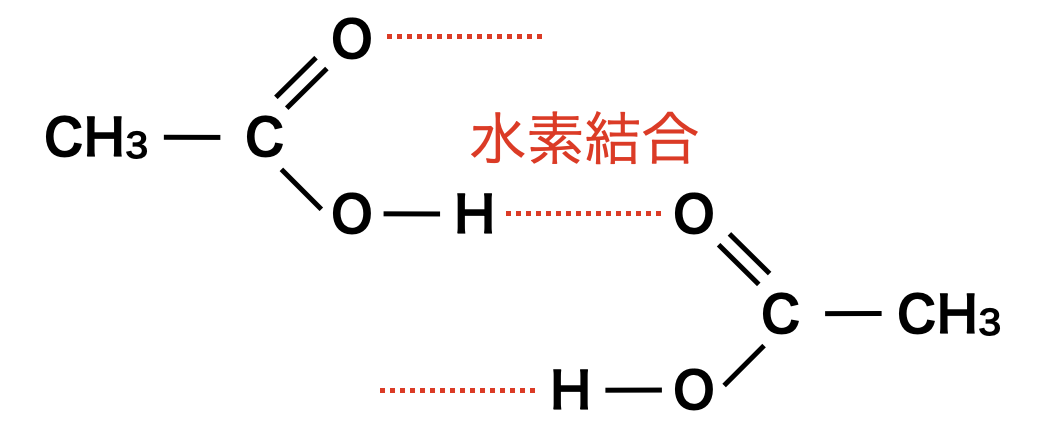
カルボキシ基は分子間で水素結合ができ,沸点・融点が高いです.\(\rm{R-OH}\)はヒドロキシ基よりカルボキシ基の方が官能基中の\(\rm{O}\)原子の数が多いので,水素結合の効果も\(\rm{R-OH}\)より大きくなります.
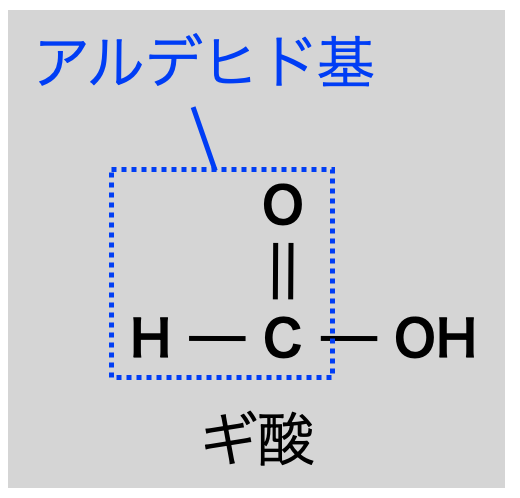
ギ酸はアルデヒド基をもつカルボン酸なので還元性をもちます.
カルボン酸の反応
カルボン酸の反応には,分子間脱水と分子内脱水があります.それぞれみていきましょう!
分子間脱水
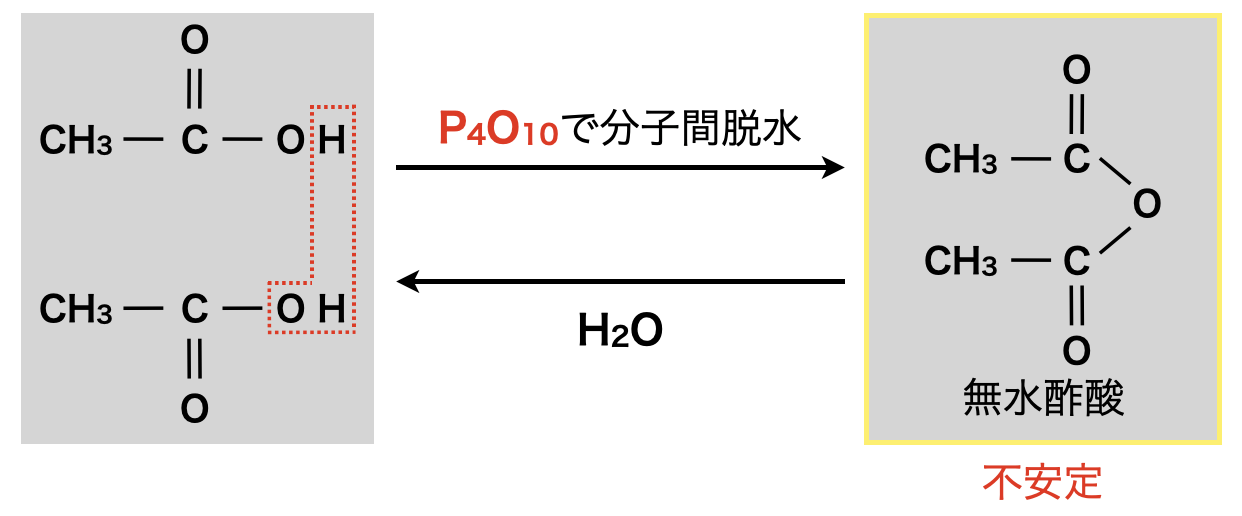
分子間脱水とは名前の通り,\(2\)つの分子から水が取れる(脱水する)反応です.そして脱水したものをカルボン酸無水物といいます.
カルボン酸の分子間脱水反応は反応後に生じるカルボン酸無水物が不安定なため起こりにくいです.アルコールのときに用いた濃\(\rm{H_2SO_4}\)では反応しないため,さらに威力の強い\(\rm{P_4O_{10}}\)(十酸化四リン)を使用します.
分子内脱水
カルボキシ基が同一分子内に\(2\)つ存在するジカルボン酸では分子内脱水が起こる場合があります.これはカルボキシ基が分子内で接近している必要があります.この場合は\(\rm{P_4O_{10}}\)を用いなくても,\(\rm{OH}\)基同士の衝突回数が多くなるので,加熱だけで反応が進行します.
入試で頻出の
① マレイン酸・フマル酸
② フタル酸
について詳しく説明していきますね!
① マレイン酸・フマル酸
分子式が\(\rm{C_4H_4O_4}\)の不飽和ジカルボン酸には,マレイン酸とフマル酸があります.
この分子式を見たら,「マレイン酸かフマル酸!」と言えるようになりましょう!
シス型のマレイン酸はカルボキシ基が接近しているため,加熱すると分子内脱水反応が起こり無水マレイン酸が生じます.なお\(\rm{H_2O}\)を加えるとマレイン酸に戻ります!
一方でトランス型のフマル酸はカルボキシ基が離れているため,加熱しても分子内脱水は起きません.
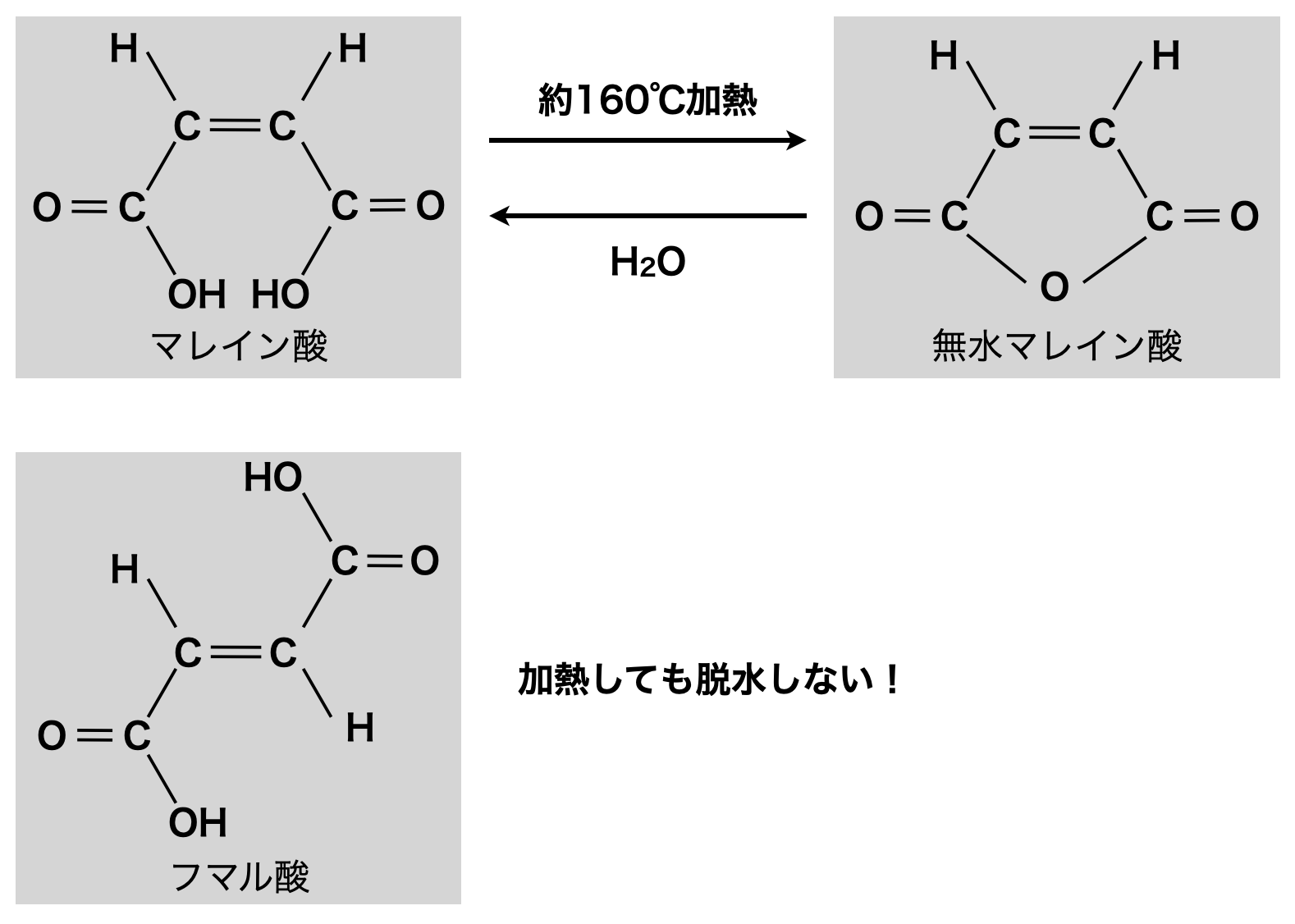
下のような図で私は頭にインプットしています!

まずマレイン酸は「まる」の形をしています.そうでない方をフタル酸と覚えています.またシス・トランス異性体についてですが,シス(\(\rm{cis}\))は英語の\(\rm{this}\)という意味です.そのためシスは\(\rm{OH}\)基が近い方,トランスは\(\rm{OH}\)基が遠い方と覚えています!
参考にしてみてください!
② フタル酸
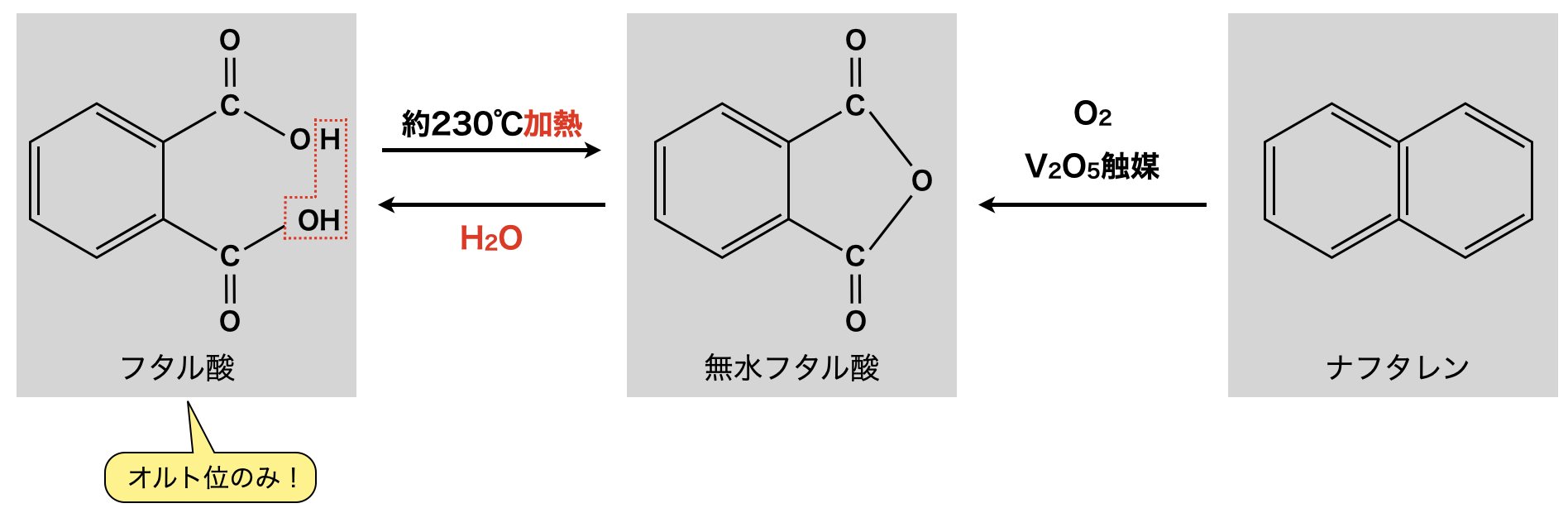
ベンゼン環のオルト位の\(\rm{H}\)原子\(2\)つをカルボキシ基に置換したものをフタル酸といいます.フタル酸の分子式は\(\rm{C_8H_6O_4}\)です!「\(\rm{C_8H_6O_4}\)が出てきたら,フタル酸と連想できるようになりましょう!」
フタル酸を約\(230^\circ \rm{C}\)程度で加熱すると,\(2\)つのカルボキシ基が接近しているので脱水反応が起こり,無水フタル酸が得られます.またナフタレンを\(\rm{V_2O_5}\)触媒下で\(\rm{O_2}\)と反応させることでも無水フタル酸が得られます.このような反応は\(1\)つの図として覚えていきましょう!
脱炭酸反応
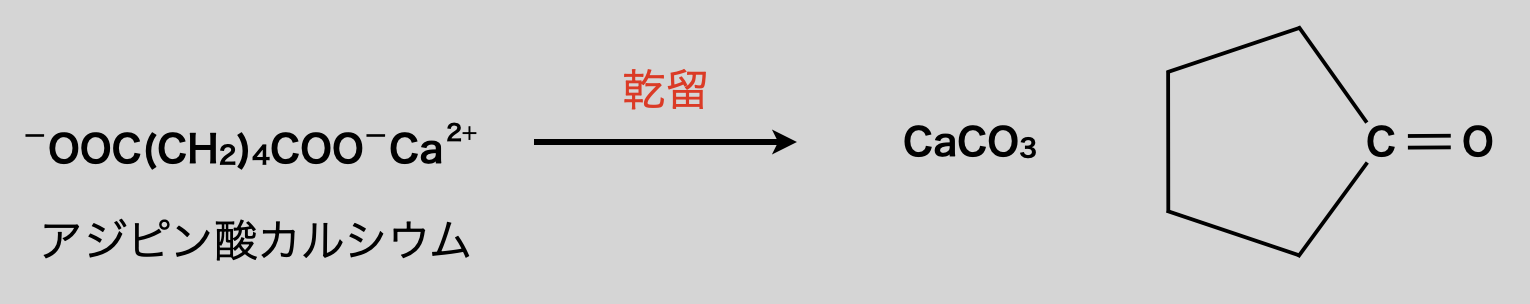
カルボン酸由来の塩\(\rm{+NaOH}\)を固体のまま試験管で乾留すると,\(\rm{CO_3^{2-}}\)(炭酸イオン)が脱離する脱炭酸反応が起こります.受験に必要な反応は\(2\)つなので,しっかりと覚えていきましょう!
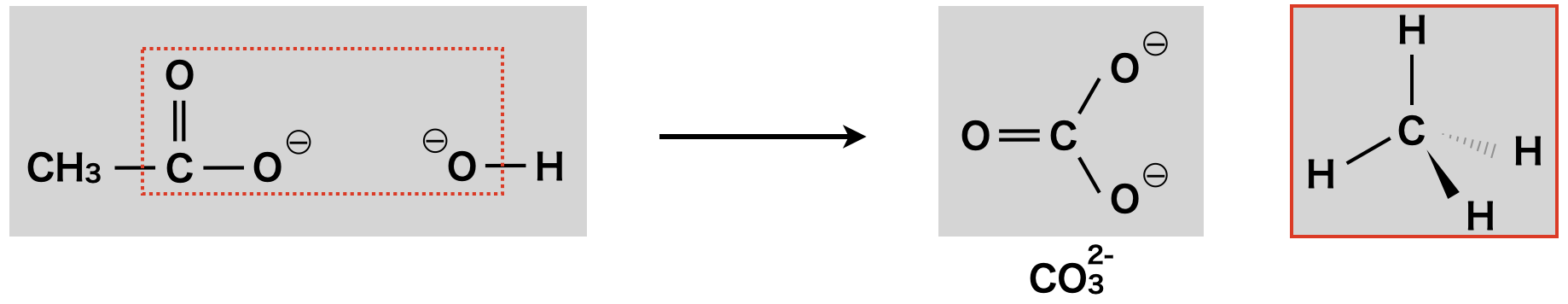
① \(\rm{CH_4}\)生成
酢酸イオン(\(\rm{CH_3COO^-}\))に水酸化物イオン(\(\rm{OH^-}\))が攻撃することで,\(\rm{CO_3^{2-}}\)イオンが脱離し,\(\rm{CH_4}\)が生成します.
\(\rm{CH_3COONa\ +\ NaOH\ →\ Na_2CO_3\ +\ CH_4}\)
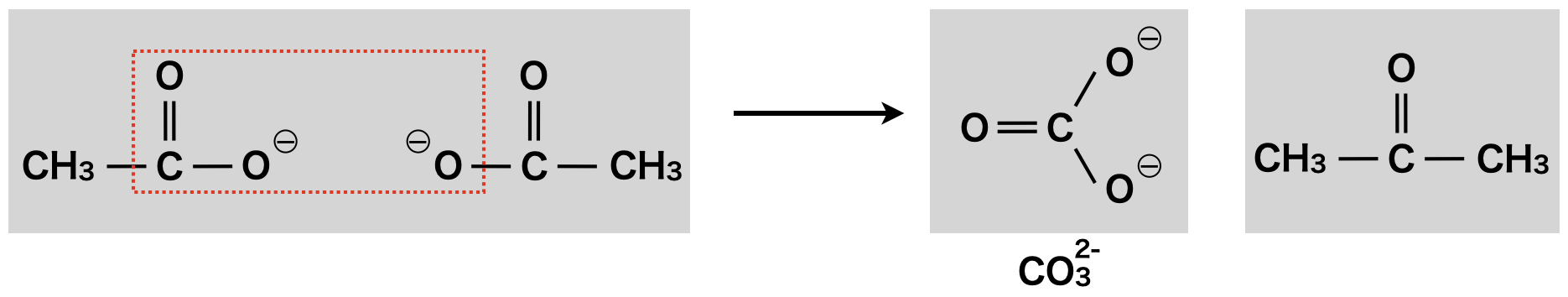
② \(\rm{CH_3COCH_3}\)生成
次は,酢酸イオン(\(\rm{CH_3COO^-}\))に同じ酢酸イオン(\(\rm{CH_3COO^-}\))が攻撃することで,\(\rm{CO_3^{2-}}\)イオンが脱離し,\(\rm{CH_3COCH_3}\)が生成します.
\(\rm{(CH_3COO)_2Ca\ →\ CaCO_3\ +\ CH_3COCH_3}\)
乾留とは,固体物質を空気を遮断して加熱分解し,生成物を取り出す操作のことです.
上の\(2\)つの反応を見て少し疑問を感じた方もいるかもしれません.脱炭酸反応では,陰イオン(アニオン)同士を衝突させて反応させています.陰イオン同士は反発するため,反応しないと思うかもしれません.このように考えられた人は,化学の理解力がグンっとアップしています!
そのためこの反応を促進させるために,温度をかなりあげる必要があります.水溶液を加熱するだけでは条件を満たせないため,固体のまま加熱乾留を行います.
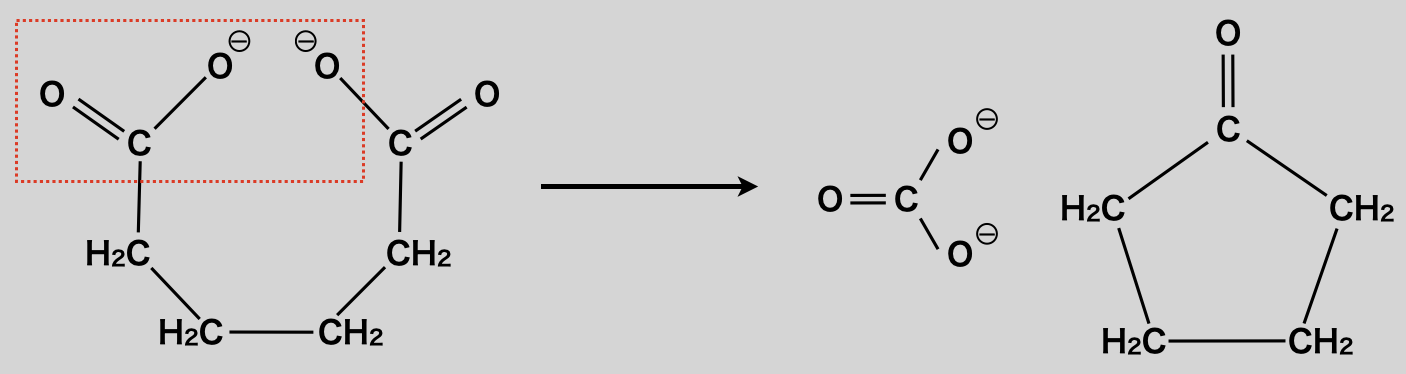
先程の②で酢酸イオン同士の反応によってケトンが生成する反応を見ました.この反応がジカルボン酸で起きた場合は,下のような反応となり,環状ケトンが生成します.難関大などで出る可能性があるので,原理を理解しておきましょう!
<原理>
エステル
次は,エステルについてみていきます!
エステルとは,カルボン酸とアルコールが縮合した構造をいいます.
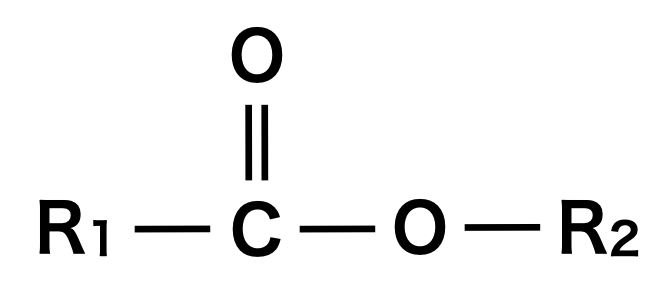
上の構造で,\(\rm{R_1=H}\)の場合はギ酸エステルとなります.ただ,\(\rm{R_2=H}\)の場合はただのカルボン酸となるため,エステルとはいいません!
エステルとは?
エステルは,水に対して難容性のものが多いです.またフルーティーな芳香をもつ液体です!
エステルの名称についても覚えておきましょう!エステルの場合は,基の名称と種類名を組み合わせて表します.この注意点としては,語尾に「酸」がこないようにすることです!
例えば下の物質を命名してみましょう!

この場合は,酢酸エチルとなります.
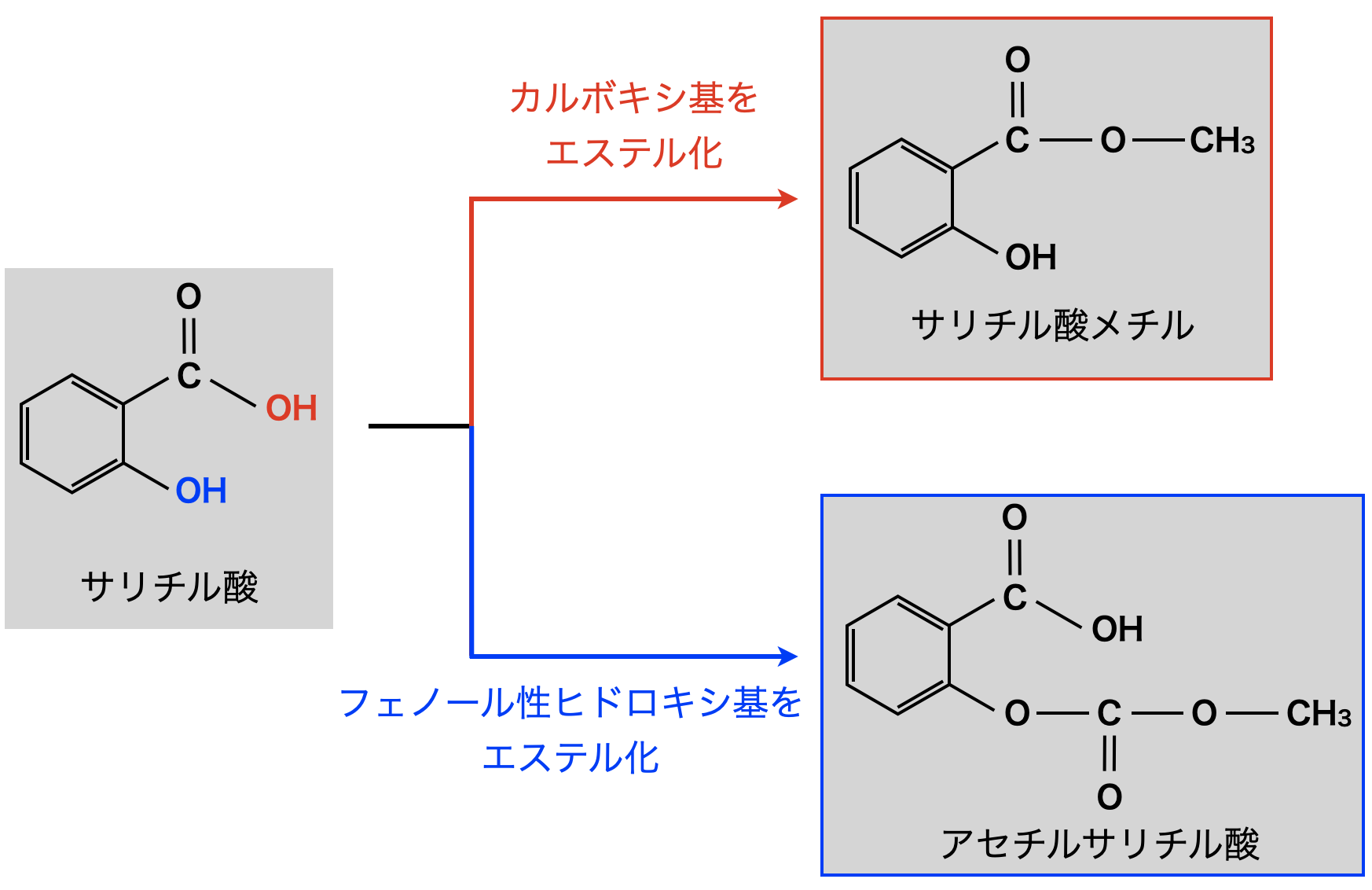
芳香族カルボン酸であるサリチル酸はカルボキシ基とフェノール性ヒドロキシ基があります.そのためそれぞれの官能基がエステル化できます!
サリチル酸のカルボキシ基をメタノールでエステル化すると,サリチル酸メチルとなります.カルボキシ基がなくなるため,語尾に「酸」は付けないようにします!
またフェノール性ヒドロキシ基を無水酢酸でエステル化すると,アセチルサリチル酸となります.この場合は,カルボン酸(\(\rm{COOH}\))が残っているため,語尾に「酸」をつけます!
エステル化
まず,エステル化の基本を説明していきます!
カルボン酸のカルボキシ基の\(\rm{OH}\)とアルコールの\(\rm{H}\)を加熱・縮合します.このとき登場するのが有機化学で脱水するときによく使用する濃\(\rm{H_2SO_4}\)です!
またエステルに希\(\rm{H_2SO_4}\)を加えて加熱することで,加水分解できます.
酢酸とエタノールの例をみてみましょう!
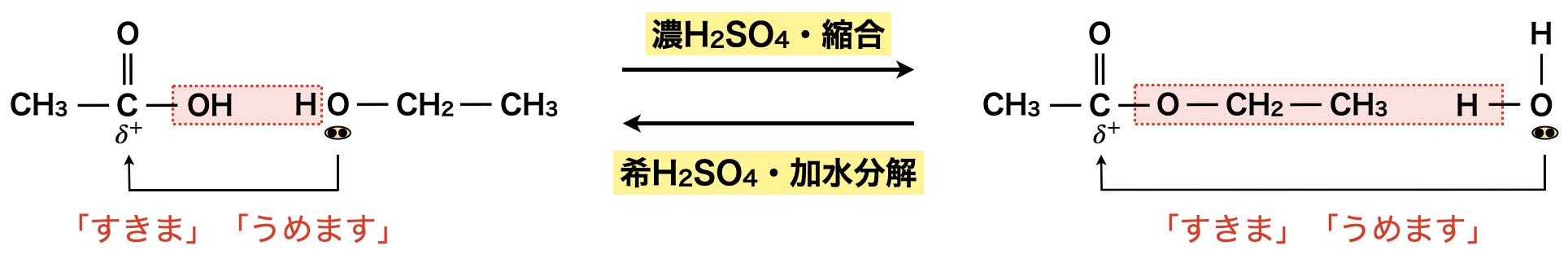
カルボキシ基の\(\rm{C}\)原子が\(\delta^+\)(すきま)となっています.このすきまにアルコールの\(\rm{OH}\)の\(\rm{O}\)原子がもつ非共有電子対が攻撃して縮合(うめます)していきます!つまり,これは「すきま」「うめます」反応となっています!
エステル化の詳細
エステル化を考えるときは,先程説明した「すきま」「うめます」と覚えておけば大丈夫です.ここではさらに踏み込んでその詳細を説明していきます!
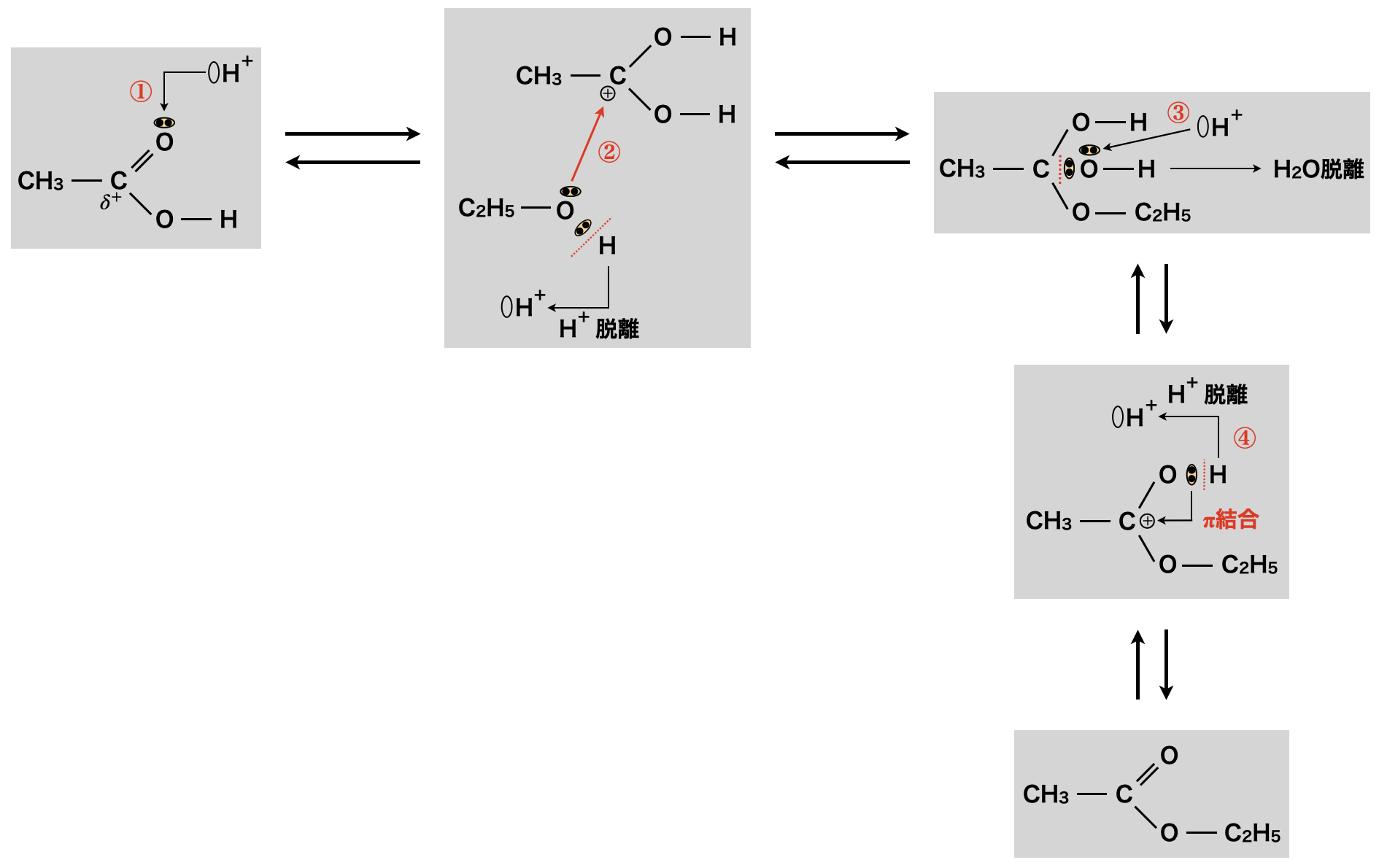
① カルボン酸の\(\rm{O}\)原子がもつ非共有電子対に\(\rm{H^+}\)イオンが配位結合します.\(\rm{H^+}\)イオンのもつ\(+\)電荷をカルボン酸の\(\rm{C}\)原子が受け持ちます.これによって,さらにカルボン酸の\(\rm{C}\)原子の\(\delta^+\)(すきま)がさらに大きくなります.
② 「すきま」の大きくなったカルボン酸の\(\rm{C}\)原子にアルコールの\(\rm{O}\)原子のもつ非共有電子対がそのすきまを「うめる」ように攻撃します!このとき,\(\rm{OH}\)基由来の\(\rm{H^+}\)イオンが脱離します.
③ ②で生じた化合物のヒドロキシ基の\(\rm{H^+}\)イオンが攻撃して\(\rm{H_2O}\)が脱離します.
④ ③で生じた化合物から\(\rm{H^+}\)イオンがさらに脱離することで,\(\pi\)結合が生成します!
エステル化の反応において,\(\rm{H^+}\)イオンがよく出てきます!この反応のように,特定の化学反応を促進する物質で,自身は反応の前後で変化しないものを触媒(\(\rm{catalyst}\))といいます.
エステル化において,\(\rm{H^+}\)イオンはカルボン酸の\(\rm{C}\)原子の「すきま」を大きくしますが,結合→脱離を繰り返し自身は変化しないので,触媒として働いています!
カルボン酸とアルコールのエステル化は,正反応と逆反応が同時に起こる可逆反応です!
ル・シャトリエの原理により,右辺の\(\rm{[H_2O]}\)が低いとき(濃\(\rm{H_2SO_4}\)を用いる)は,平衡は右に傾きます!
一方で,右辺の\(\rm{H_2O}\)が\(\rm{[H_2O]}\)が高いとき(希\(\rm{H_2SO_4}\)を用いる)は,平衡は左に傾きます!
これはこの後重要になってくるので,しっかりと覚えておいてくださいね!
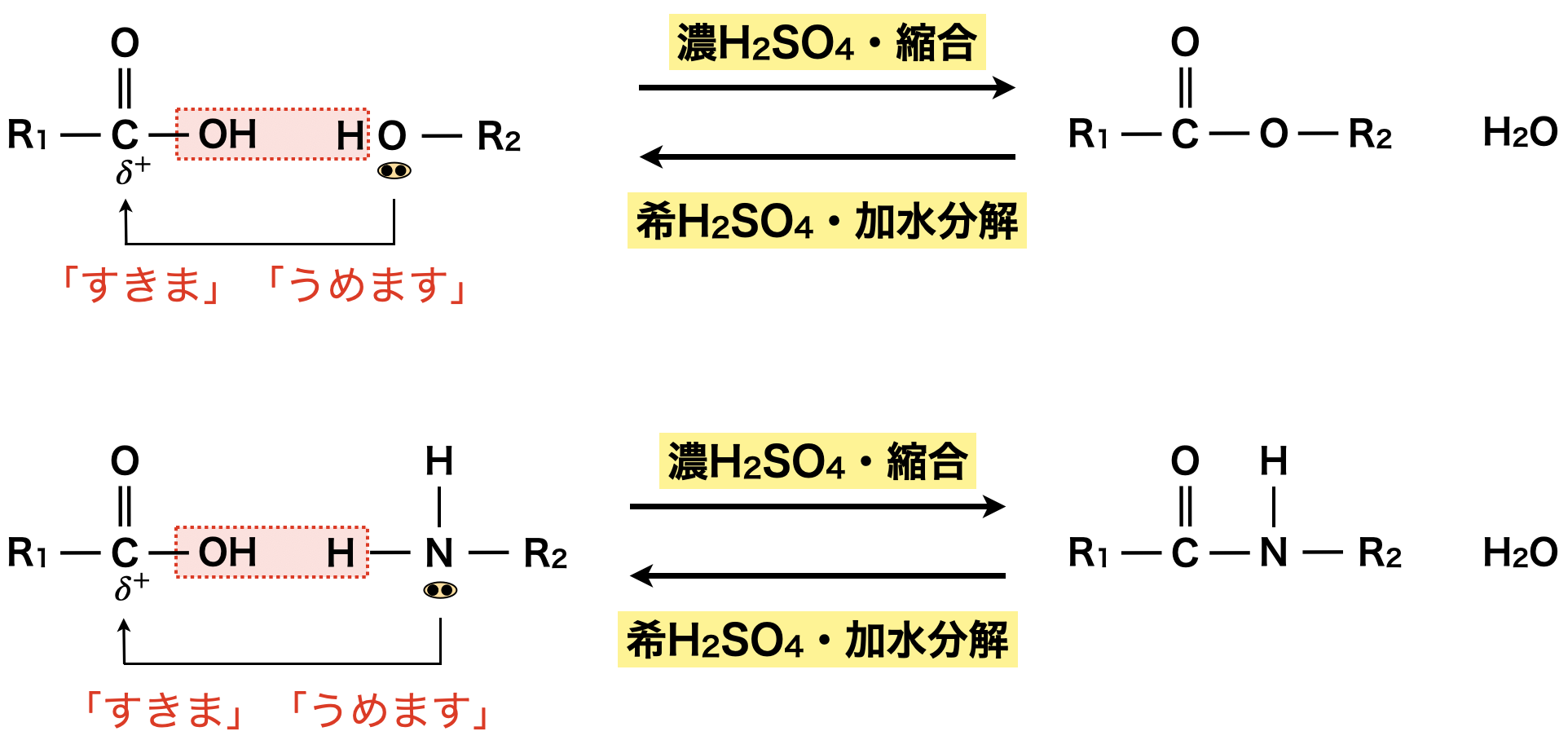
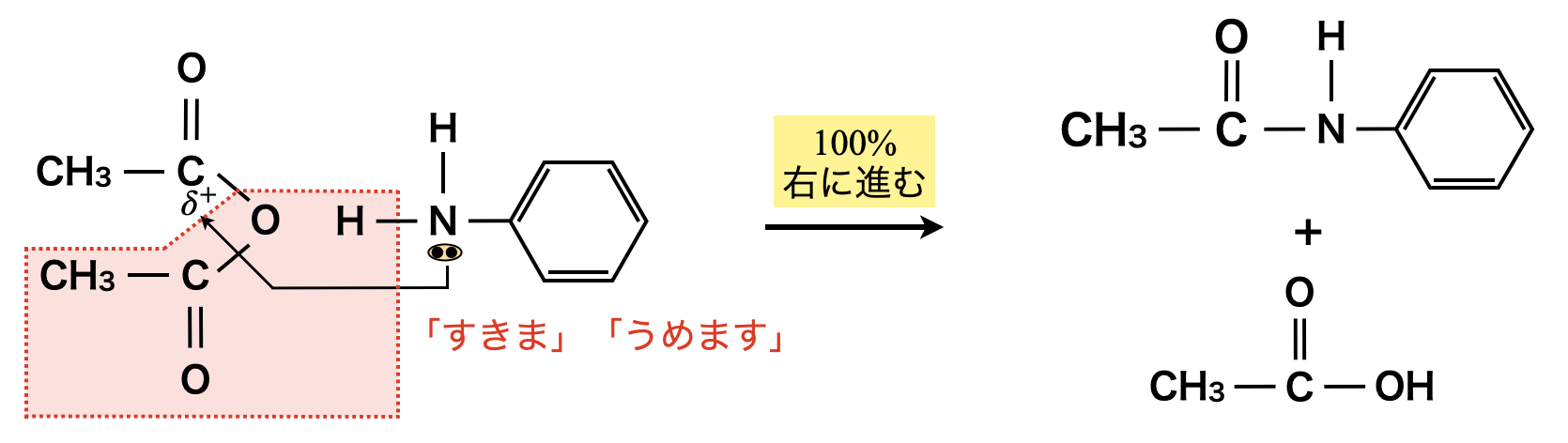
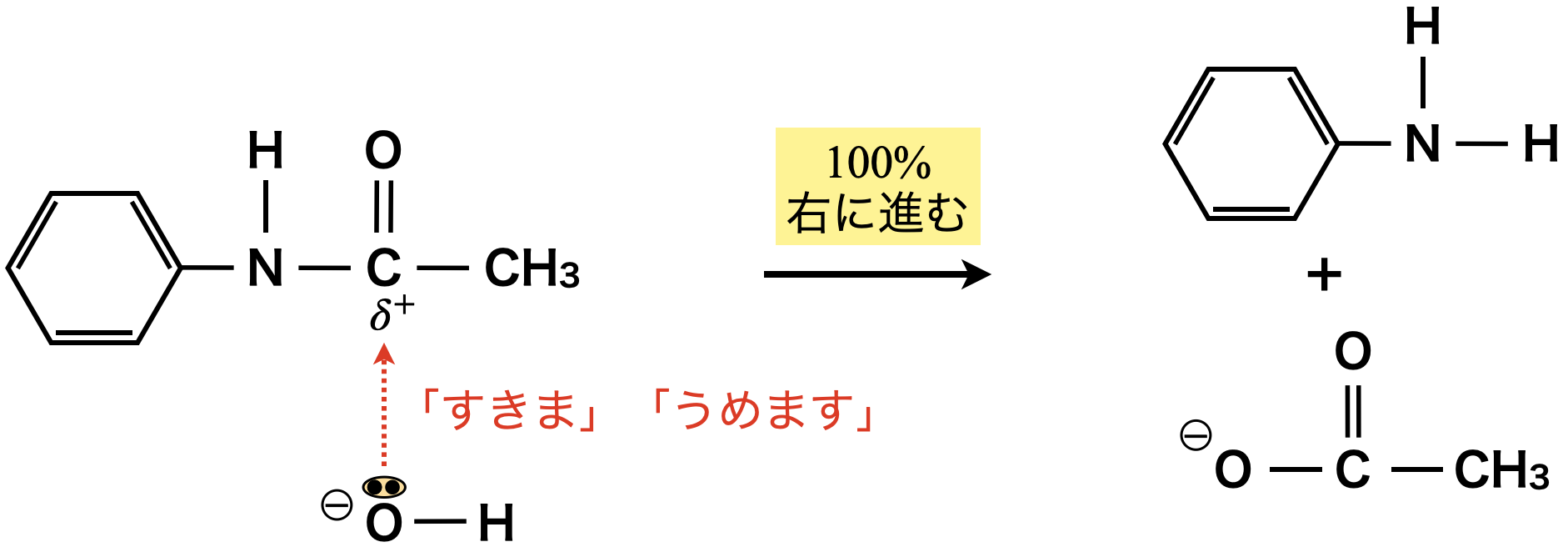
エステルを生成する反応とアミドを生成する反応は,共に「すきま」「うめます」反応として考えることができます!アミド化の場合は,エステル化の「\(\rm{O}\)」が「\(\rm{N}\)」に変化しただけと考えましょう!
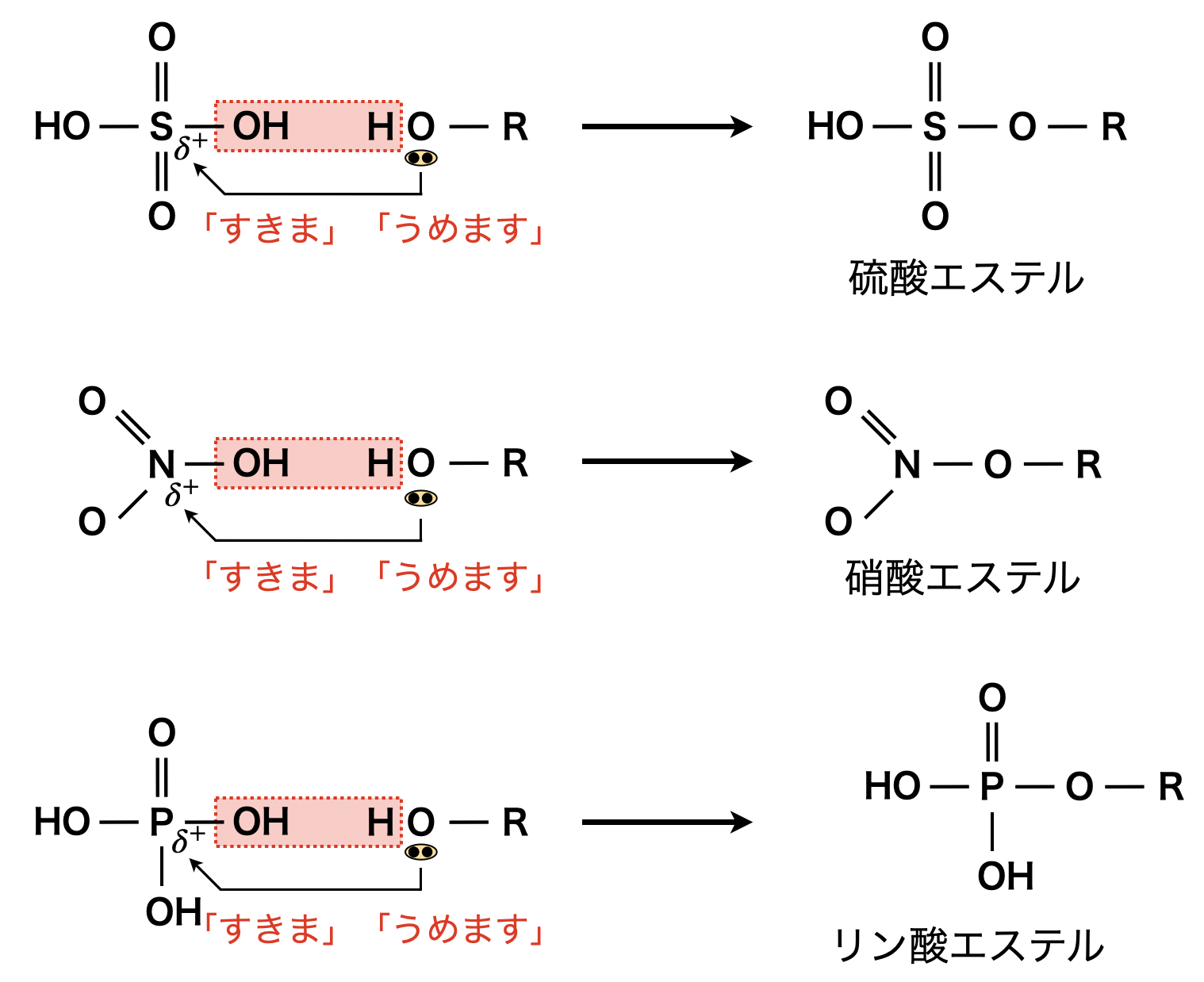
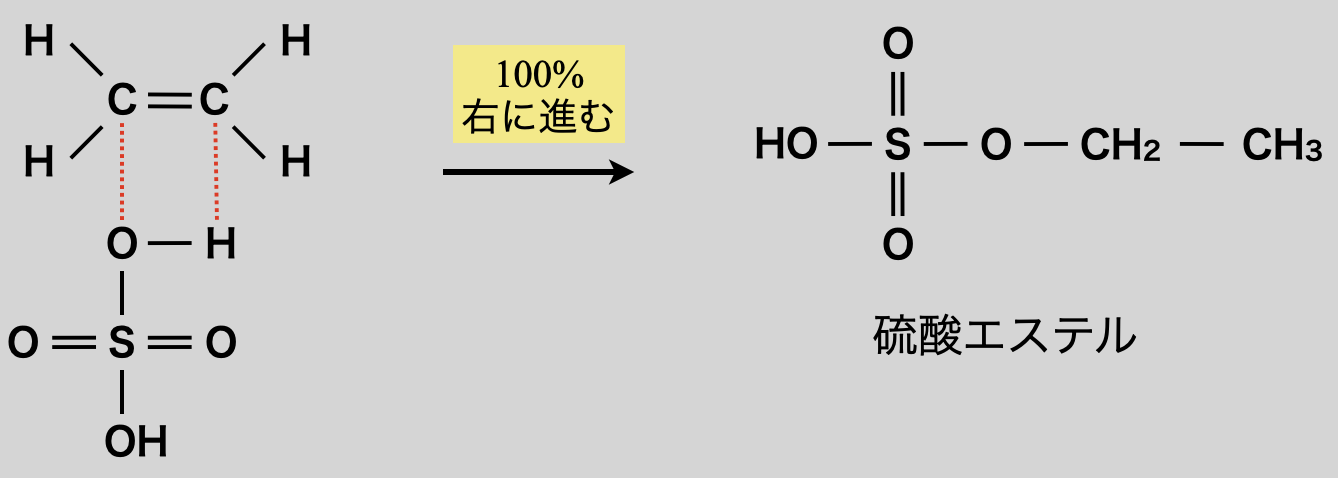
先ほども見てきたように,エステル化やアミド化は「すきま」「うめます」で反応します.そのため電子の「すきま」はカルボン酸の\(\rm{C}\)原子でなくても構いません!硫酸・硝酸・リン酸のようなオキソ酸は,中心原子に\(\delta^+\)が存在するので,「すきま」「うめます」反応が起こります.それぞれ硫酸エステル・硝酸エステル・リン酸エステルになります!
収率\(100\%\)のエステル化
先ほども説明したようにエステル化は可逆反応なので,\(100\%\)右に進むこと(エステル化)も左に進むこと(加水分解)もありません.
では,エステルの収率を\(100\%\)にするにはどうすればよいでしょうか?
\(2\)つの方法を順に説明していきますね!
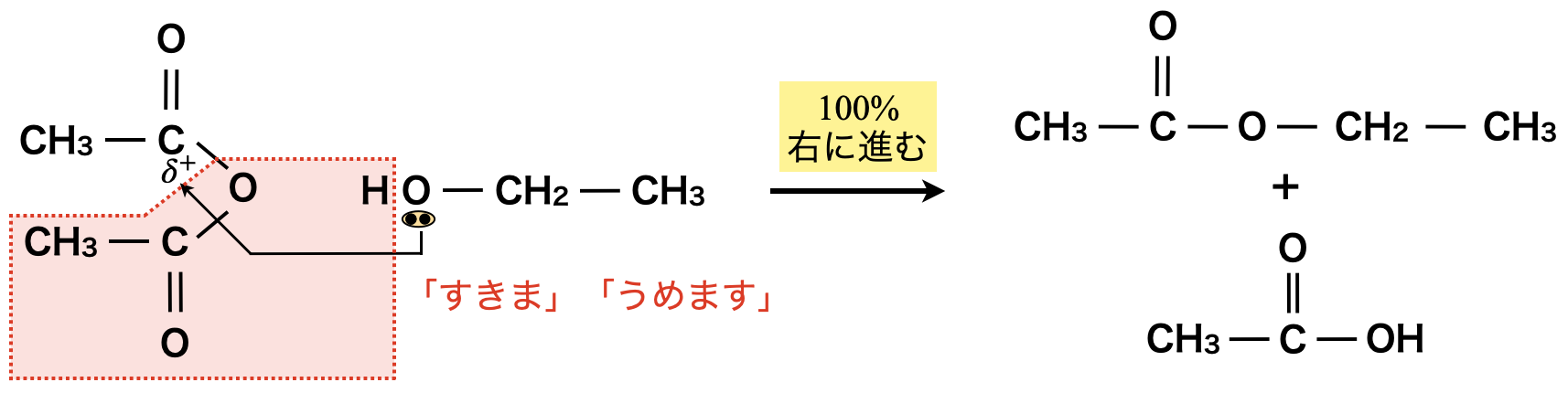
① カルボン酸無水和物によるエステル化
② アルケンによるエステル化
カルボン酸無水和物によるエステル化
例として,酢酸とエタノールのエステル化を考えていきます!
この場合,酢酸とエタノールでは先ほど見たように可逆反応になってしまいます.そこで酢酸より不安定な無水酢酸を使ってみましょう!すると下のような反応によってエステルが生成します.
\(\rm{(CH_2CO)_2O\ +\ C_2H_5OH\ →\ CH_3COOC_2H_5\ +\ CH_3COOH}\)
この場合,無水酢酸よりも酢酸の方が安定であるため,この反応は\(100\%\)進行します!(つまり,不可逆反応!)
このようにカルボン酸より不安定なカルボン酸無水物を使うと,エステル化が\(100\%\)進行します!
またアミド化も同じように100\(\%\)進行します!
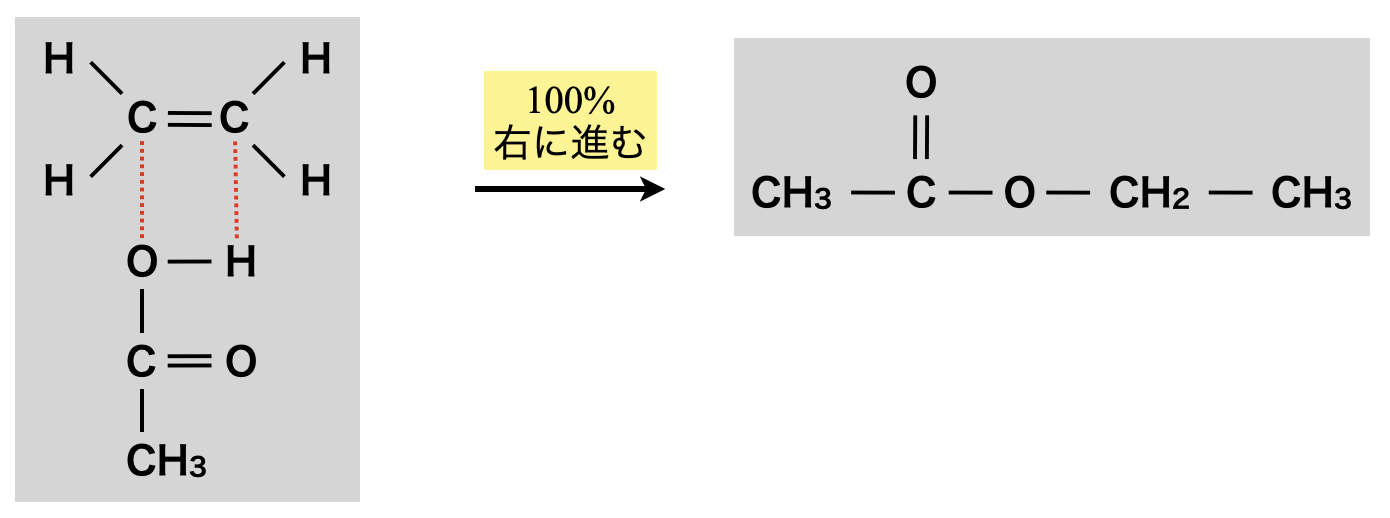
アルケンによるエステル化
エステル化を行う前にアルコールを分子内脱水し,アルケンに変化させておくという方法もあります.この場合もエステル化は\(100\%\)進行します!
\(\rm{CH_2=CH_2\ +\ CH_3COOH\ →\ CH_3COOC_2H_5}\)
先ほど硫酸・硝酸・リン酸のようなオキソ酸でもエステル化すると言いました.そのためオキソ酸とアルケンを反応させることでエステルを生成することもできます!
収率\(100\%\)の加水分解
\(100\%\)の収率でエステルを加水分解するためには,\(\rm{NaOH \cdot KOH}\)などの強塩基を用いて加熱する必要があります.このような反応をケン化といいます.
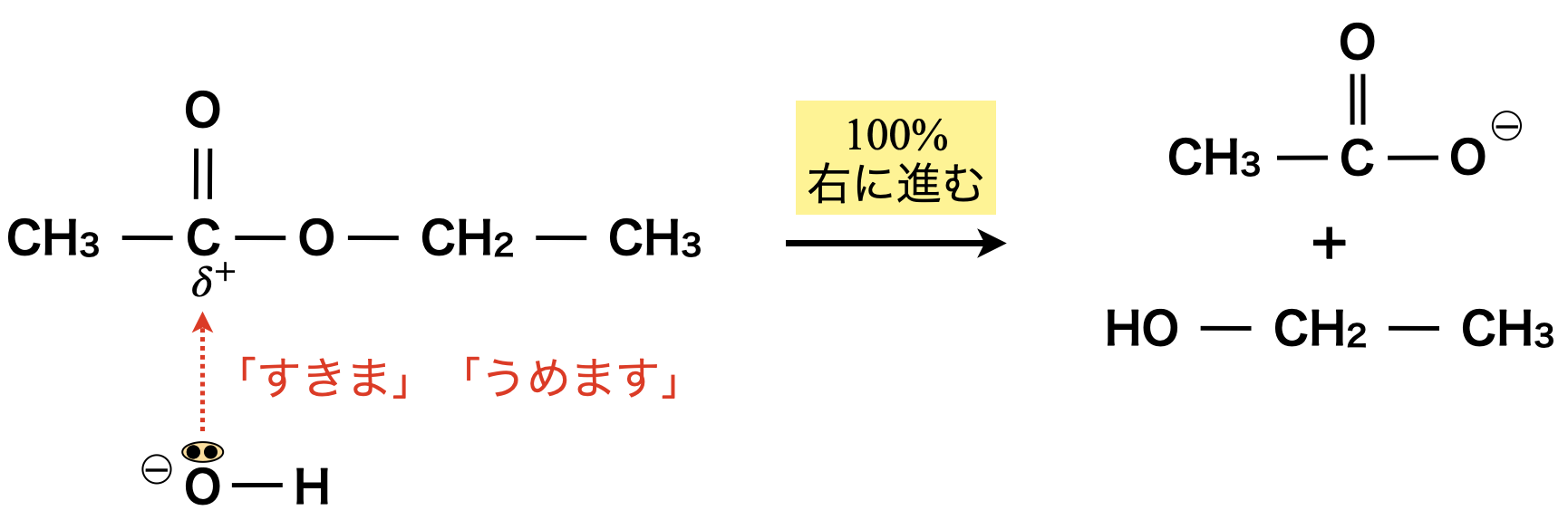
エステルとアミドは根本的には同じように考えることができるので,アミド化についても\(\rm{NaOH}\)を加えて加熱することで,収率\(100\%\)で加水分解することができます.
今回はかなり長かったので,ポイントをまとめてみました!
下のポイントを見ながらもう一度読み返してもらうことで,より理解が深まると思います!

それぞれの方法を混乱しないように整理して覚えてくださいね!



コメント