
- ザイツェフ則の復習
- アミノ酸の等電点の解法
- 未知の反応の考え方
を特にポイントとしています.昨日の自分より少しでもレベルアップしていきましょう!
大問\(4\)の総評
こんにちは,\(\rm{KUT}\)です.
本記事では,\(2018\)年京大化学の大問\(4\)について解説していきます.
また解説に加えて,それぞれの問題で覚えておいてほしいポイントについて詳しく説明していきます.
京大の化学は難しいという印象が強い方が多いと思いますが,京大化学には難しい問題と標準問題の\(2\)つがあります.ここで,受験生が対策すべきことが\(2\)つあります.
\(1\)つ目は,標準問題を最後まで解き切る力を身につけることです.これにより,まずは平均点を取ることを目指します.
\(2\)つ目は,難しい問題と標準問題を見分けられる目を養うことです.試験本番は時間制限内に自分の解ける問題を解き切る必要があります.そのため,難しい問題は解かずに,標準問題をしっかりと選択していきながら,最後まで解いていくことが必要になります.
この記事では,問題を選択していく目を養うために,どのようにして判断していくのかということも自分なりに説明していきます.
それでは,\(2018\)年京大化学の大問\(4\)の解説に進んでいきましょう!
大問\(4\)
(\(\rm{a}\)):二重結合の酸化開裂反応
(\(\rm{a}\))は,\(\rm{C=C}\)の\(\rm{KMnO_4}\)による酸化開裂反応です.問題文に考え方が説明されていたので,その誘導に乗っていければ解ける問題ですよ!
詳細についてはこちらの記事でも解説しているので,レベルアップも含めてぜひご覧ください.

問\(1\):構造決定問題
問題文の図\(1\)から,\(\rm{C=C}\)に硫酸酸性条件下で\(\rm{KMnO_4}\)を反応させると,その間に\(\rm{-COOH}\)基が形成されることがわかります.二重結合の\(\rm{CH}\)がそれぞれ\(\rm{COOH}\)に変換されるイメージですね!
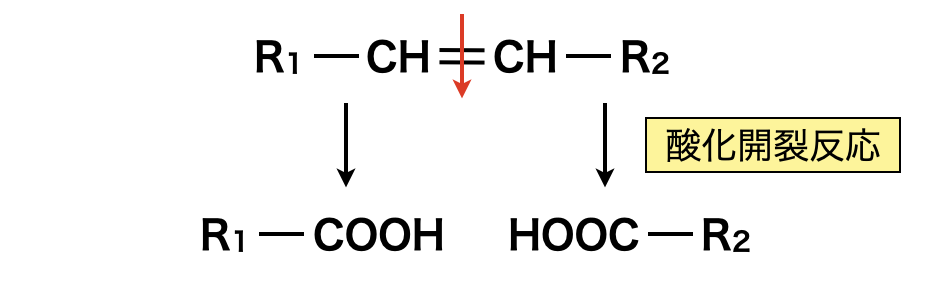
Aはモノカルボン酸なので,何も反応させない状態ですでに\(\rm{-COOH}\)基が端にあることがわかります.この状態で酸化反応を行うと,プロピオン酸\(1\)分子とマロン酸\(2\)分子が生成されるので,とりあえずこれらを並べてみましょう.
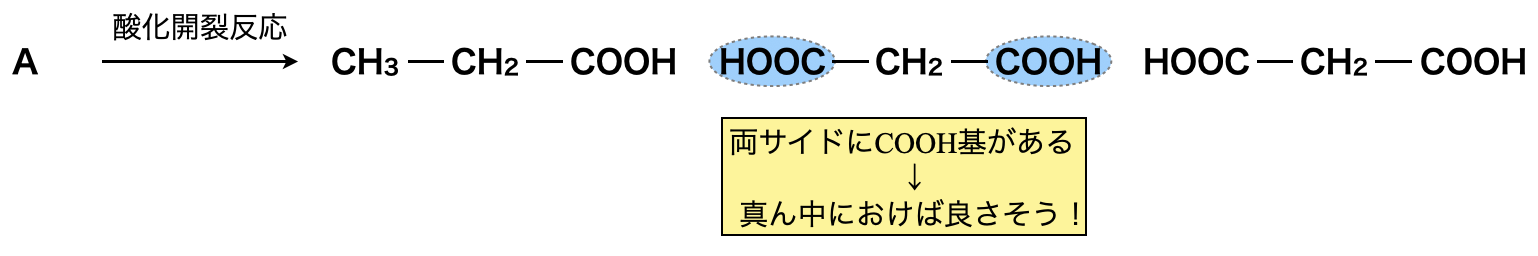
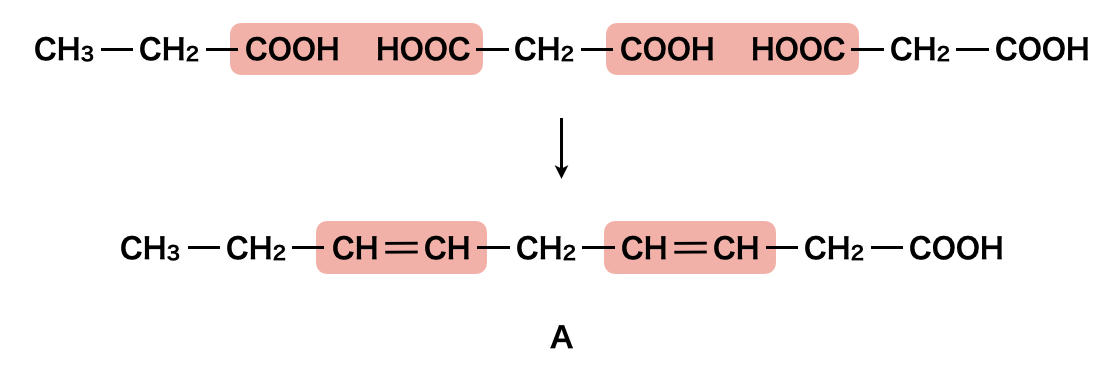
すると,マロン酸には\(\rm{-COOH}\)基が\(2\)つついているので,真ん中にあり,その端にそれぞれプロピオン酸とマロン酸があることがわかります.端の\(2\)つに関しては,どちらにおいてもひっくり返せば同じになるので,どちらでも大丈夫ですよ!
問\(2\):構造決定問題
まず構造決定で\(1\)番大切なことは,\(\rm{C}\)骨格を決定することでした.
今回の問題では,Bに水分子を付加してCを得たので,CはBと\(\rm{C}\)骨格は変化しません.そして,C→Dは問題文に書かれているように\(\rm{C}\)骨格は変化していないので,すべての変化で\(\rm{C}\)骨格は変化していないことがわかります.
まず,Cから決定していきましょう.
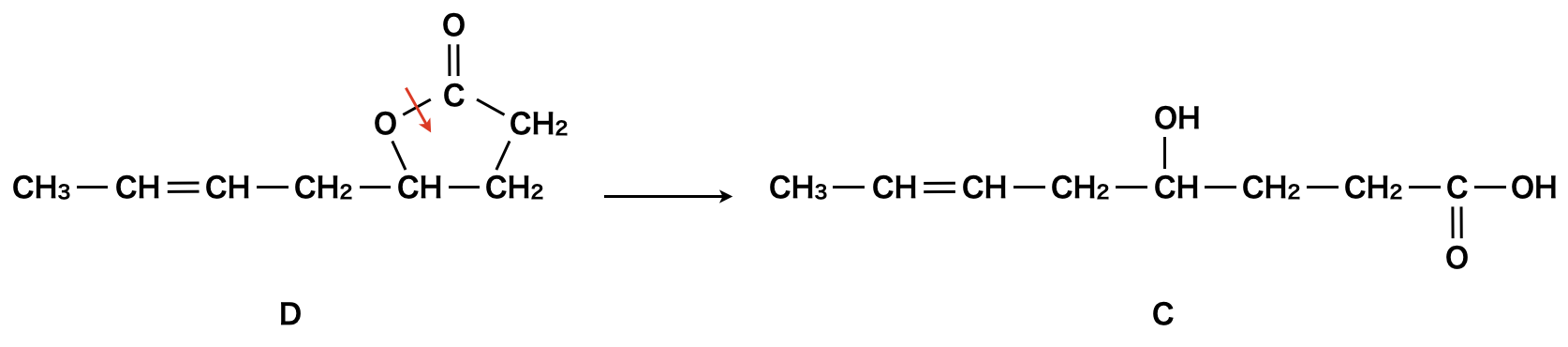
Cはヒドロキシ酸と書かれているので,\(\rm{OH}\)基と\(\rm{COOH}\)基が共に存在することがわかります.そしてC→Dでこの\(\rm{-OH}\)と\(\rm{-COOH}\)がエステル化反応をしていると考えられます.ということは,D→Cを考えるときには,その逆反応である加水分解を考えればよいというわけです.
具体的には,Dに存在する環状のエステル(\(\rm{-COO}\))を開裂することで,\(\rm{-OH}\)と\(\rm{-COOH}\)が共に存在するようになります.
次は,Bについて考えていきます.
Cから\(\rm{OH}\)基が失われるとき,二重結合の生成には\(\rm{2}\)種類あります.この失われ方については,ザイツェフ則というものがあります.ザイツェフ則について,簡単に復習しておきましょう.
ザイツェフ則とは,アルコールの分子内脱水についての経験則です.
アルコールの分子内脱水では,\(\rm{-OH}\)基の結合した\(\rm{C}\)原子の両隣の\(\rm{C}\)原子のうち,\(\rm{H}\)原子の数の少ない方から\(\rm{H}\)原子が優先的に失われ,主生成物が得られます.
もっとかみくだいて説明すると,\(\rm{C}\)原子には\(\rm{H}\)原子が\(2\)つ,\(\rm{C}\)原子には\(\rm{H}\)原子が\(3\)つついています.そのため,\(\rm{H}\)原子の少ない\(\rm{C}\)原子から\(\rm{H}\)原子が失われる方が主生成物になるということです.
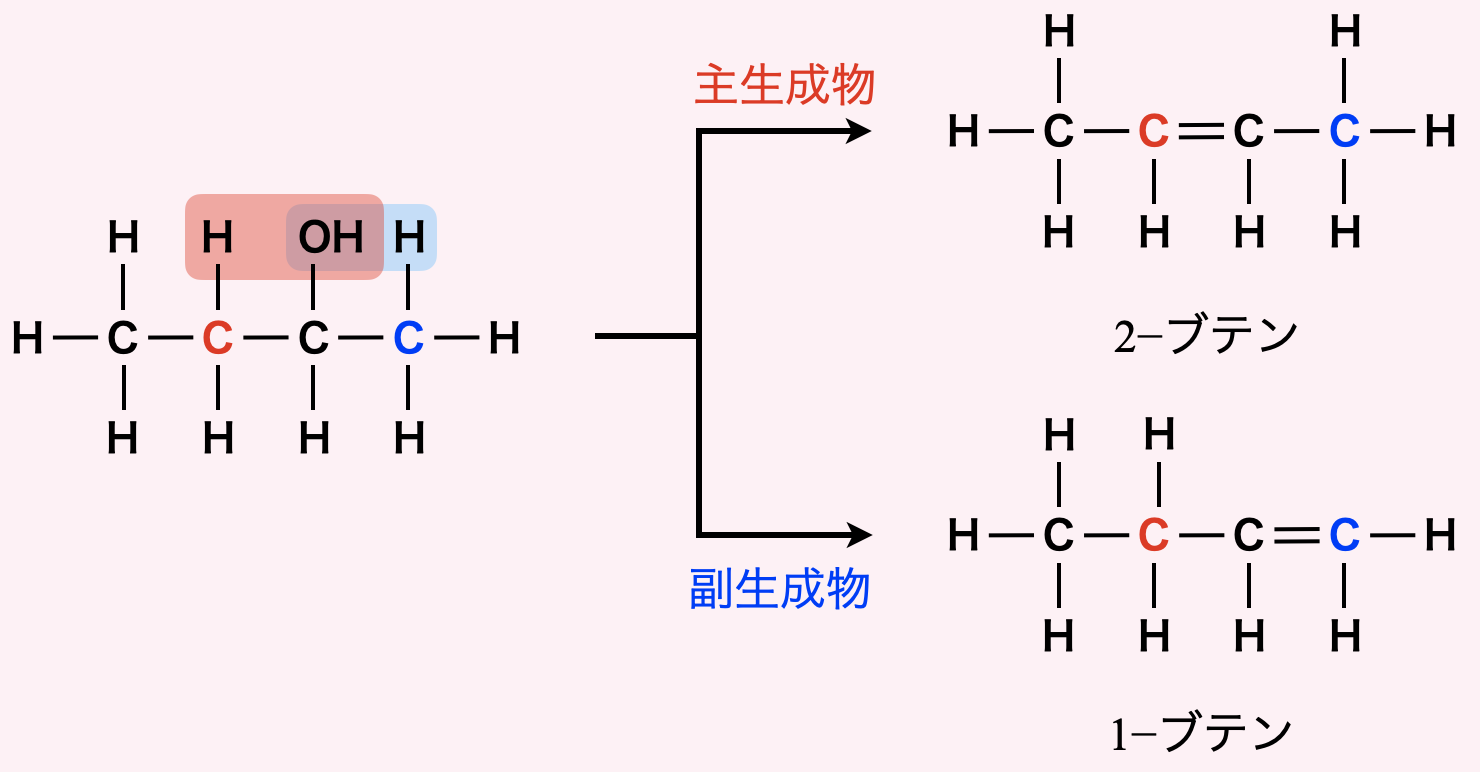
今回については,どちらの\(\rm{C}\)原子にも\(\rm{H}\)原子が\(2\)つついているので,この法則を使うことはできません.ただ,このような法則があるということを知っておいてほしいと思い,紹介しました.
この法則を使わないとは言いましたが,どちらから\(\rm{H}\)原子を抜くのかという考え方はとても大切です.
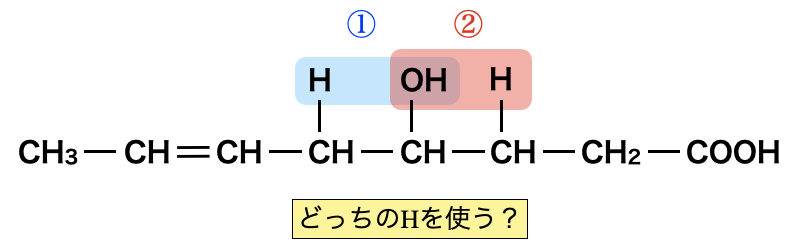
\(2\)パターン考えることができるのでそれぞれ考えていきましょう.
\(1\)つ目は,左側に\(\rm{C=C}\)結合があるパターンで,\(2\)つ目は,右側に\(\rm{C=C}\)結合があるパターンです.そしてこれらの\(\rm{C=C}\)結合に対して酸化開裂反応を行って,マロン酸が生成されるのがどちらであるかを見極めましょう.
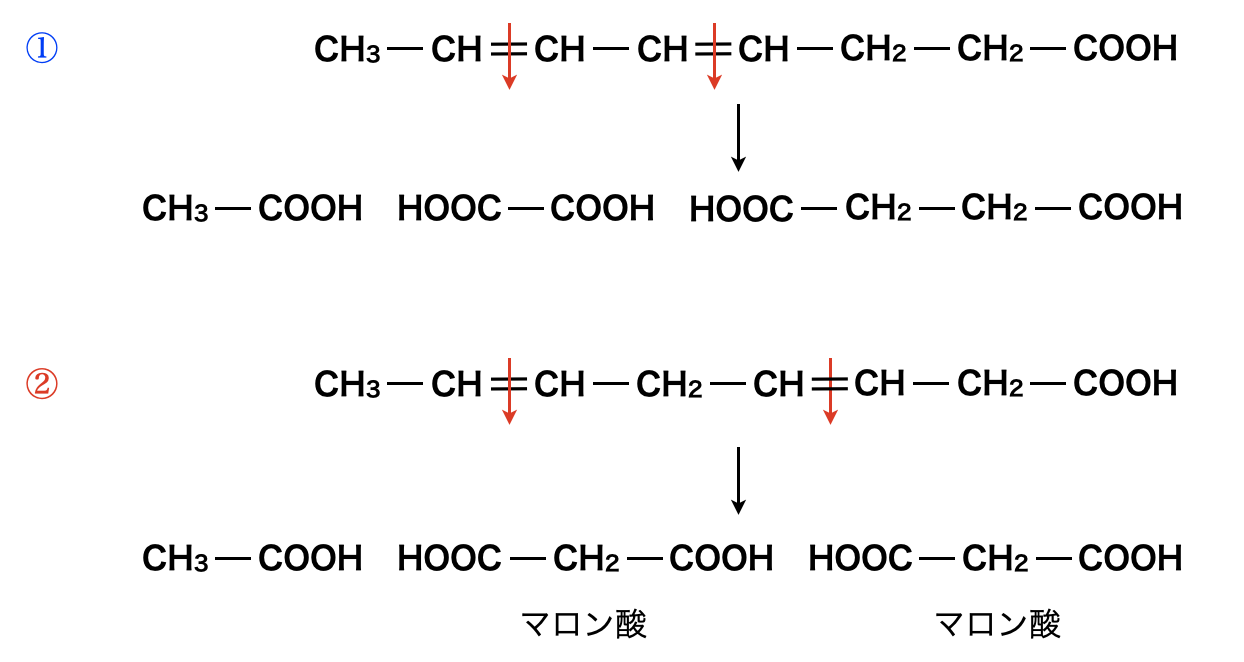
この結果から答えは②の方であることがわかりますね!
今回のザイツェフ則については,こちらの記事で詳しく解説しています.

(\(\rm{b}\)):アミノ酸の電気泳動と等電点
(\(\rm{b}\))は\(\alpha-\)アミノ酸の電気泳動や等電点に関する問題です.
問\(3\):双性イオン
\(\alpha-\)アミノ酸を簡単に復習しておきましょう.
\(\alpha-\)アミノ酸は,\(1\)分子に\(\rm{-NH_2}\)と\(\rm{-COOH}\)が共に存在するので,溶液中では\(\rm{-NH_3^+}\)と\(\rm{-COO^-}\)に変化して存在しています.そして溶液の\(\rm{pH}\)が変化することで,このイオンも以下のように変化していきます.
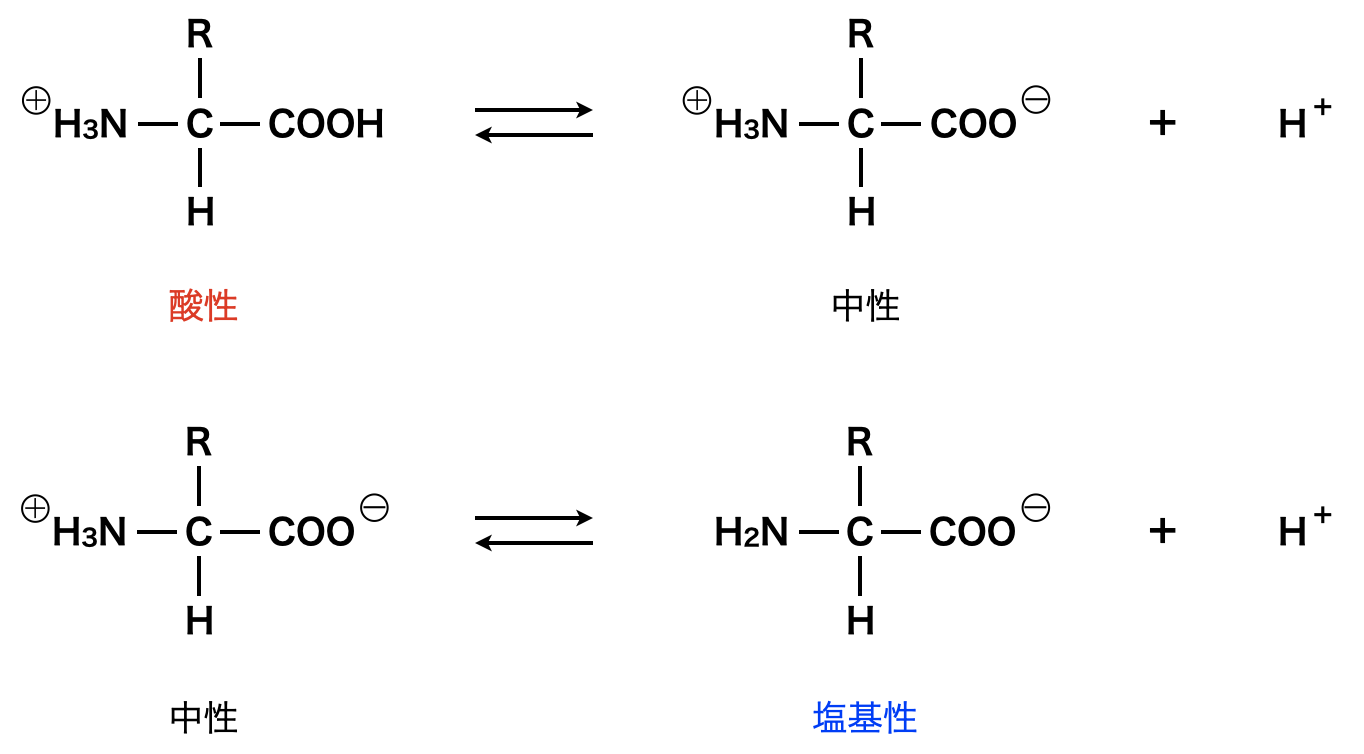
この中で,分子内にカチオン(陽イオン:\(\rm{-NH_3^+}\))とアニオン(陰イオン:\(\rm{-COO^-}\))が存在するイオンを一般的に双性イオンと呼びます.
双性イオンの詳細についてはこちらの記事をどうぞ!

問\(4\):電気泳動による分離
つづいて,電気泳動に関する問題です.
まずは等電点と電気泳動に関して復習です.
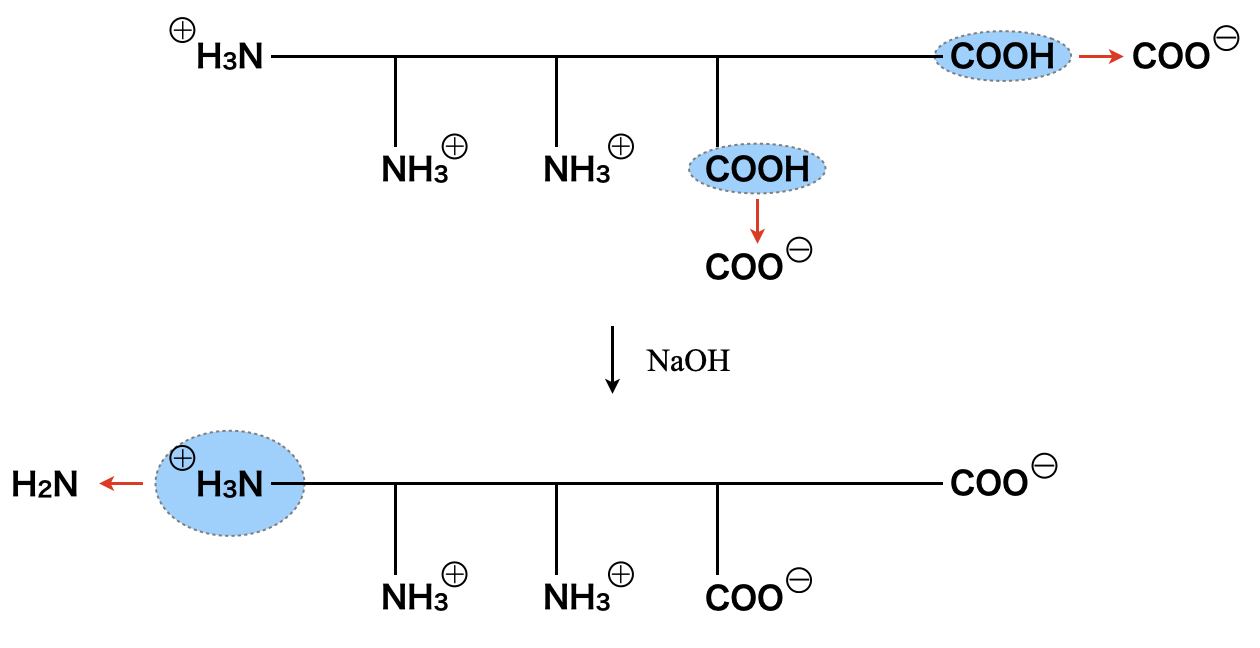
側鎖に\(\rm{-NH_2}\)が存在するアミノ酸を塩基性アミノ酸,\(\rm{-COOH}\)が存在するアミノ酸を酸性アミノ酸,どちらも存在しないものを中性アミノ酸といいます.そして,アミノ酸の電荷の総和が\(0\)となる\(\rm{pH}\)のことを等電点といいます.
等電点より\(\rm{pH}\)が小さいときはアミノ酸の電荷はプラス,大きいときはアミノ酸の電荷はマイナスとなります.これは下のような図で覚えておきましょう!
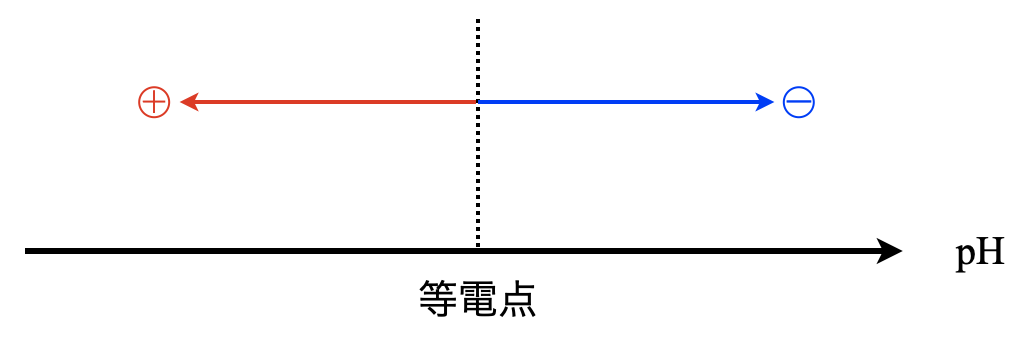
詳細についてはこちらの記事をどうぞ!

上のことを考えるだけでも各アミノ酸を分類することができます.
- 酸性アミノ酸:\(\rm{Glu}\)
- 中性アミノ酸:\(\rm{Ala}\),\(\rm{Ser}\),\(\rm{Asn}\)
- 塩基性アミノ酸:\(\rm{Lys}\)
先ほど説明した図を使いながら今回の問題を分析していきましょう.
酸性アミノ酸,中性アミノ酸,塩基性アミノ酸の一般的な等電点はそれぞれ,\(3\),\(6\),\(9\)となります.そしてそこに線を縦に引き,左側をプラス,右側をマイナスとします.そして今回問われている溶液の\(\rm{pH}\)が\(7\)なので,そこの領域を黄色で示しています.
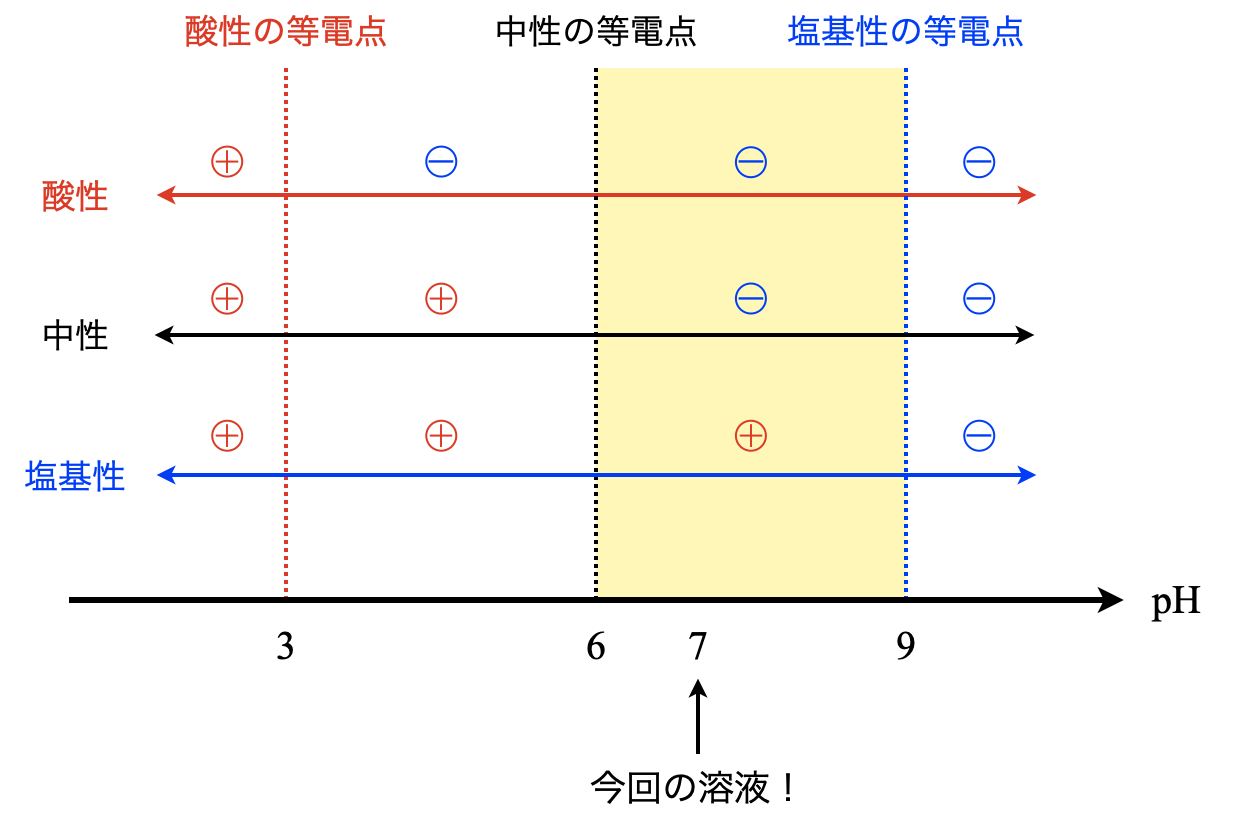
すると,黄色の領域では塩基性のアミノ酸のみが\(\rm{pH7}\)の溶液でプラスとなり,陰極側に移動したことがわかります.よって,陰極側に移動したのは,塩基性アミノ酸の\(\rm{Lys}\)(リシン)になります.
問\(5\):電気泳動による分離
次は,\(\rm{pH4}\)の溶液について考えます.
まず何の処理もせずに電気泳動を行うと下の図のようになり,酸性アミノ酸である\(\rm{Glu}\)のみがマイナスとなり,陽極側に移動します.これは先ほどと全く同じように考えることができますね!
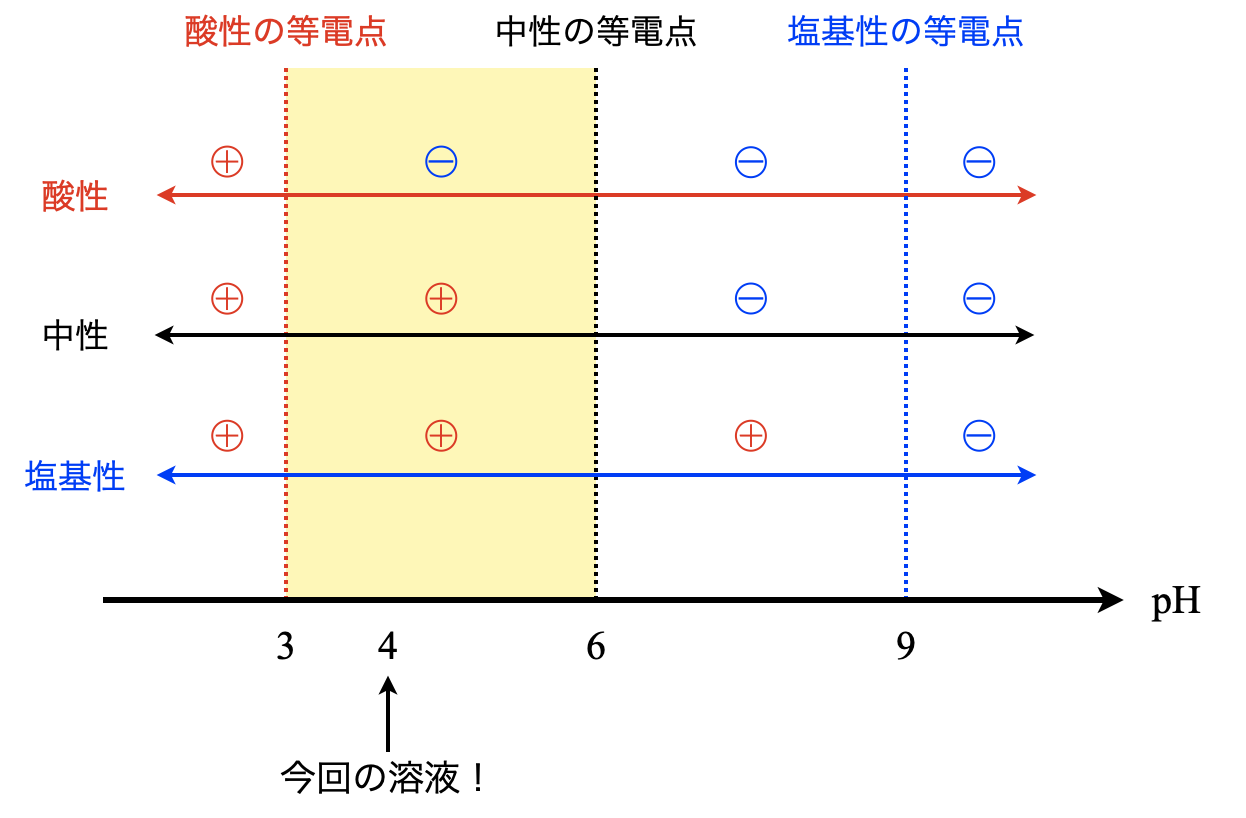
次に,強酸性条件下で電気泳動を行うと,\(2\)種類のアミノ酸が陽極側に移動したとあります.これは酸性アミノ酸である\(\rm{Glu}\)に加えて,他のアミノ酸が酸性アミノ酸に変化したとしか考えられます.すると,アスパラギン(\(\rm{Asn}\))の側鎖の\(\rm{-CONH_2}\)が以下の反応によって\(\rm{-COOH}\)に変化したと考えられます.\(\rm{-COOH}\)に変化したものをアスパラギン酸(\(\rm{Asp}\))といいます.
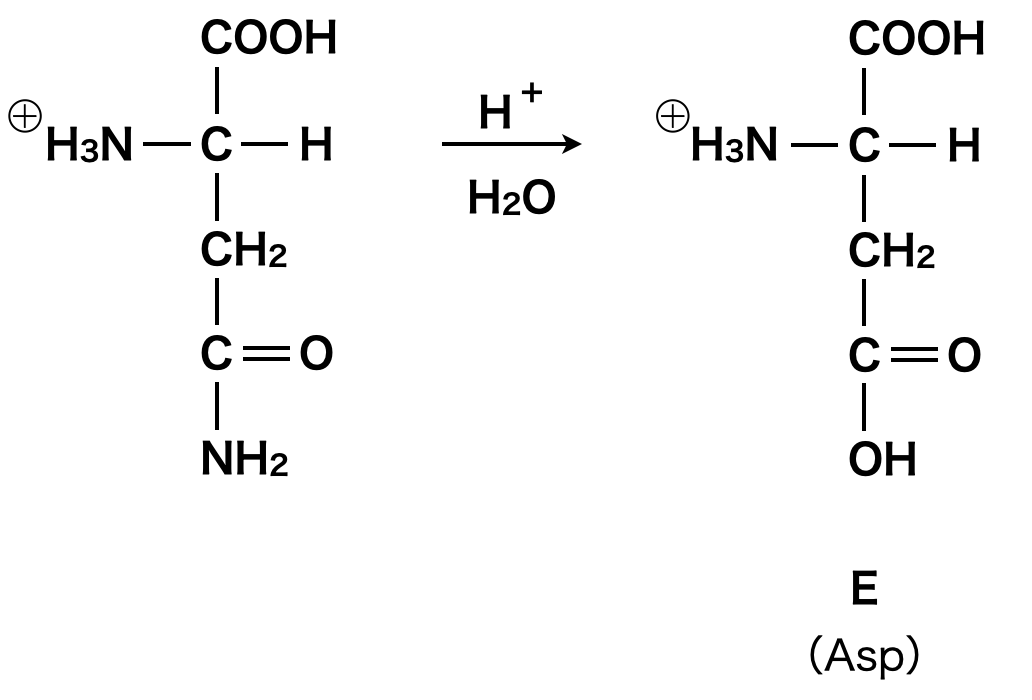
よって,アスパラギン酸(\(\rm{Asp}\))の酸性溶液の構造式は上のようにプラス電荷をもったものになります.
(\(\rm{c}\)):ポリペプチド
(\(\rm{c}\))は,ポリペプチドに関する等電点を考える問題です.
問6:ポリペプチドの官能基
ポリペプチドFの側鎖をアミノ基とカルボキシ基を意識しながら整理していきましょう.
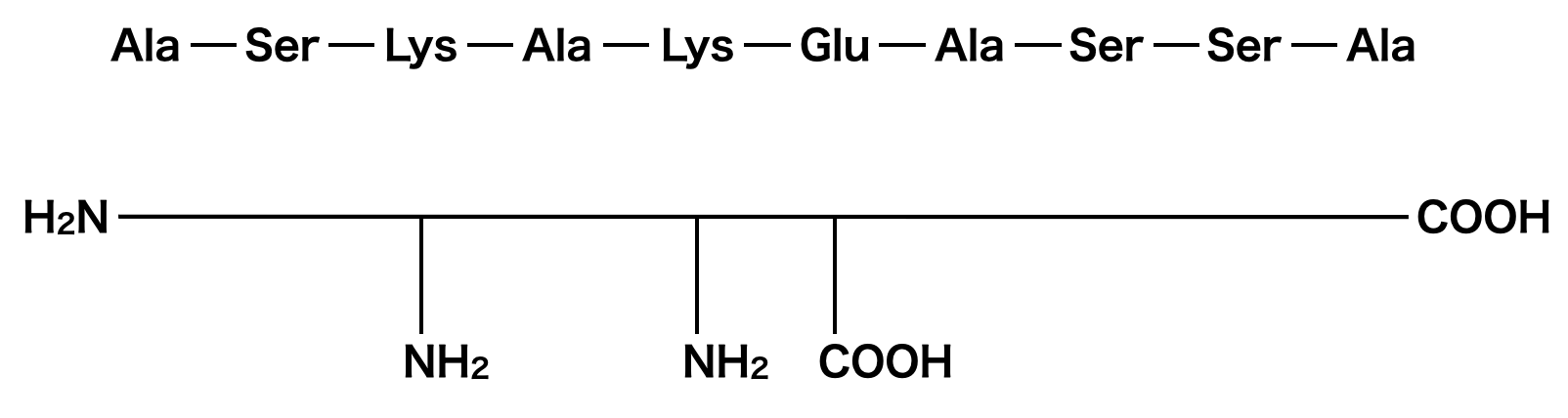
すると,側鎖にアミノ基が\(2\)コ,カルボキシ基が\(1\)コあることがわかります.
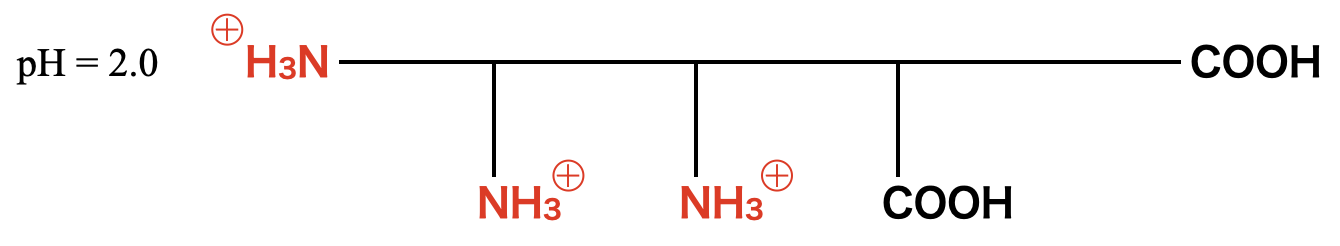
また,\(\rm{pH2.0}\)つまり酸性条件では,電荷はプラスとなるので,\(\rm{-NH_2→-NH_3^+}\)となります.
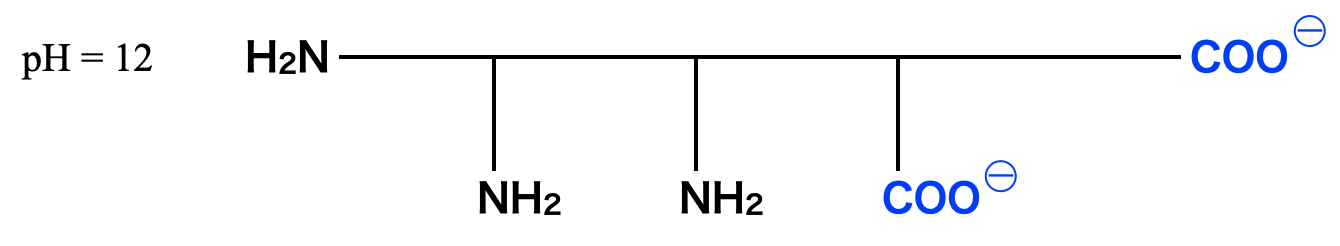
一方で\(\rm{pH12.0}\)つまり塩基性条件では,電荷はマイナスとなるので,\(\rm{-COOH→-COO^-}\)となります.
問\(7\):ポリペプチドの等電点
\(\rm{pH2.0}\)のポリペプチドFの状態から考えていきましょう.このときFは先程の問題から下のような構造になっているのでしたね!

これについている官能基\(\rm{NH_3^+}\)と\(\rm{COOH}\)が\(\rm{NaOH}\)を加えることで変化していき,最終的に電荷\(0\)の\(\rm{pH}\)を見つけるという問題です.ここで,グラフの横軸である\(\rm{[NaOH]/}\)[ポリペプチド]とは,ポリペプチドFに対して\(\rm{NaOH}\)をいくつ(何モル)反応させているのか?という意味になります.
まず,\(\rm{pH2.0}\)のときに\(\rm{NaOH}\)を反応させていくと,\(\rm{-COOH→-COO^-}\)へと先に変化していきます.\(\rm{[NaOH]/}\)[ポリペプチド] \(= 2\)のとき,全体での電荷は\(+1\)となります.
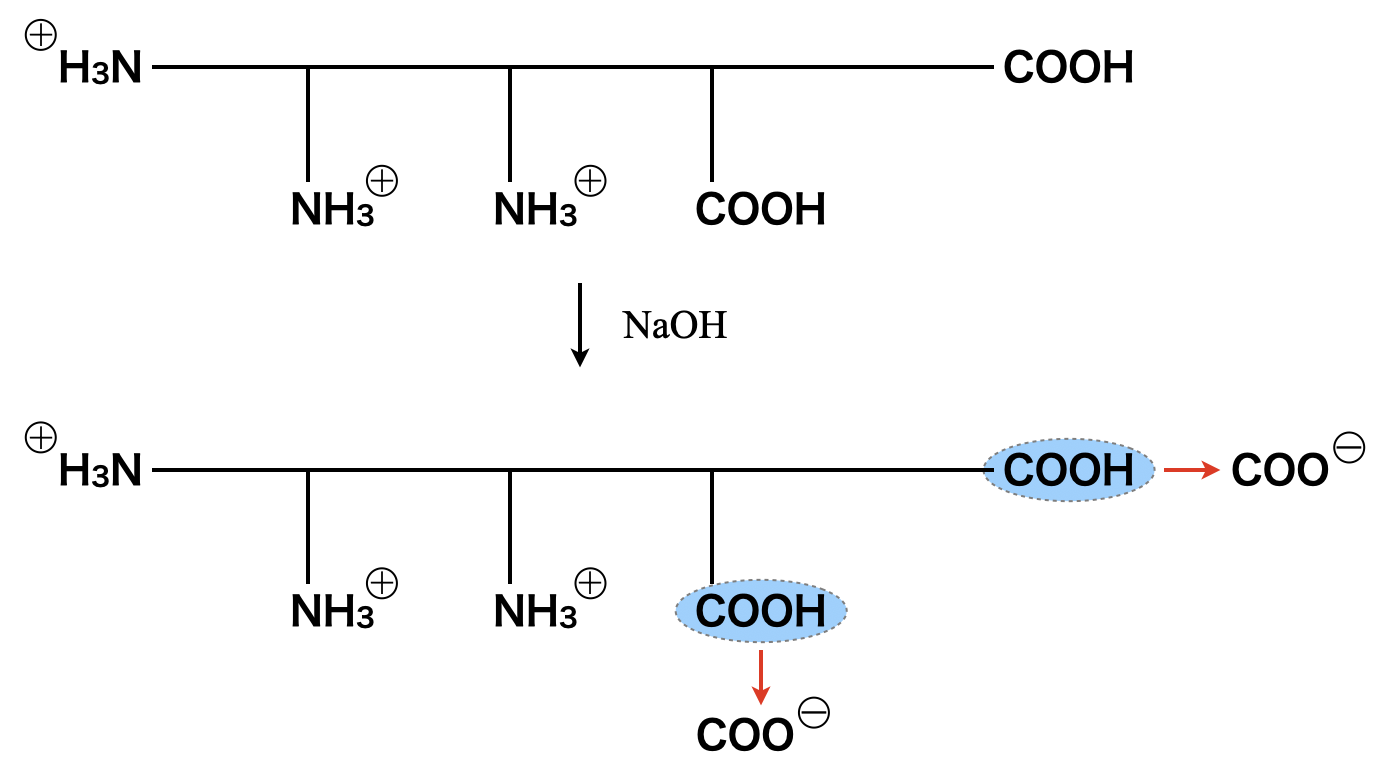
そしてこれにさらに\(1\)コ\(\rm{NaOH}\)を反応させることで,\(1\)つ\(\rm{-NH_3^+→-NH_2}\)へと変化し,全体の電荷が\(0\)となります.
このときの\(\rm{pH}\)をグラフから読み取ると,\(\rm{pH ≒ 9}\)となります.
この問題では,\(\rm{-COOH→-COO^-}\)と\(\rm{-NH_3^+→-NH_2}\)のどちらの反応が先に起こるのか?と考えた方もいるかもしれませんので,詳しく解説しておきます!
一般的なアミノ酸としてアラニン(\(\rm{Ala}\))を考えてみましょう.
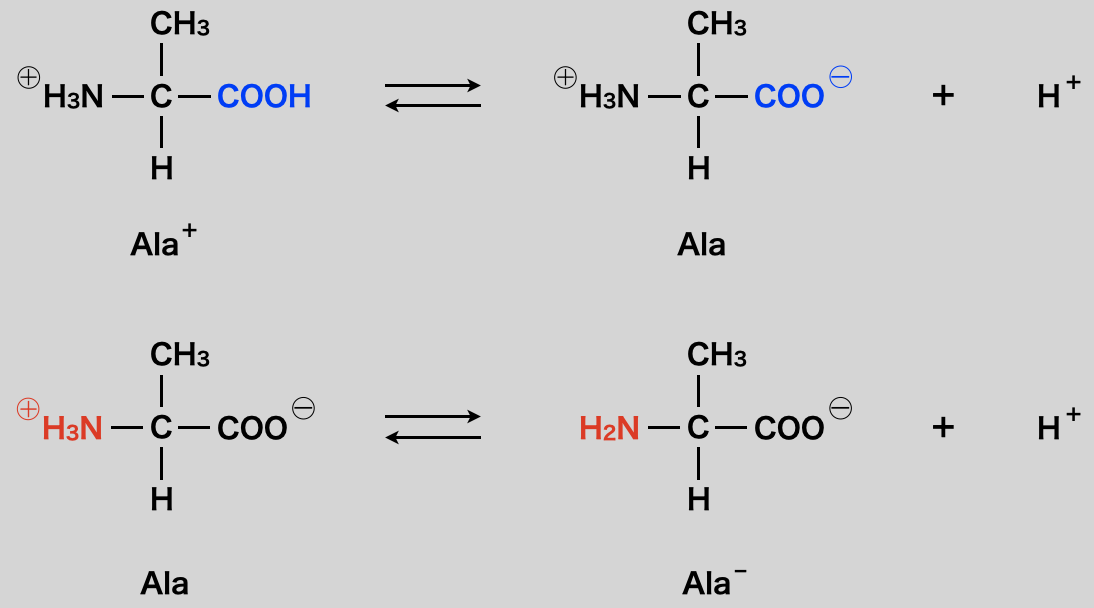
これはみなさん答えることができると思います.
この考え方を使うと,先に\(\rm{-COOH→-COO^-}\)となり,双性イオンを形成した後,\(\rm{-NH_3^+→-NH_2}\)へと変化します.そのため今回の反応においてもこの順序で\(\rm{NaOH}\)と反応していくと考えられます.
このように自分の知識をフル活用することで,未知の物質に遭遇したときでも自信をもって解答できるようになります.難しい問題をどんどん解くのはやめて,基礎知識の徹底を頑張っていきましょう.このサイトでは,今後も京大の過去問を通して,基礎知識をどのように京大攻略につなげていくのかを徹底解説していきますね!
最後に
最後まで閲覧していただきありがとうございました.
本記事の内容についてわからない点があれば,遠慮なく質問していただければと思います.
(\(\rm{Twitter}\):chem_story1)
京都大学の化学は難問が多いと言われますが,その分多くのことを学ぶことができます.
皆さんの学習の一助になれば幸いです.
今回の問題についてはこちらの参考書に載っています!もっていない方はぜひ自分の勉強のお供にしましょう!
- 題名:入試詳解25年 化学2019〜1995
- 出版社:駿台文庫
- 価格(税込):2,530円
- 特徴:化学の本質を掴むことのできるシリーズ

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/21495128.dd49cb47.21495129.e09ddf2d/?me_id=1294271&item_id=10035482&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fgakusan%2Fcabinet%2Fbook_image3%2F9784796123754.jpg%3F_ex%3D240x240&s=240x240&t=picttext)



コメント
コメント失礼いたします。
分かりやすいサイトの提供をありがとうございます。
問7のポリペプチドにNaOHを加える過程で、-NH₃⁺より、-COOHの方が早く反応するのはわかりました。
しかし、COOHとNaOHの反応の仕組みがいまいちわかりません。
①これは結局中和なのでしょうか。
②また、側鎖のCOOHと末端のCOOHは、同じように反応し、反応の優先順位はないのでしょうか。
③最後に、-H₃NとNaOHの反応は、弱塩基遊離の仕組みでしょうか。
④また、この場合も側鎖と末端の反応の優先順位はないのでしょうか。
多く質問してしまい申し訳ございませんが、もしよろしければ教えていただけますでしょうか。
コメントいただきありがとうございます!
①について
これは中和反応です.
この問題では,ペプチドに十分量の塩酸を加えて-+H3Nとし,この水溶液に対してNaOHの標準溶液を滴下していくことで,2価の弱酸のように2段階で中和されています.
+H3N-R-COOH → +H3N-R-COO− → H2N-R-COO−
②について
側鎖のCOOHは通常の弱酸性を示すので,よく見かける弱酸のpH滴定曲線のようになります.
一方で,主鎖のCOO–は反対に位置するNH3+で安定化されているので,通常のCOOHよりは電離しやすくなります.そのため,COOHの順番で考えると,
末端のCOOHの方が側鎖のCOOHより反応性は高くなります.
今回の問題では,まとめて考えても答えが出るため,詳細は記していませんでした.
③について
この反応では,NH3が単離しているわけではないので,弱塩基遊離とは考えない方がいいと思います!
④について
②と同様に考えることができますよ!
ただし,この問題ではそこまで理解していなくても解けるように問題設定されています!
もしわからない点があれば,コメントください!
ご丁寧な説明ありがとうございます。大変助かります。
最後に1点だけよろしいでしょうか。
最初問題を解いている時、
NaOHが-COOHの2つと反応することはわかりましたが、
さらにNaOHを加えると、次は何と反応するのか迷いました。
電荷を0にするためには、-NH₃⁺と反応するしかないのは分かりますが、反応する理由は何なのか気になりました。
ただ単に、アミノ酸の平衡があって、そこにOH⁻を加えることによる平衡の移動でしょうか。
H₃⁺N-R-COO⁻ + OH⁻ → NH₂-R-COO⁻ + H₂Oの方向に平衡が移動したということでしょうか。
コメントいただきありがとうございます!
アミノ酸を水に溶かすと,双性イオンは次のような平衡状態となります.
+H3N-R-COO− + H+ ⇄ +H3N-R-COOH
+H3N-R-COO− + OH− ⇄ H2N-R-COO− + H2O
今回疑問に思われているのは,下の反応についてだと思いますが,
この反応はアミノ酸がH+を放出することでH2Oが生成しています.
つまり,これは酸・塩基反応ということになります.
この状態で,溶液を塩基性にすると(つまり,OH−を過剰に加えると)
先ほどの平衡が右に大きく移動するので(これはル・シャトリエの原理です!),-NH3+が-NH2に変化するというわけです!
返信が遅くなってしまい,申し訳ありません.
疑問は解決したでしょうか?
返信ありがとうございます。大変助かりました。
また別の疑問が出てきましたので、再度質問よろしいでしょうか。
側鎖のCOOHより末端のCOOHの方が反応しやすい仕組みは理解できたのですが、
側鎖のNH₂と末端のNH₂の反応の優先順位も同じように考えると混乱してしまいます。
主鎖のCOO⁻は反対に位置するNH₃⁺で安定化されているので通常のCOOHより電離しやすくなる、ということは、主鎖COO⁻と主鎖NH₃⁺の形を作り早く安定化したいのだと考えました。
すると、リシンの双性イオンの構造が理解できません。
リシンの場合、主鎖はNH₂で側鎖がNH₃⁺となっています。
これはどのような仕組みなのでしょうか。
再度質問いただき,ありがとうございます!
今回はリシンの双性イオンの構造に関する質問ということでよろしいでしょうか?
塩基性アミノ酸であるリシン(Lys)はOHーを加えることで,以下のように変化していきます.
① COOH,NH3+ × 2
→ ② COOー,NH3+ × 2
→ ③ COOー,主鎖:NH2,側鎖:NH3+
→ ④ COOー,NH2 × 2
この中で,特に疑問を持たれているのは,③の変化だと思われます.
ここは,主鎖の-NH3+が-NH2へ変化することによって,より大きな安定性が得られるために,このような変化が起こります!
安定性
①-NH3+のときの構造を考えると,これは正四面体の構造を取ります.
ただし,H+が放出されると,-NH2は平面状の構造となります!
②COOーのO原子と-NH2のH原子が水素結合を形成します.
(側鎖の-NH2はCOOーと遠すぎて,水素結合を形成することはありません…)
以上の2点の理由により,この場合は特別に主鎖の-NH3+が先に-NH2へと変化します!
疑問は解決しましたでしょうか?
また何かわからない点があれば,遠慮なく質問お願いします!