今回のメニューです!
✅酸・塩基の強弱
✅酸・塩基の価数
物質の変化の中の「酸・塩基」について徹底解説していきます。
今回は「酸・塩基」の中でも非常に重要な強弱についてです。
酸・塩基の強さの違いによって反応式も異なってくるので、ここでマスターしてしまいましょう!
電離度
酸・塩基の強弱を考えるためには、この電離度という考え方が重要です。
水に溶かした酸・塩基の物質量に対して、電離している酸・塩基の物質量の割合を電離度といいます。
一般に、電離度は\(\alpha\)と表すことが多いです。
電離度\(\ \alpha = \large \frac{電離している酸 \cdot 塩基の物質量}{水に溶かした酸 \cdot 塩基の物質量}\)電離度とは割合なので、\(\alpha\)の範囲は、\(0 ≦ \alpha ≦ 1\)です。
それでは、もう少しわかりやすくするために、イメージ図を書きながら解説していきましょう。
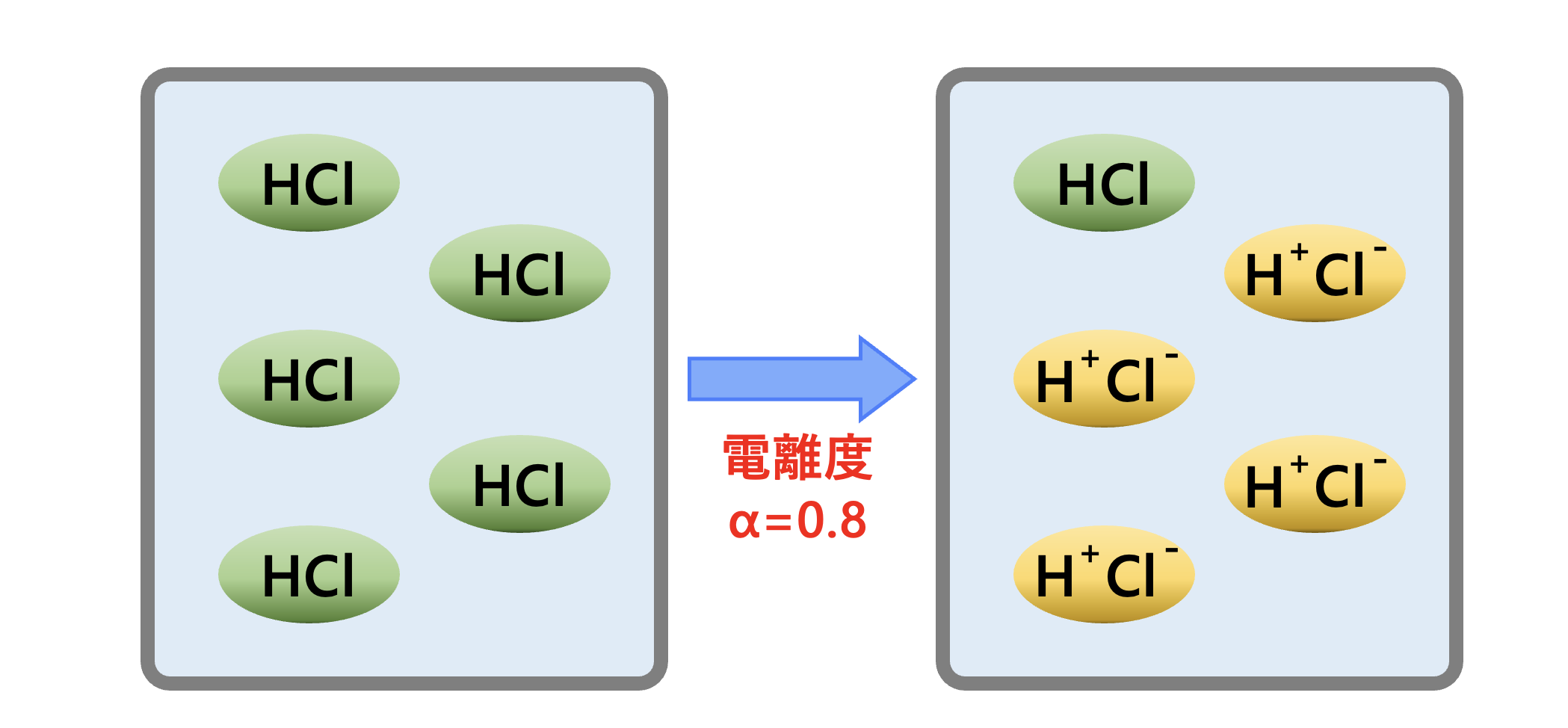
つまり、水の中に入れた酸の物質量の中で、陽イオンと陰イオンに分離している(つまり、電離している)割合を電離度というわけです。
酸の強弱
それでは、次に酸の強弱について学んでいきましょう。
酸の強弱を理解できれば、塩基の強弱もまったく同じように考えることができますので、酸の強弱をしっかりと理解していきましょう。
強弱というのは、電離度の強さによって決定されます。
| 電離度 | |
| 強酸・強塩基 | \(1\)に近い |
| 弱酸・弱塩基 | \(1\)に比べて極小 |
強酸
強酸とは、電離度が\(1\)に近い酸のことです。
強酸の例として、塩化水素\(\rm{HCl}\)を見てみましょう。
\(\rm{HCl → H^+ + Cl^-}\)
つまりこれは、水溶液中に塩化水素\(\rm{HCl}\)を溶かすと、ほぼ\(\rm{H^+}\)と\(\rm{Cl^-}\)に分離するということです。
弱酸
一方で、弱酸とは、電離度が\(1\)に比べて極端に小さい酸のことをいいます。
弱酸の例として、酢酸\(\rm{CH_3COOH}\)を考えてみましょう。
\(\rm{CH_3COOH ⇄ CH_3COO^- + H^+}\)
電離度がかなり小さいので、水溶液中ではごく一部しか電離しません。
酸・塩基の分類
酸・塩基の価数
酸・塩基\(1\)分子が電離して放出する水素イオン\(\rm{H^+}\)の数を酸・塩基の価数といいます。
これ具体例を考えてみましょう。
\(1\)価の酸
\(\rm{CH_3COOH ⇄ CH_3COO^- + H^+}\)
酢酸\(\rm{CH_3COOH}\)は電離すると、水素イオン\(\rm{H^+}\)を\(1\)つ放出するので、\(1\)価の酸と判断できます。
\(2\)価の酸
\(\rm{H_2SO_4 ⇄ H^+ + {HSO_4}^-}\)
\(\rm{{HSO_4}^- ⇄ H^+ + {SO_4}^{2-}}\)
硫酸の電離は非常に大事なので、少し詳しく解説しておきましょう。
硫酸\(\rm{H_2SO_4}\)は次に説明しますが、強酸です。
なので、電離しやすく最初の電離は簡単に起こります。(\(\rm{H_2SO_4 ↔︎ H^+ + {HSO_4}^-}\))
しかし、\(2\)段目の電離では、\(\rm{{HSO_4}^-}\)という陰イオンから\(\rm{H^+}\)を放出しています。
\(\rm{{HSO_4}^-}\)と\(\rm{H^+}\)には静電気的引力が働くので、\(1\)段目の電離よりは起こりにくくなります。
このように\(\rm{H^+}\)が\(1\)つずつ放出される電離を、多段階電離といいます。
この後で、それぞれの電離した物質の濃度を計算するような問題も出てくるので、一緒に頑張っていきましょう!
ここで\(1\)つ注意点があります。
「酸・塩基の価数と酸・塩基の強弱はまったく関係ない」
ということです。
\(1\)価の強酸もあれば、\(3\)価の弱酸もあるので、ここは混同しないようにしてくださいね。
酸・塩基の例
それでは最後に、酸・塩基を価数と強弱でまとめておきましょう。
酸・塩基の強弱は覚えるしかないので、\(1\)つずつしっかりと覚えていきましょう!
酸
| 強塩基 | 弱塩基 | |
| \(1\)価 | 塩酸 \(\rm{HCl}\)、硝酸 \(\rm{HNO_3}\) | 酢酸 \(\rm{CH_3COOH}\) |
| \(2\)価 | 硫酸 \(\rm{H_2SO_4}\) | 炭酸 \(\rm{H_2CO_3}\)、硫化水素 \(\rm{H_2S}\) |
| \(3\)価 | リン酸 \(\rm{H_3PO_4}\) |
塩基
| 強塩基 | 弱塩基 | |
| \(1\)価 | 水酸化ナトリウム \(\rm{NaOH}\)、 水酸化カリウム \(\rm{KOH}\) |
アンモニア \(\rm{NH_3}\) |
| \(2\)価 | 水酸化カルシウム \(\rm{Ca(OH)_2}\)、 水酸化バリウム \(\rm{Ba(OH)_2}\) |
水酸化マグネシウム \(\rm{Mg(OH)_2}\)、 水酸化銅 \(\rm{Cu(OH)_2}\) |
| \(3\)価 | 水酸化アルミニウム \(\rm{Al(OH)_3}\)、 水酸化鉄 \(\rm{Fe(OH)_3}\) |



コメント