前回は,逆滴定の中でよく出てくる物質としてNH3について解説しました.
まだ読んでいない方はこちら(逆滴定(NH3編))もぜひ読んでみてください.
今回はCO2の逆滴定について解説していきます.
安心して最後までついてきてくださいね.
それでは今日も頑張っていきましょう!
CO2の逆滴定(解説編)
\(\rm{CO_2}\)の逆滴定は\(\rm{NH_3}\)と比較して非常に複雑で難しいです.
しかし一歩ずつしっかりと解説するので,最後まで諦めずについてきてください!
まず,\(\rm{CO_2}\)も水には完全に溶解しません.
なので,\(\rm{NH_3}\)と同様に強塩基で中和反応させ塩にして滴定していきます.
今回は1価の強塩基である\(\rm{NaOH}\)で考えていきます.
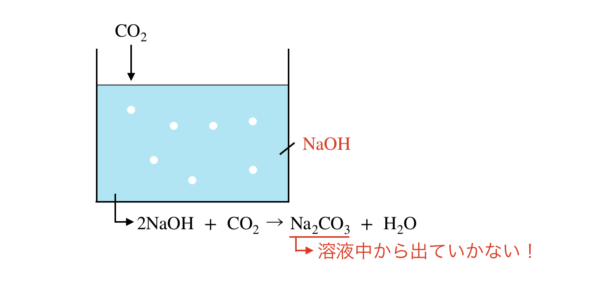
この溶液の中では,以下の反応が起こります.
2NaOH + CO2 → Na2CO3 + H2O
この反応で\(\rm{CO_2}\)が\(\rm{Na_2CO_3}\)に変化し,この\(\rm{Na_2CO_3}\)が溶液中から放出しないので,
中和滴定を行うことで\(\rm{CO_2}\)の量を正確に測定できるということです.
この溶液には過剰に\(\rm{NaOH}\)が存在するので,\(\rm{NaOH+Na_2CO_3}\)溶液となっています.
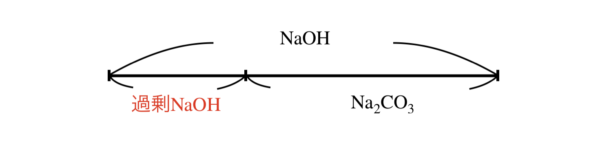
ここからは\(\rm{Na_2CO_3}\)溶液の滴定を学習した後,\(\rm{NaOH+Na_2CO_3}\)溶液の滴定を考えていきます.
Na2CO3溶液のHClによる滴定
\(\rm{CO_3^{2-}}\)と\(\rm{H^+}\)の反応機構は以下のようになります.
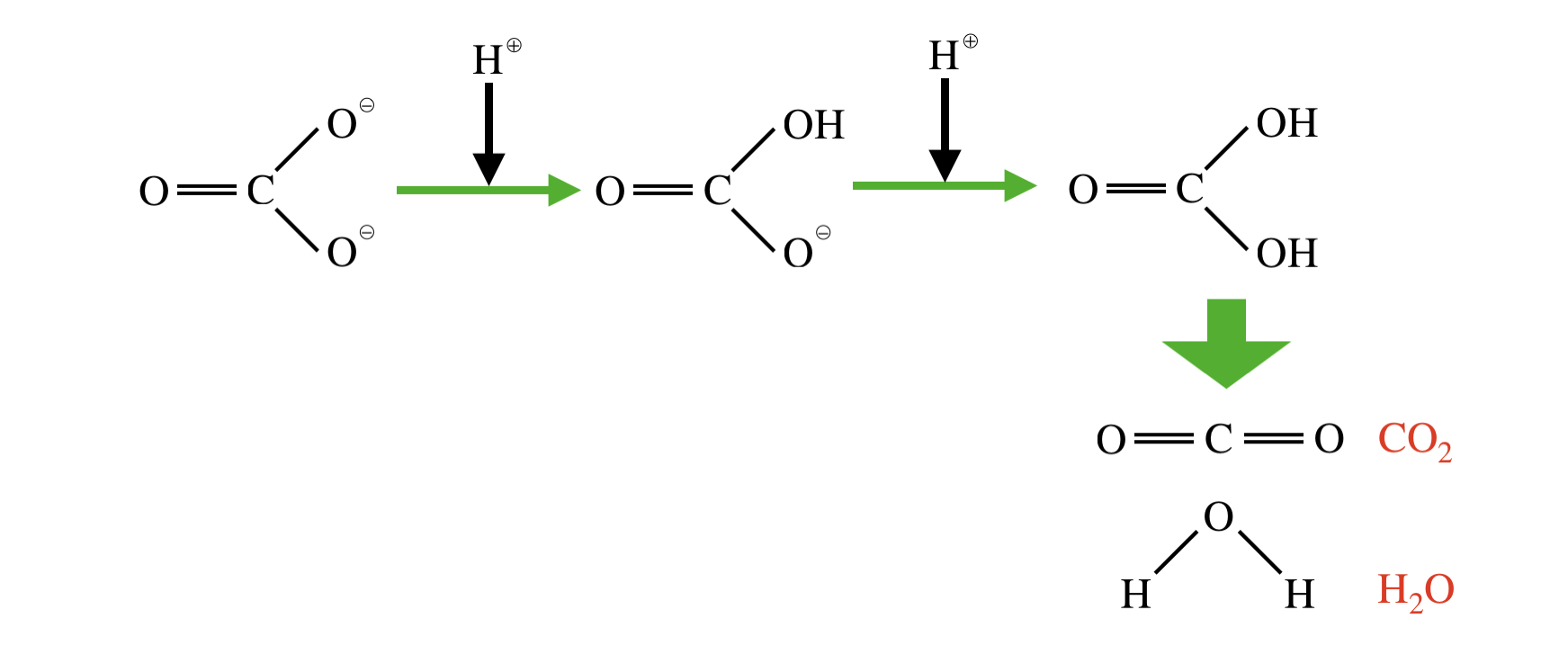
CO32- + H+ → HCO3–
HCO3– + H+ → H2CO3 → CO2 + H2O
この反応ではまず\(\rm{CO_3^{2-}}\)が\(\rm{H^+}\)と反応し,その後\(\rm{HCO_3^-}\)と\(\rm{H^+}\)が反応します.
このように順番で\(2\)段階電離することがポイントです!
これは,\(\rm{CO_3^{2-}}\)の\(1\)つ目の\(\rm{H^+}\)を受け取る能力が\(2\)つ目の\(\rm{H^+}\)を受け取る能力よりはるかに大きいからです.
そのため,1段目の反応が完全に完了してから,2段目の反応が始まると考えてOKです!
すると,滴定曲線は次のようになります.
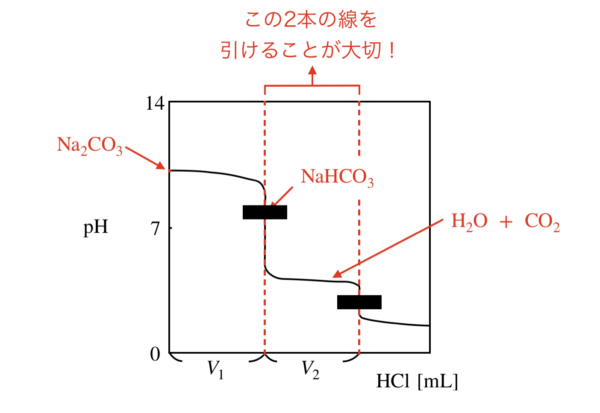
まず,\(\rm{HCl}\)の滴下量が\(0\ \rm{mL}\)のときは\(\rm{Na_2CO_3}\)溶液であるため,塩基性を示しています.
その後,\(\rm{HCl}\)を加えていくと,塩の加水分解が進み,\(\rm{NaHCO_3}\)溶液となります.
ここで用いる\(\rm{pH}\)指示薬がフェノールフタレイン溶液(\(\rm{PP}\))となります.
色の変化は,赤→無色となりますね.
フェノールフタレイン溶液(\(\rm{PP}\))が赤から無色に変化することで,1段階電離が終了したことがわかります.
その後,さらに\(\rm{HCl}\)を加えていくと,\(\rm{HCO_3^-}\)が\(\rm{H_2CO_3}\)となり,\(\rm{H_2O+CO_2}\)となります.
ここで用いる\(\rm{pH}\)指示薬がメチルオレンジ(\(\rm{MO}\))となります.
色の変化は,黄→赤となりますね.
メチルオレンジ(\(\rm{MO}\))が黄から赤に変化することで,2段階電離が終了したことがわかります.
\(\rm{pH}\)指示薬の色の変化がまだ覚えられていない方は,こちらの記事(中和滴定とpH指示薬)を参考にしてください!
すぐに覚えられますよ!
ここで,1段階電離と2段階電離での\(\rm{H^+}\)のモル比が等しく\(1 : 1\)になっています.
そのため,
滴定曲線で\(V_1 = V_2\)となります.
ここが非常に大切な部分で,次の\(\rm{NaOH}+\rm{Na_2CO_3}\)溶液でも重要になってきます.
その後\(V_1\ =\ V_2\)を使って,それぞれの滴定に要した\(\rm{HCl}\)の量を求めることができます!
NaOH + Na2CO3溶液のHClによる滴定
これは\(\rm{CO_2}\)を中和して吸収させた後,まだ\(\rm{NaOH}\)が残存しているというパターンです.
この溶液の考え方のポイントは,\(\rm{NaOH}\)が消費されてから,\(\rm{Na_2CO_3}\)の反応が起こるということです.
ここで,\(\rm{Na_2CO_3}\)の反応は先程上の節で見たことと全く同じ反応となります.
では,一連の反応を見ていきましょう!
NaOH + HCl → NaCl + H2O
Na2CO3 + HCl → NaHCO3 + NaCl
NaHCO3 + HCl → NaCl + H2O + CO2
この反応の滴定曲線を考えると下のようになります.
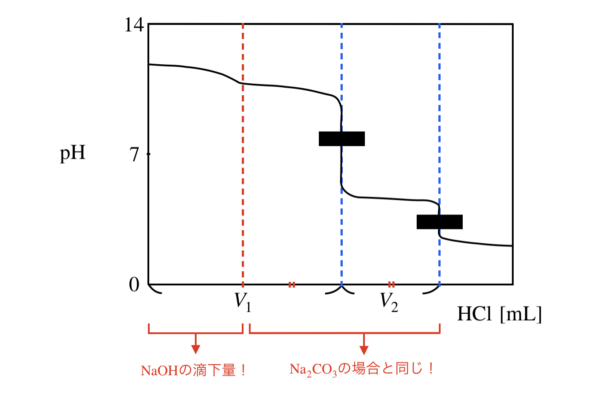
この反応の問題点は,\(\rm{NaOH}+\rm{HCl}\)の中和反応が完了しても\(\rm{pH}\)ジャンプがないため,\(\rm{NaOH}\)反応の終点がわからないという点です.
そのため,上の滴定曲線のように,\(\rm{Na_2CO_3}+\rm{HCl}\)の中和反応が始まる所に線を入れます!
この線を必ず入れられるようにしてください.
この線は\(\rm{Na_2CO_3}\)と\(\rm{NaHCO_3}\)が\(1 : 1\)であることより,わかります.
そして図の中で,\(V_1 – V_2\)が\(\rm{NaOH}\)の滴定で使用した\(\rm{HCl}\)の量であることがわかります.
解説編は以上となります.
\(\rm{NH_3}\)と比較してかなり難しかったと思います.
1度で理解しようとは思わずに,何度も見て少しずつ慣れていってください!
CO2の逆滴定(実践編)
それでは簡単な問題を解いていきましょう!
今回も丁寧に解説していくので,ついてきて下さいね!
\(1.0\ \rm{mol/L}\)の塩酸(\(\rm{HCl}\))で滴定すると,第1中和点までに加えた\(\rm{HCl}\)は\(8.0\ \rm{mL}\)となり,第2中和点までに加えた\(\rm{HCl}\)は\(3.0\ \rm{mL}\)となった.
この溶液に含まれている\(\rm{NaOH}\)のモル濃度は?
では,解説を始めていきましょう!
まずは,この問題の状態を滴定曲線として描けることが非常に大切です!
みなさんも答えを見る前に一度考えてみて下さい.
下のような図を描くことができましたか?
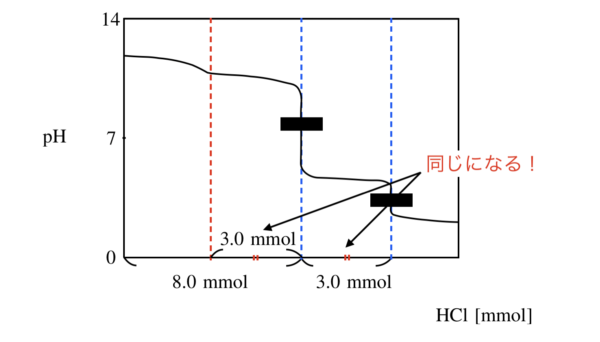
そうすると,\(x\ \rm{mmol}\)が\(\rm{NaOH}\)を中和した分の量であり,\(y\ \rm{mmol}\)が\(\rm{Na_2CO_3}\)を中和した分の量となります.
ここで,解説編より,\(y\ =\ 3\ \rm{mmol}\)となるので,\(x\ =\ 8 – 3\ =\ 5\ \rm{mmol}\)となります.
そのため,\(\rm{NaOH}\)は\(20\ \rm{mL}\)の溶液中に,\(5\ \rm{mmol}\)あるので,
\(\large \frac{5}{20} \small = 0.25\ \rm{mol/L}\)
となります.
今日は以上となります!
\(\rm{CO_2}\)の逆滴定は本当にややこしいので,本記事を何度も読み直して確実に得点できるようにしてみてください!
今日もお疲れ様でした!



コメント