
反応速度を変化させるときに,
何が関係しているのかをしっかりと理解しましょう!
今日も頑張っていきましょう!!
化学反応のしくみ
化学反応を理解するためには,反応速度,つまりどれくらいの速さでその反応が進行するのかを考えることが重要になります.
今回は,反応速度についてみていきましょう!
反応速度を決定する因子
まずは化学反応がどのように起こるのかをミクロな視点で見ていきましょう.

\(\rm{A}\)という物質と\(\rm{B}\)という物質があるとします.
反応が進行するためには,\(\rm{A}\)と\(\rm{B}\)が接近する必要があります.
つまり,「物質の出会いの回数」が大切だということです.
「物質の出会いの回数」とは「物質の衝突回数」と考えることができます!
ところで\(\rm{A}\)と\(\rm{B}\)が接近すると,\(\rm{A}\)と\(\rm{B}\)の間にゆるい結合ができ,不安定な状態となります.
エネルギー図では,不安定な状態は図の上の方に書くため,\(\rm{A}\)と\(\rm{B}\)はゆるい結合によって山を登るようなイメージになります.
この「不安定な状態」とは「エネルギーが高い状態」ということです!
この山の頂上までいくと,次は山を降ります.
ここの速度は非常に速く,一気に生成物へ向かう反応が起こります.
反応において,エネルギーが最も高い状態を「活性化状態」といいます.
\(\rm{A}\),\(\rm{B}\)という初期状態と活性化状態のエネルギーを「活性化エネルギー」といいます.
「つまり活性化状態を超えると,この反応は進行するということです!」
この山を越えるためには,物質が動き回る力が高い方が良いということになります.
この物質が動き回る力というのが「運動エネルギー」です.
「運動エネルギー>活性化エネルギー」のとき反応が進行します!
つまり運動エネルギーが大きい方がいいですし,活性化エネルギーが小さい方がよりよいことがわかります!
今までの説明を図で確認してみましょう!
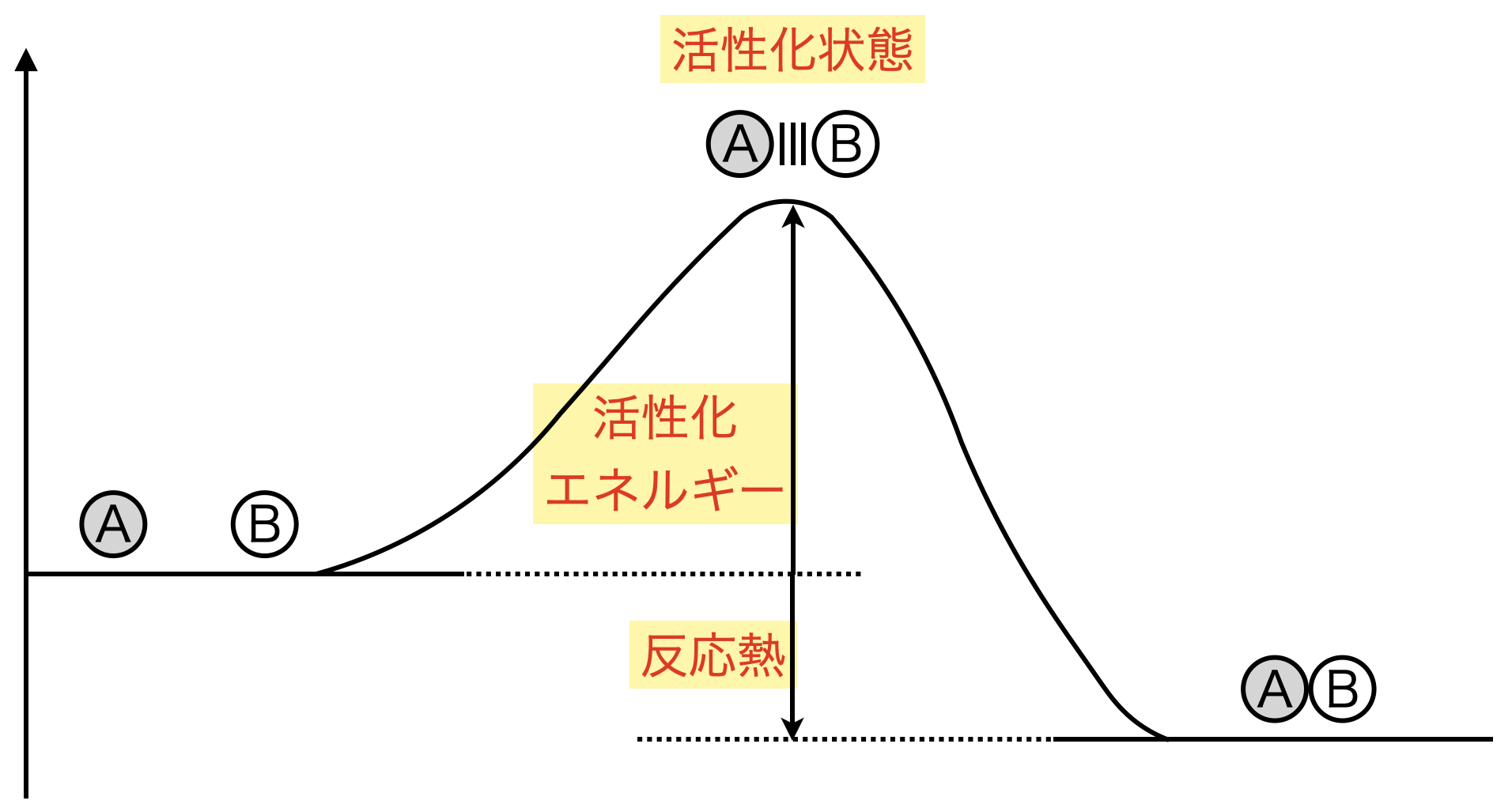
このように図でそれぞれの用語を覚え,それぞれの状態がどのようになっているかを説明できるようになっていることが大切です!
以上より,下のことがわかります!
反応速度を上げるための方法として,下の3つをしっかりと覚えておきましょう!
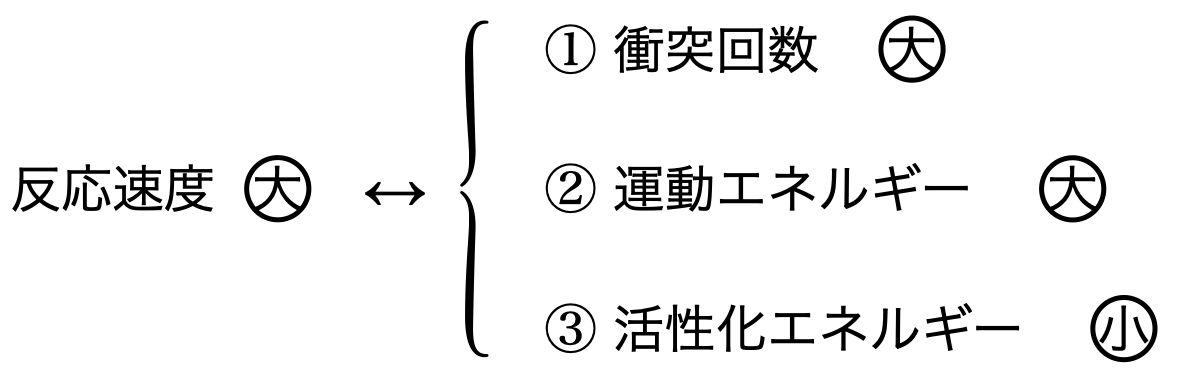
反応速度を上げる操作
先程の節で,反応速度を上げるためには,衝突回数・運動エネルギー・活性化エネルギーが重要であることがわかりました.
次に,それらを変化させるためには,具体的にどのような操作が必要であるのかを見ていきましょう!
衝突回数
粒子間の衝突は,粒子の数が多いほど多くなります.これはモル濃度(\(\rm{mol/L}\))で考えるとわかりやすいです.モル濃度が高くなるほど衝突回数は多くなります.
衝突回数 大 → 濃度 大
運動エネルギー
粒子の運動エネルギーの分布は一般的に下のようになります.そして運動エネルギーを全体的に増加させると,グラフが右に移動するようになります.
すると,活性化エネルギー\(E_{\rm{a}}\)を超えるエネルギーをもった粒子の割合が増加します.具体的には,熱を加えて,温度を上昇させます.
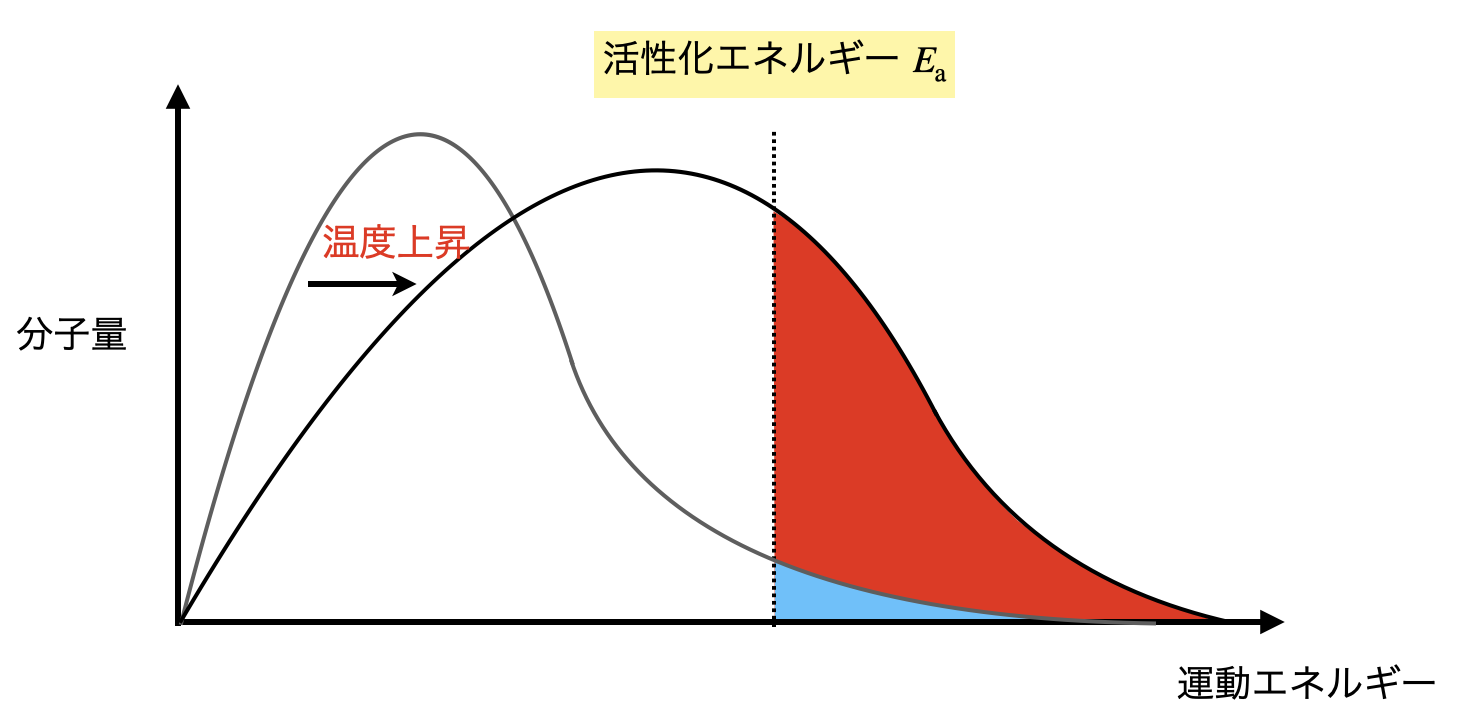
運動エネルギー 大 → 温度 大
活性化エネルギー
最後に活性化エネルギーについてみていきましょう.
活性化エネルギーを小さくするためには,触媒を加える必要があります.触媒を加えることで,活性化状態にある物質のエネルギーを低くすることができ,越えるべき山の高さがより低くなります.
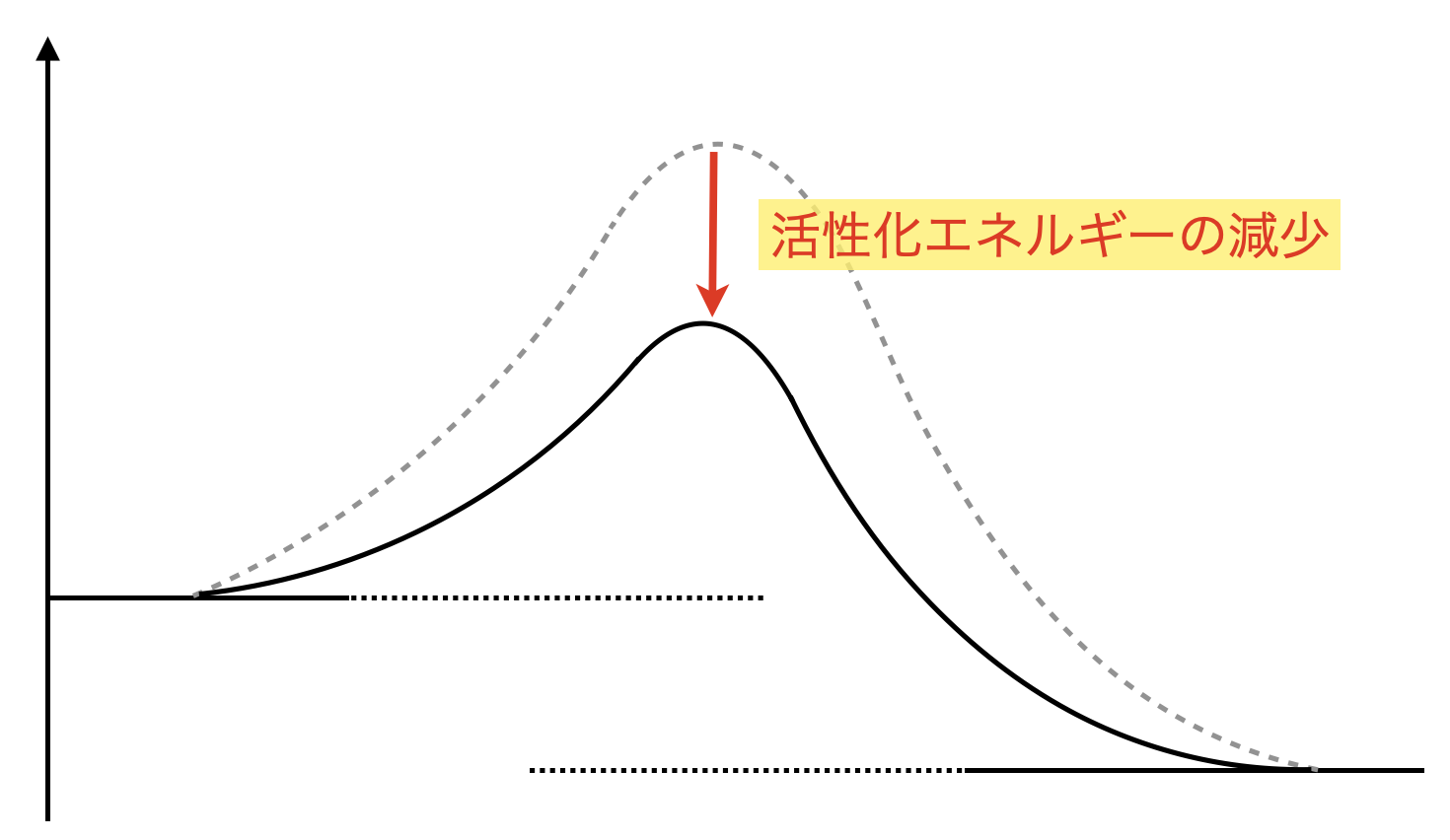
活性化エネルギー 小 → 触媒を加える



コメント