
- \(o\),\(p\)配向性の実践的な見分け方
- \(\rm{C}\)数による炭素骨格の決定
- 芳香族の分離方法
を特にポイントとしています.昨日の自分より少しでもレベルアップしていきましょう!
大問\(3\)の総評
こんにちは,\(\rm{KUT}\)です.
本記事では,\(2018\)年京大化学の大問\(3\)について解説していきます.
また解説に加えて,それぞれの問題で覚えておいてほしいポイントについて詳しく説明していきます.
京大の化学は難しいという印象が強い方が多いと思いますが,京大化学には難しい問題と標準問題の\(2\)つがあります.ここで,受験生が対策すべきことが\(2\)つあります.
\(1\)つ目は,標準問題を最後まで解き切る力を身につけることです.これにより,まずは平均点を取ることを目指します.
\(2\)つ目は,難しい問題と標準問題を見分けられる目を養うことです.試験本番は時間制限内に自分の解ける問題を解き切る必要があります.そのため,難しい問題は解かずに,標準問題をしっかりと選択していきながら,最後まで解いていくことが必要になります.
この記事では,問題を選択していく目を養うために,どのようにして判断していくのかということも自分なりに説明していきます.
それでは,\(2018\)年京大化学の大問\(3\)の解説に進んでいきましょう!
大問\(3\)
(\(\rm{a}\)):ベンゼン環の置換基効果
ベンゼン環の置換基による配向性については,こちらの記事で詳しく解説しています.今回の問題を解く際には,ぜひこちらを読んでから解き進めてみてください!

問\(1\):アミド化・ジアゾ化
トルエンの場合,ベンゼン環に置換されているアルキル基の\(\rm{C}\)が\(\rm{H}\)からひきつけた電子をベンゼン環の方へ流し込みます.これを「電子供与性」といいます.つまり,電子を供与\(=\)電子を与えるということです.すると,ベンゼン環中の電子が増加し,ベンゼン環にカチオンが攻撃します.このときベンゼン環に攻撃するカチオンは\(o\)-(オルト位),\(p\)-(パラ位)に置換しやすくなります.そのためトルエンは\(o\),\(p\)配向性であることがわかります.
これを踏まえた上で,A〜Jまでの流れを区切って見ていきましょう.
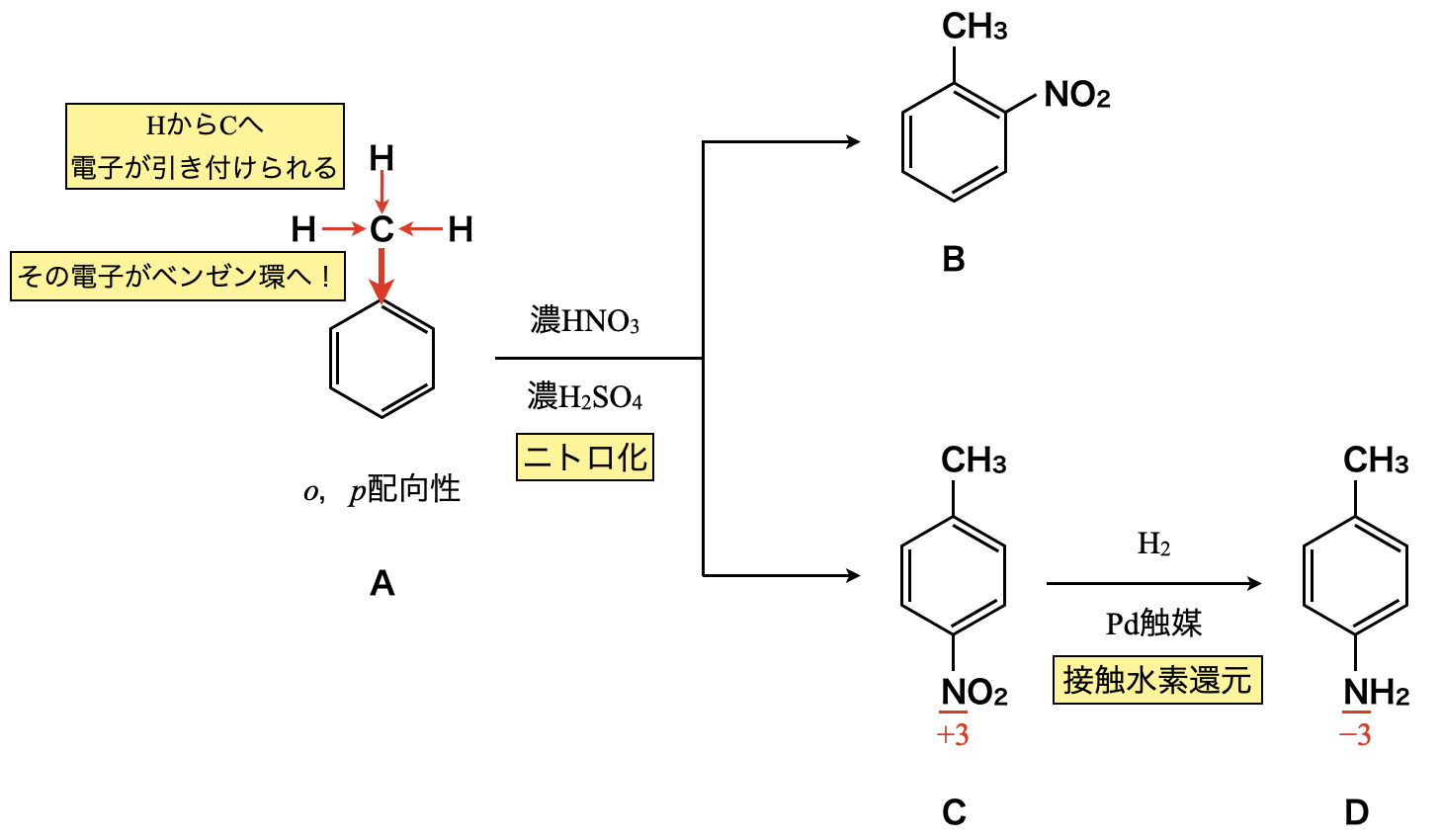
Aトルエンを濃\(\rm{HNO_3}\)と濃\(\rm{H_2SO_4}\)の混合物(混酸)と反応させることで,ニトロ化が起きます.このときトルエンの\(\rm{-CH_3}\)基は電子供与基であるため,\(\rm{-NO_2}\)は\(o\),\(p\)に置換されます.それぞれ\(o\)位に置換されたものがB,\(p\)位に置換されたものがCとなります.
Cについて\(\rm{Pd}\)触媒下で\(\rm{H_2}\)と反応させると,接触水素還元によって\(\rm{-NO_2}\)→\(\rm{-NH_2}\)へと還元されます.\(\rm{N}\)の酸化数を見ると,\(+3→-3\)とたしかに変化していますね.
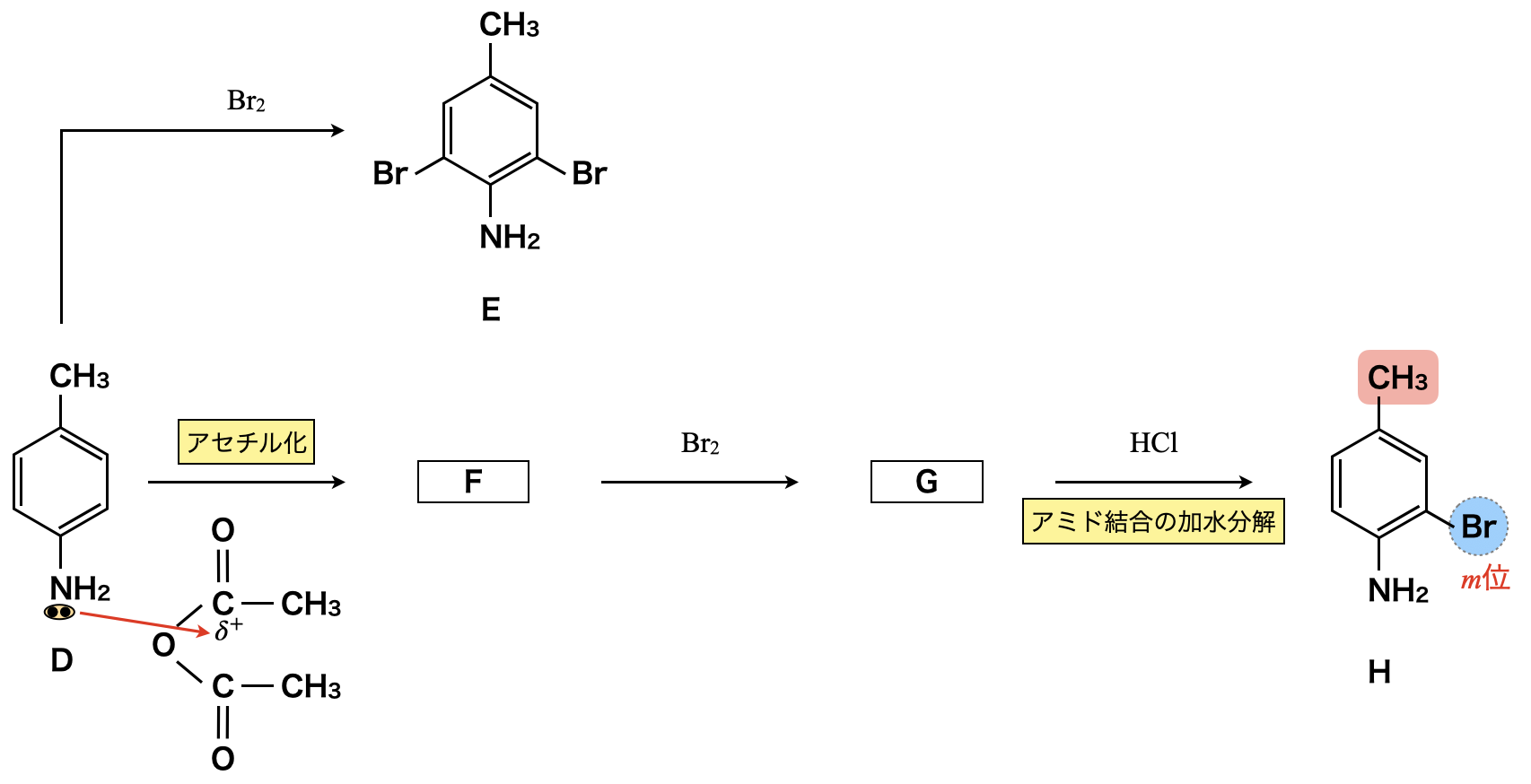
次に,アミノ基\(\rm{-NH_2}\)をもつDに無水酢酸\(\rm{(CH_3CO)_2O}\)を反応させると,「すきま」「うめます」の要領でアミノ基の\(\rm{N}\)原子のもつ非共有電子対が攻撃し,アミド化します.
ここでFとGについて構造を決定していきましょう.
- F:アミド結合あり
- G:\(\rm{CH_3}\)の\(m\)位に\(\rm{Br}\)(Hから推測),アミド結合あり
これらの条件から下のようにFとGの構造を決定できます.
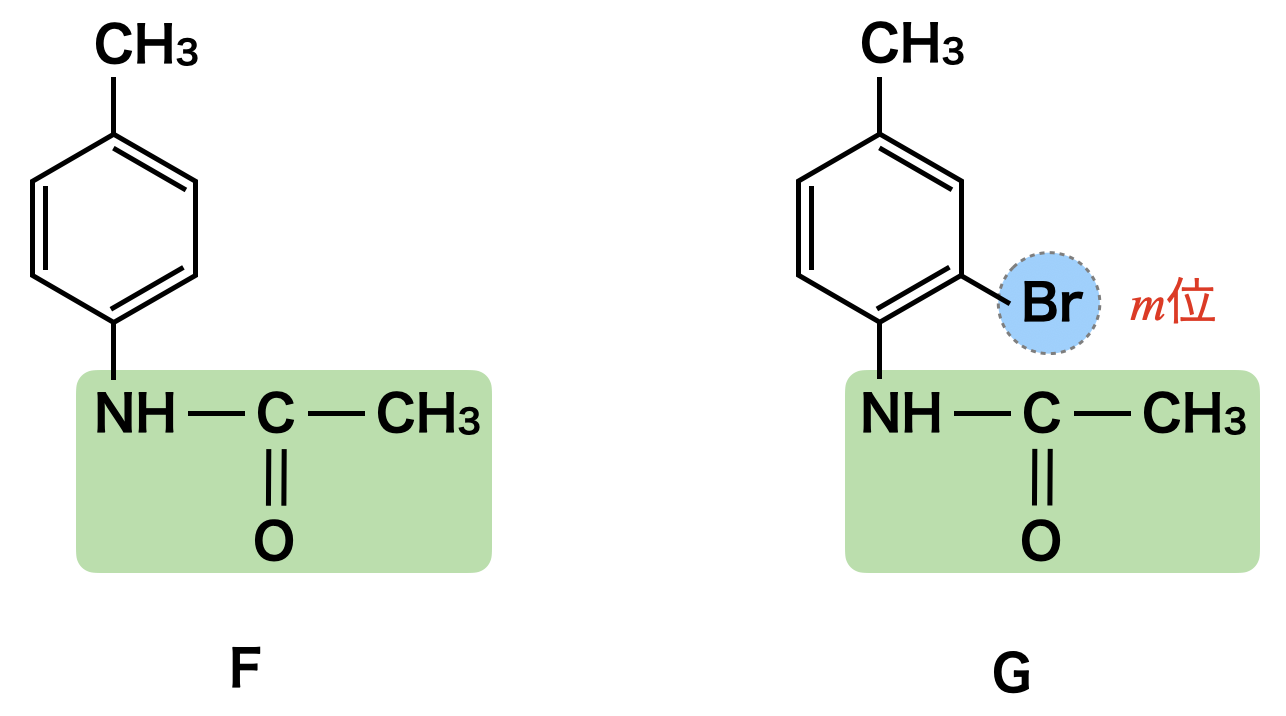
Fと\(\rm{Br_2}\)を反応させるとG→Hが生成しますが,Hに\(\rm{Br}\)基が\(\rm{-CH_3}\)の\(m\)位なので,Gにも同じように\(m\)位に置換されていると考えられます.Gに\(\rm{HCl}\)を加えるとアミド結合が加水分解され,Hが生成します.
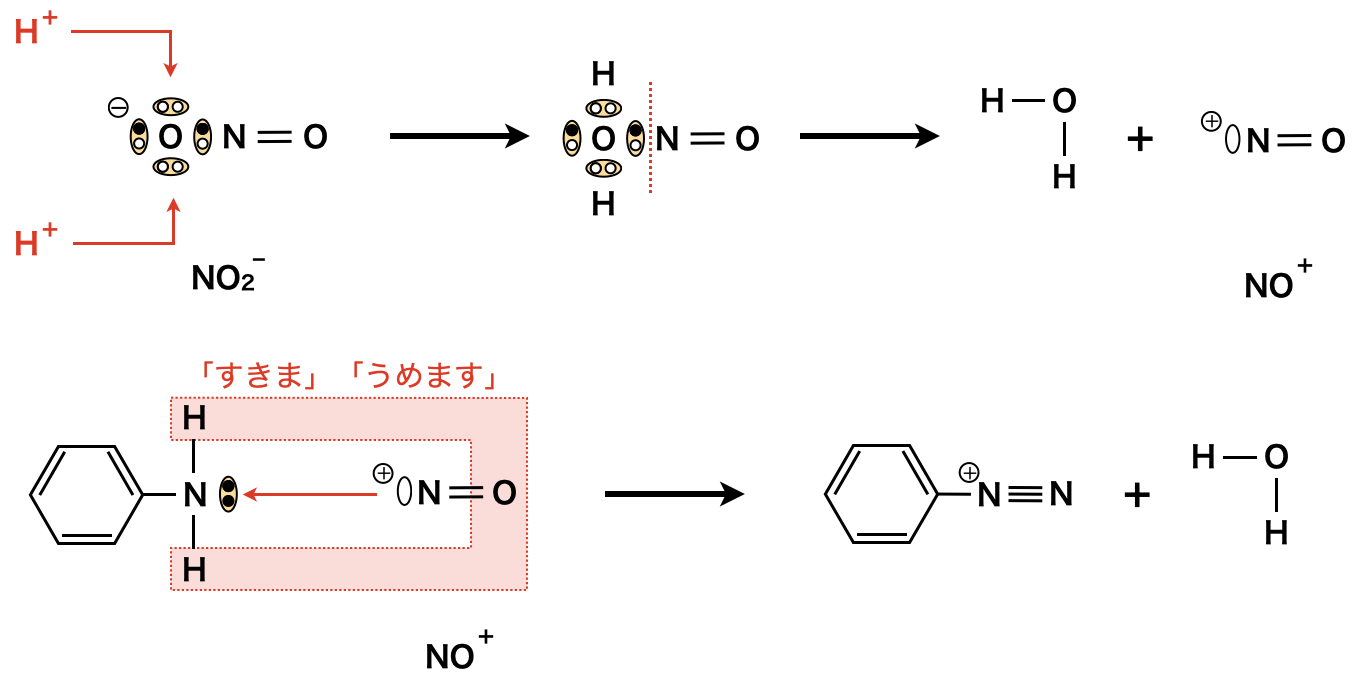
最後に,亜硝酸ナトリウム\(\rm{NaNO_2}\)をHに作用させると,ジアゾ化が起こります.
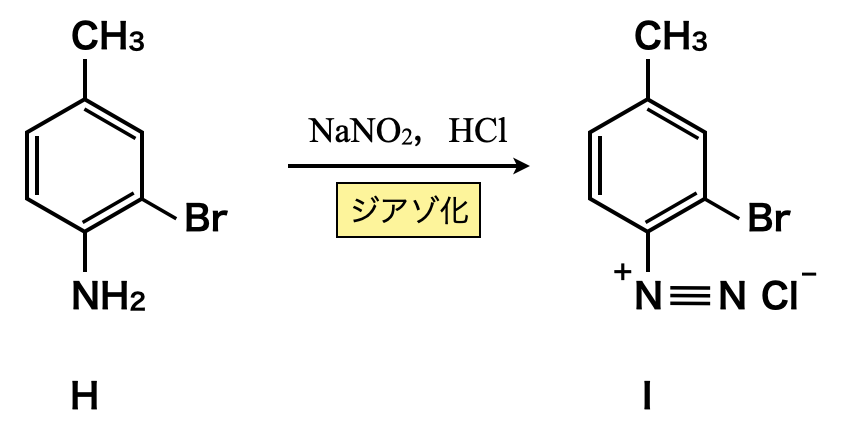
ジアゾ化についてもここでしっかりと復習しておきましょう.
亜硝酸ナトリウム(\(\rm{NaNO_2}\))に\(\rm{HCl}\)を加えると,亜硝酸イオン(\(\rm{NO_2^-}\))が生成します.この亜硝酸イオンに\(\rm{H^+}\)が攻撃してニトロ化において生成したのと同じように\(\rm{NO^+}\)が生成します.そして\(\rm{NO^+}\)イオンが毎度おなじみの「すきま」「うめます」の要領で攻撃し,\(\rm{H_2O}\)が脱離することで,ベンゼンジアゾニウムイオンが生成します.
問\(2\):電子的・立体的効果
まず,電子的な効果から考えていきます.
私が先ほど紹介した記事ではアルキル基の電子的効果については書いていましたが,-\(\rm{NH_2}\)基や-\(\rm{NHCOCH_3}\)基については紹介していません.そのため,これらの電子的効果を知っていた受験生はほとんどいなかったと思われます.この問題は基礎的な内容をおさえた上で,応用問題に適応する能力が大切です.一緒に考えていきましょう.
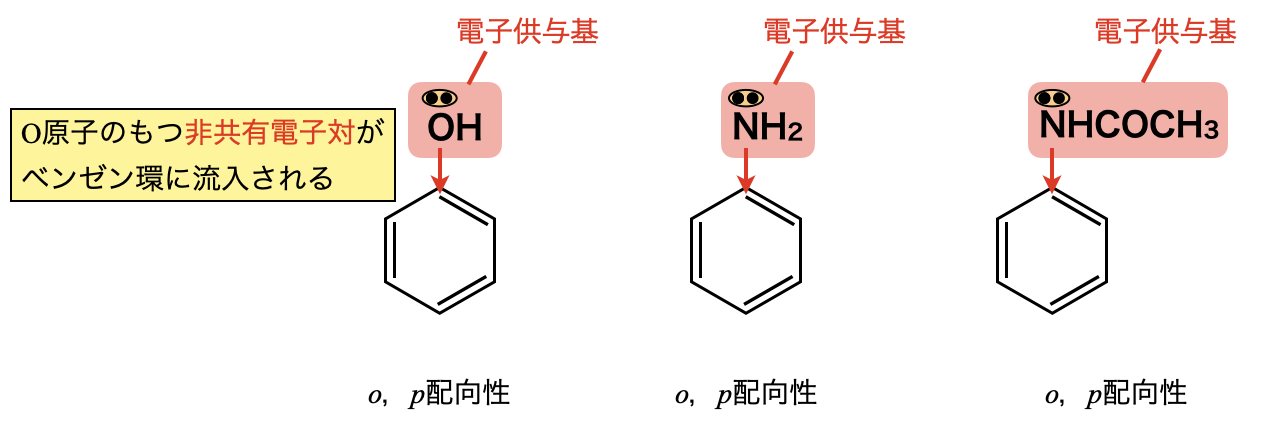
まずフェノールがトルエンなどと同じように電子供与基であることを知っておく必要があります.これは必須事項なので,必ず覚えておいてくださいね!
フェノールであれば,\(\rm{-OH}\)基の\(\rm{O}\)原子が非共有電子対をもっているので,これがベンゼン環に流入し,共鳴することで\(o\),\(p\)配向性となります.
今回の問題に当てはめて考えると,\(\rm{-NH_2}\)基や\(\rm{-NHCOCH_3}\)基にも同様に\(\rm{N}\)原子に非共有電子対があります.そのためともに\(o\),\(p\)配向性をもつことがわかります.\(\rm{-CH_3}\),\(\rm{-NH_2}\),\(\rm{-NHCOCH_3}\)はどれも\(o\),\(p\)配向性をもっており,その中からどの効果が大きいかを考えていく必要があります.
つまり,今回の問題は,
「\(\rm{-CH_3}\),\(\rm{-NH_2}\),\(\rm{-NHCOCH_3}\)について,電子的な効果の強さはどうなっているか?」
と捉えることができます.
ここで,EとGを比較してみましょう.
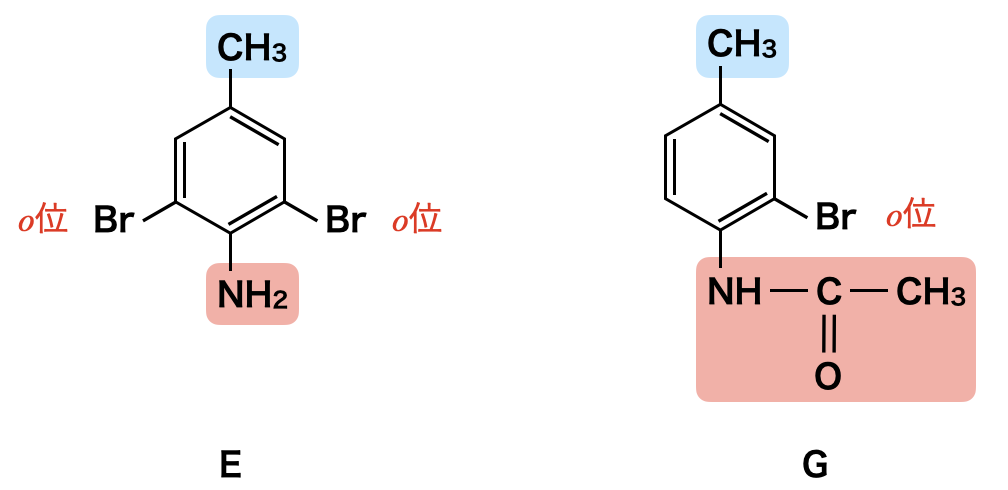
化合物Eを見ると,\(\rm{-NH_2}\)基からみて\(o\)位に\(\rm{Br}\)基が\(2\)つ置換されている一方で,化合物Gは,\(\rm{-NHCOCH_3}\)基からみて\(o\)位に\(\rm{-Br}\)基が\(1\)つ置換されています.つまり,\(\rm{-NH_2}\)と\(\rm{-NHCOCH_3}\)はどちらも\(\rm{-CH_3}\)より効果が大きい上に,\(\rm{-NH_2}\)と\(\rm{-NHCOCH_3}\)を比較すると,\(\rm{-NH_2}\)の方がより多く置換されているので,効果が大きいとわかります.
効果の大きさを並べると,
\(\rm{NH_2 > NHCOCH_3 > CH_3}\)
となります.これを文章としてまとめると,下のようになります.
アミノ基がアセチル化されると電子供与性が弱まり臭素化の速度が抑えられるが,メチル基よりは効果が大きい.
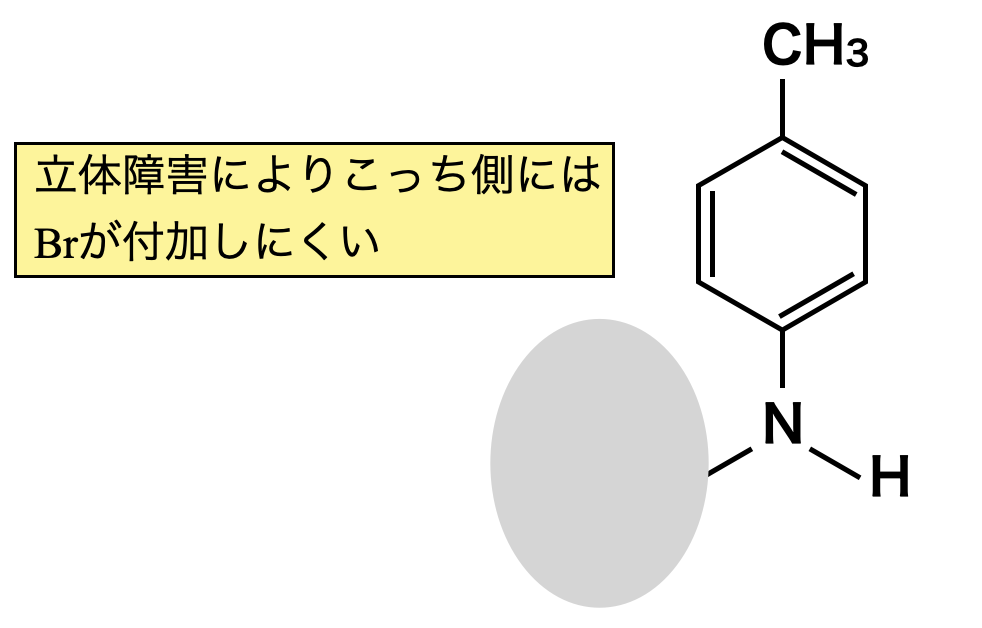
次に,立体的な効果について考えていきます.
Dの\(\rm{-NH_2}\)基がある場合には,\(2\)つ\(\rm{-Br}\)基が導入されていますが,\(\rm{-NHCOCH_3}\)基の場合は\(\rm{-Br}\)基が\(1\)つだけ導入されています.これは完全に\(\rm{-NH_2}\)と\(\rm{-NHCOCH_3}\)の違いであるとわかります.
この違いを立体的な点から考えると,\(\rm{-NHCOCH_3}\)の方が大きいことがわかります.つまり,\(\rm{-NHCOCH_3}\)の方が大きく立体的障害があるため,\(\rm{-Br}\)基はせいぜい\(1\)つしか置換されないというわけです.
(\(\rm{b}\)):推定力の養成
(\(\rm{b}\))は知らない反応が多いため,後ろの物質からK,L,Mを推定する力が必要となります.
問\(3\):スルホン化
問題文に与えられた図\(2\)からK,Lを推定するには,Nから逆算していく必要があります.
このような逆算をしながら構造式を推定する問題のワザは\(\rm{C}\)数に着目して,炭素骨格を決めていく!ことです.
まず初めに\(\rm{C}\)数に着目します.\(\rm{C}\)数が同じであれば炭素骨格は同じであるとわかり,さらにそこからより詳細な官能基などに着目していきます.もし\(\rm{C}\)数が異なっていれば,それを特定できるような情報が問題文のどこかに隠れているということになります.
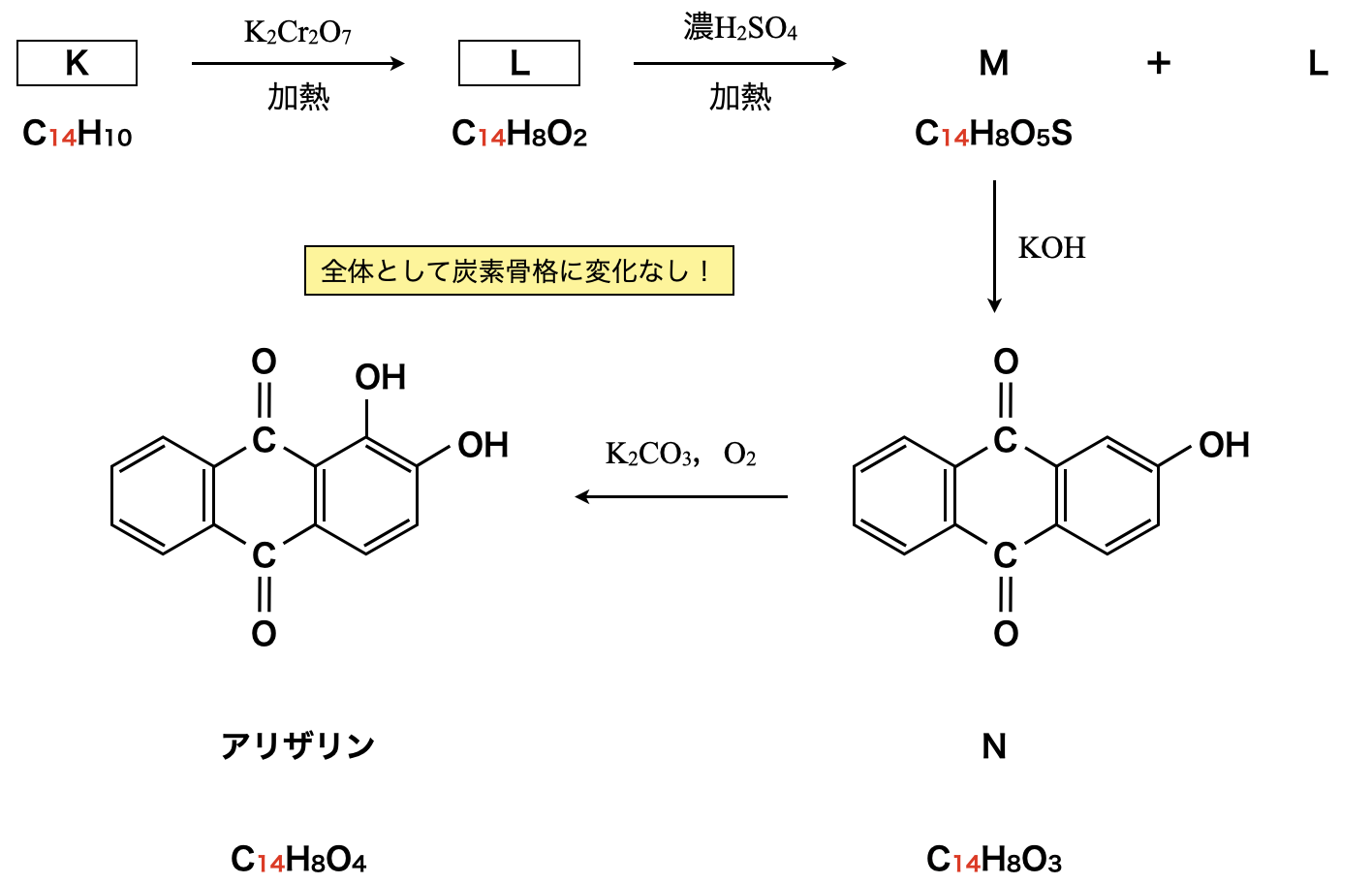
今回の場合で\(\rm{C}\)数に着目すると,K→Nまですべて\(\rm{C}\)数が\(14\)なので,炭素骨格は変化していないことがわかります.
次に,細かくみていきましょう.
M→Nで\(\rm{SO_2}\)減少しており,この\(\rm{SO_2}\)はL→Mの操作で導入された官能基であると推測できます.濃\(\rm{H_2SO_4}\)を使う官能基といえば,スルホ基(\(\rm{-SO_3H}\))を思い出せるようにしておきましょう!この推測をもとに,問題の状況を整理していきます.
L→Mでスルホン化され,\(\rm{-H}\)→\(\rm{-SO_3H}\)になるので,確かに\(\rm{SO_3}\)分増加しており,M→Nでアルカリ融解され,\(\rm{-SO_3H}\)→\(\rm{-OH}\)で\(\rm{SO_2}\)分減少しています.これは問題文の分子式に当てはまっていますね!
下の図の中で,点線の矢印は逆向きの反応を表しています.(考え方を表すためにこのような表記にしています.)
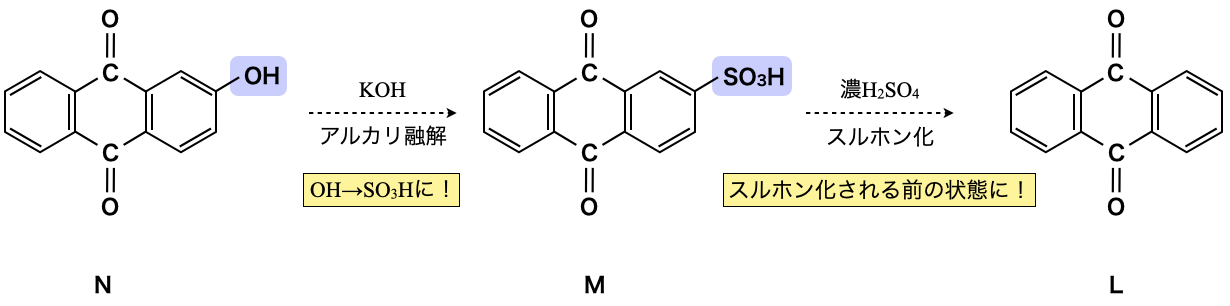
このとき,分子式から官能基以外の部分については変化がないと考えてよいでしょう.これからLとMの構造を決定できます.
この反応で出てきたアルカリ融解についてもしっかりと復習しておきましょう.下の記事のベンゼンスルホン酸→フェノール生成のところでしっかりと解説しているので,ぜひ読んでみてください!

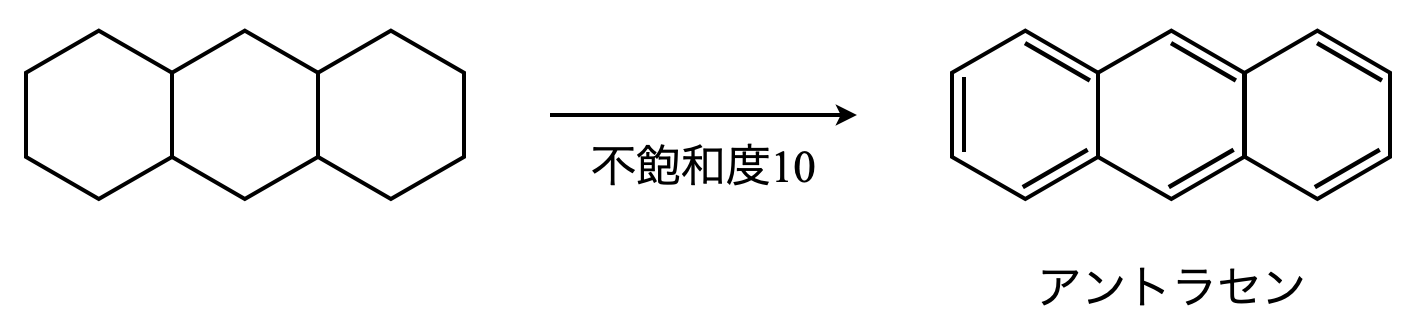
次に,Kについてみていきましょう.先ほど見たように\(\rm{C}\)数に変化がないので,炭素骨格は同じになります.
Kは炭化水素(\(\rm{C}\)と\(\rm{H}\)からのみなる有機化合物)なので,このままで\(\rm{OK}\)です.
これに加えて不飽和度が\(10\)なので,これを満たすように二重結合を加えていけば\(\rm{OK}\)です.このようにしてできたKはアントラセンという物質です.この物質は確実に覚えておいてくださいね!
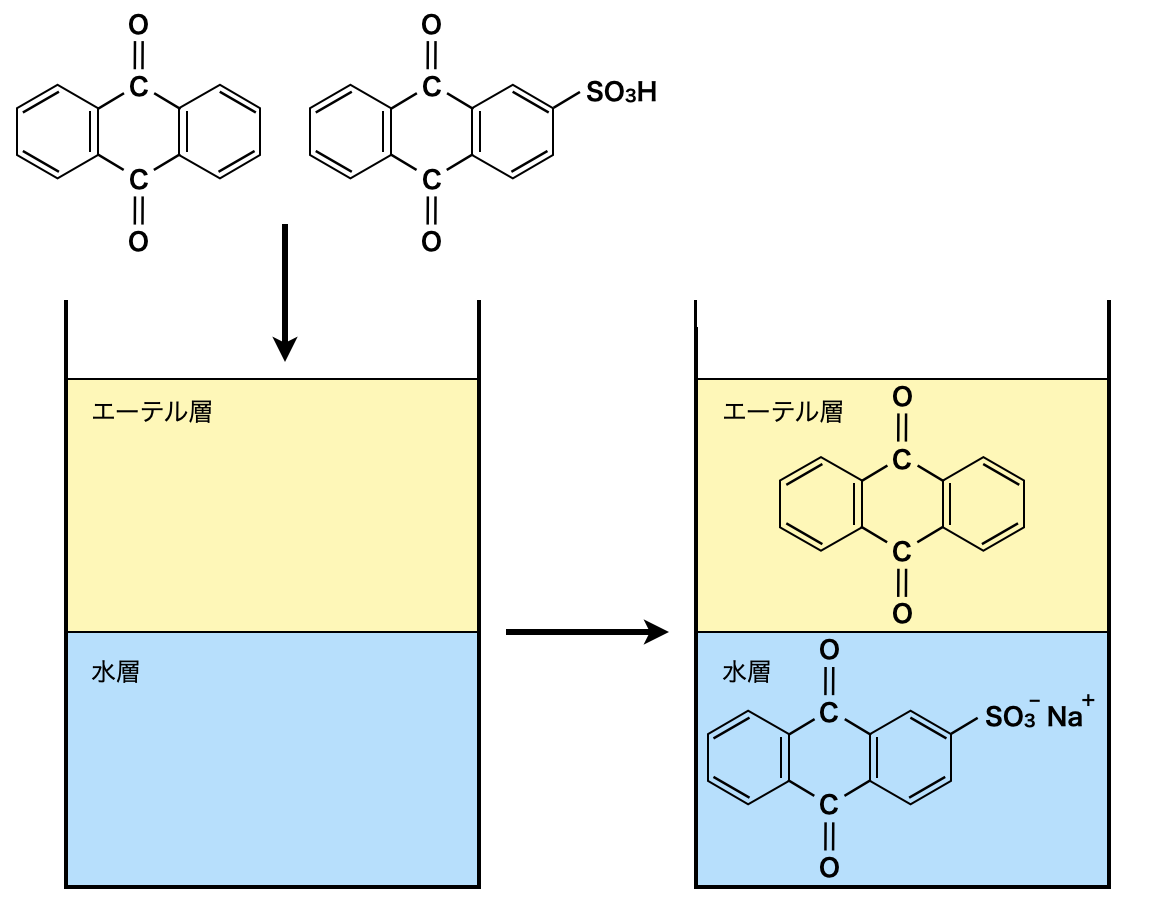
問\(4\):芳香族の分離
芳香族の分離に関する問題です.
この問題は分離の基本がわかっていれば解くことができますよ!その基本についてはこちらの記事をどうぞ.

LとMの混合物に\(\rm{NaOH}\)を加えると,Mにある\(\rm{-SO_3H}\)基が中和され,\(\rm{-SO_3^-}\)となって\(\rm{NaOH}\)水溶液に溶解します.Lについては中和される部分がないため,エーテル層に溶けます.そのためMのナトリウム塩が水層に溶解し,以下のようになります.
問\(5\):モル計算
簡単なモル計算です.
最後の方は難しそうと思ってやめてしまう方も多いかもしれませんが,案外最後の方に簡単な問題もあります.簡単な問題を取りこぼさないように,問題を見極める力を養いましょう!
構造式からアリザリンの分子式は\(\rm{C_{14}H_8O_4}\)(分子量 \(240\))です.
炭素と水素のみからなるアリザリンを完全燃焼させると,\(\rm{CO_2}\)と\(\rm{H_2O}\)のみになるので,\(\rm{CO_2}\)の生成量を考えるには,\(\rm{C}\)数に着目すれば\(\rm{OK}\)です.アリザリン(\(\rm{C_{14}H_8O_4}\))の\(\rm{C}\)数が\(14\)なので,アリザリン\(\rm{:CO_2=1:14}\)(モル比)となることがわかります.
\(\large \frac{960}{240} \small × 14 × 44 = 2464\ \rm{g} = 2.5\ kg\)
最後に
最後まで閲覧していただきありがとうございました.
本記事の内容についてわからない点があれば,遠慮なく質問していただければと思います.
(\(\rm{Twitter}\):chem_story1)
京都大学の化学は難問が多いと言われますが,その分多くのことを学ぶことができます.
皆さんの学習の一助になれば幸いです.
今回の問題についてはこちらの参考書に載っています!もっていない方はぜひ自分の勉強のお供にしましょう!
- 題名:入試詳解25年 化学2019〜1995
- 出版社:駿台文庫
- 価格(税込):2,530円
- 特徴:化学の本質を掴むことのできるシリーズ

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/21495128.dd49cb47.21495129.e09ddf2d/?me_id=1294271&item_id=10035482&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fgakusan%2Fcabinet%2Fbook_image3%2F9784796123754.jpg%3F_ex%3D240x240&s=240x240&t=picttext)



コメント